Содержание
- 2. Назовите вещества Наркоз: хлороформ CHCl3 → фторотан (галотан) СHClBr-CF3 Тушение пожаров: четыреххлористый углерод CCl4 → бромхлорметан
- 3. Получение хлорирование и бромирование алканов: SR присоединение HHal и Hal2 по кратной связи: АЕ или AR
- 4. Строение и свойства Rδ+-Halδ- Молекула полярна, на атоме С рядом с галогеном понижена электронная плотность →
- 5. SN E
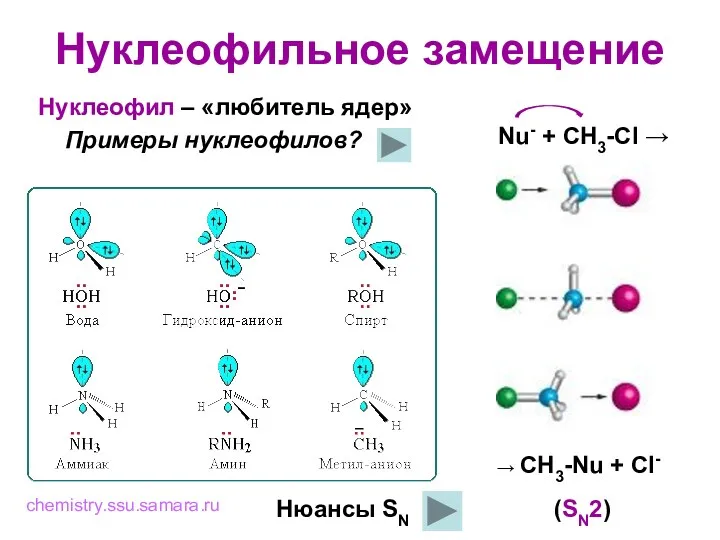
- 6. Нуклеофильное замещение Нуклеофил – «любитель ядер» Примеры нуклеофилов? Nu- + CH3-Cl → chemistry.ssu.samara.ru (SN2) Нюансы SN
- 7. Примеры SN RHal + NaOH → ROH + NaHal (to) R-CHHal2 → R-CH=O, R-CHal3 → R-COOH
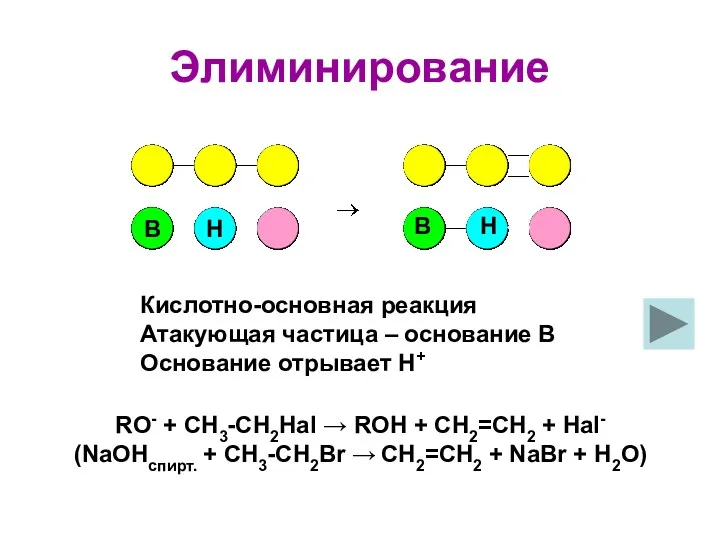
- 8. Элиминирование Кислотно-основная реакция Атакующая частица – основание В Основание отрывает Н+ RO- + CH3-CH2Hal → ROH
- 9. Магнийорганический синтез RHal + Mg = Rδ-[MgHal]δ+ (в эфире) реактив Гриньяра, серое вещество кетон → третичный
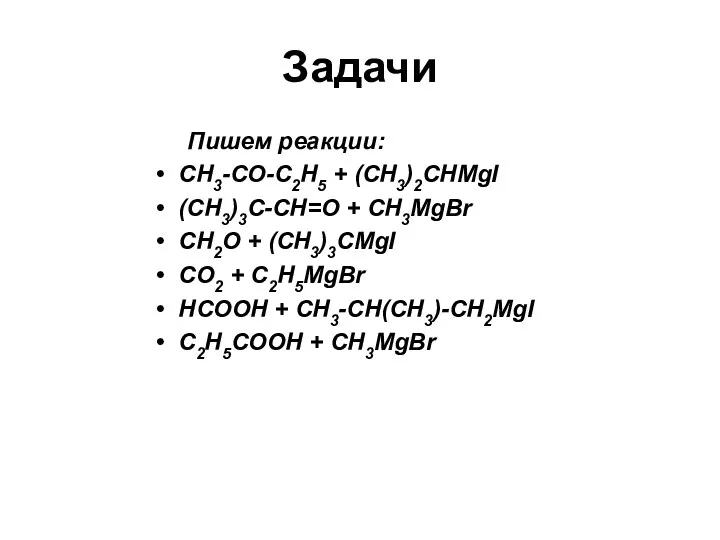
- 10. Задачи Пишем реакции: CH3-CO-C2H5 + (CH3)2CHMgI (CH3)3C-CH=O + CH3MgBr CH2O + (CH3)3СMgI CO2 + C2H5MgBr HCOOH
- 11. Другие реакции Реакция Вюрца 2RHal + 2Na → R-R + 2NaHal Образование металлоорганических соединений RHal +
- 12. Нитросоединения (бонус) Получение: RH + HNO3 → RNO2 + H2O (to, SR) RHal + KNO2 →
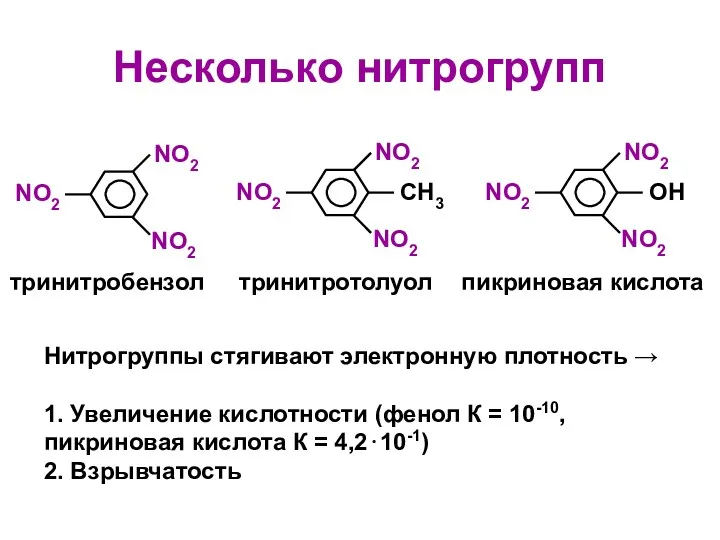
- 13. Несколько нитрогрупп NO2 NO2 NO2 СH3 NO2 NO2 NO2 OH NO2 NO2 NO2 тринитробензол тринитротолуол пикриновая
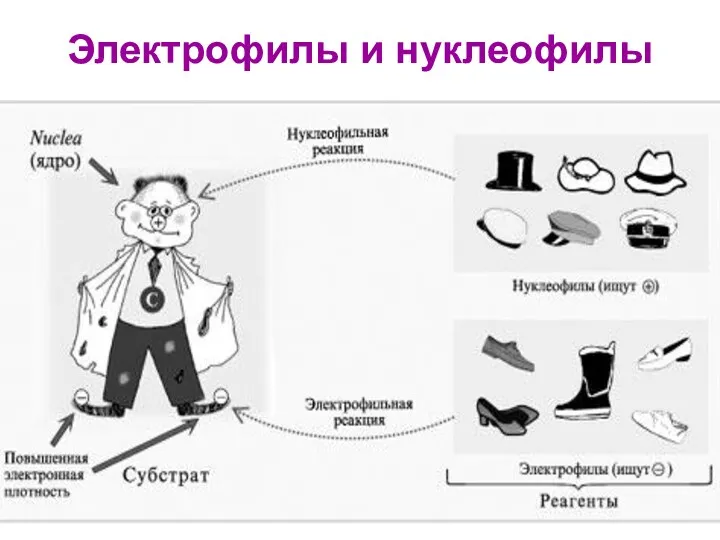
- 14. Электрофилы и нуклеофилы
- 16. Нюансы SN Активность в SN: RF (→ уменьшается энергия связи) Скорость SN1 у RHal: метил (→
- 17. Нюансы элиминирования Конкуренция SN и Е Элиминированию способствуют: - сильное основание – слабый нуклеофил - стерические
- 18. Ароматические нитросоединения Динитробензол versuchschemie.de Орто-, мета- и пара-нитротолуолы seilnacht.com
- 20. Скачать презентацию




![Магнийорганический синтез RHal + Mg = Rδ-[MgHal]δ+ (в эфире) реактив](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/337715/slide-8.jpg)






 Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Углерод и его свойства
Углерод и его свойства Производство метанола. Физико-химические основы синтеза метанола. Современные катализаторы
Производство метанола. Физико-химические основы синтеза метанола. Современные катализаторы The production of stable isotopes
The production of stable isotopes Человек в мире веществ, материалов и химических реакций. Химия и пища
Человек в мире веществ, материалов и химических реакций. Химия и пища Уральские самоцветы
Уральские самоцветы Синтетические моющие средства
Синтетические моющие средства Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ)
Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ) Классификация химических реакций
Классификация химических реакций Химиялық өнеркәсіп
Химиялық өнеркәсіп Лекция Атомное строение твердых тел. 1-01
Лекция Атомное строение твердых тел. 1-01 Сера и ее важнейшие соединения
Сера и ее важнейшие соединения Алотропні модифікації фосфору
Алотропні модифікації фосфору Молекулярно-массовые характеристики высокомолекулярных соединений
Молекулярно-массовые характеристики высокомолекулярных соединений Кристаллография, кристаллохимия, минералогия
Кристаллография, кристаллохимия, минералогия Кремний
Кремний Горные породы Крыма
Горные породы Крыма Химия элементов 16 (VIA) группы
Химия элементов 16 (VIA) группы Химическая термодинамика. Термохимия
Химическая термодинамика. Термохимия Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Минералы и их свойства
Минералы и их свойства Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Ионная связь
Ионная связь Кислоты
Кислоты Наглядное пособие Динамические модели. Химическое равновесие в растворах
Наглядное пособие Динамические модели. Химическое равновесие в растворах Многоатомные спирты (10 класс)
Многоатомные спирты (10 класс) Высокомолекулярные соединения. Общий курс
Высокомолекулярные соединения. Общий курс