Содержание
- 2. УЭ – 1 Входной контроль Цель: определить исходный уровень знаний необходимых для изучения модуля; 1. Приведите
- 3. УЭ – 2. Скорость химической реакции. Цель: дать понятие «Скорость химической реакции»,вывести формулы для вычисления средней
- 4. Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов -
- 5. Скорость реакции определяется изменением количества вещества в единицу времени. - изменение молярной концентрации;
- 6. Задача на применение знаний о «Скорости химических реакций» Химическая реакция протекает в растворе, согласно уравнению: А+В
- 7. Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -2 балла, максимальное количество баллов
- 8. УЭ – 3. Факторы, влияющие на скорость химической реакции Цель: выявить зависимость скорости химических реакций от
- 9. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют факторы, влияющие на скорость химической реакции. Х О
- 10. Теория столкновений. Основная идея теории: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией. Выводы:
- 11. 1. Природа реагирующих веществ. Известно, что для полного гниения брошенной в лесу газеты потребуется год, для
- 12. 2. Температура Определите, как изменится скорость некоторой реакции: а) при повышении температуры от 10° до 50°
- 13. Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -2балла, максимальное количество баллов -
- 14. 3. Концентрации реагирующих веществ. Для реакции: 2СО + О2 = 2СО2 запишите выражение закона действующих масс
- 15. Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов -
- 16. 4. Действие катализатора Неосуществимых реакций нет, а если реакция не идёт, то пока ещё не найден
- 17. Применение ферментов
- 18. УЭ – 4 Лабораторная работа. Цель: экспериментально доказать зависимость скорости химических реакций от различных факторов. Внимание!
- 19. УЭ – 5. Графический диктант Цель: проверить уровень усвоения знаний. Выполните графический диктант, заполните таблицу (отметьте
- 20. УЭ – 6. Рефлексия. Домашнее задание. Цель: подвести итоги урока, выставить оценки, определить себе домашнее задание.
- 21. УЭ – 6. Рефлексия. Домашнее задание. Цель: подвести итоги урока, выставить оценки, определить себе домашнее задание.
- 23. Скачать презентацию
 Химические свойства солей
Химические свойства солей Механизм реакции в органической химии
Механизм реакции в органической химии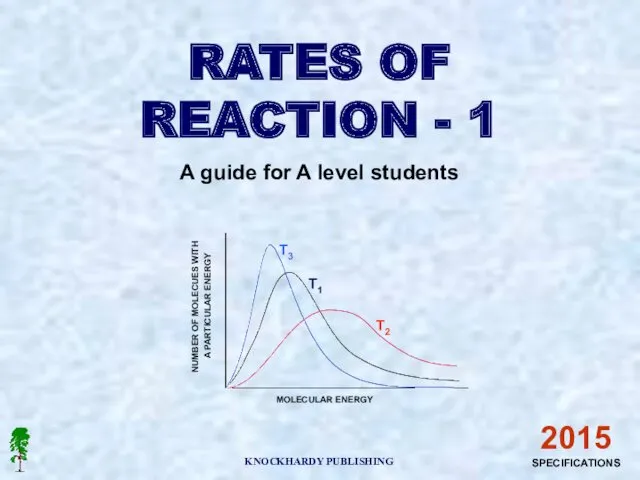 Number of molecues with a particular energy
Number of molecues with a particular energy Минералы. Свойства минералов
Минералы. Свойства минералов Исследование снежного покрова на территории пришкольного участка
Исследование снежного покрова на территории пришкольного участка Застосування неметалів
Застосування неметалів Етери. Ізомерія та номенклатура
Етери. Ізомерія та номенклатура Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть
Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть Функціональні матеріали для високоенергетичної електроніки. (Лекція 1)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 1) Углеводы Cn(H2O)m
Углеводы Cn(H2O)m ГИА-9 Химия. А10
ГИА-9 Химия. А10 Курс Материаловедение. Введение
Курс Материаловедение. Введение Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали, галогени, інертні гази
Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали, галогени, інертні гази Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Crystal structure and surface phase composition of palladium oxides thin films for gas sensors
Crystal structure and surface phase composition of palladium oxides thin films for gas sensors Особенности химического состава клетки
Особенности химического состава клетки Классы органических соединений
Классы органических соединений Химические соединения в организме человека
Химические соединения в организме человека Фосфор и его соединения (9 класс)
Фосфор и его соединения (9 класс) Сполуки основних класів у будівництві і побуті
Сполуки основних класів у будівництві і побуті Азот
Азот Період як особлива синтаксична конструкція
Період як особлива синтаксична конструкція Компоненты, попадающие в продукты питания из минеральных и других удобрений
Компоненты, попадающие в продукты питания из минеральных и других удобрений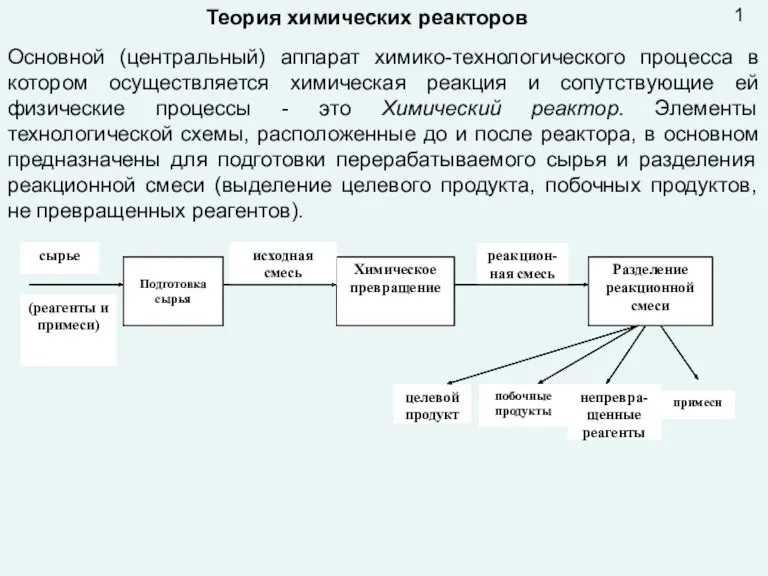 Презентация лекция 9 Реактора
Презентация лекция 9 Реактора Классификация химических реакций в органической химии
Классификация химических реакций в органической химии Енергетичний баланс процесу горіння
Енергетичний баланс процесу горіння Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Коллоидная химия
Коллоидная химия