Содержание
- 2. Модули I II III IV 1-ая часть курса 0...25 баллов= Оц1 0...25 баллов=Оц2 (0-5 – «1»
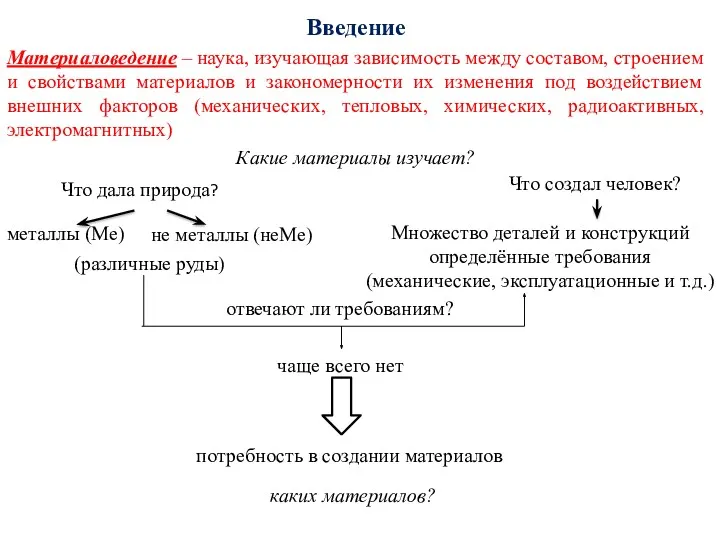
- 3. Введение Материаловедение – наука, изучающая зависимость между составом, строением и свойствами материалов и закономерности их изменения
- 4. Конструкционные материалы – это такие материалы, из которых изготавливаются различные виды конструкций и деталей машин, воспринимающих
- 5. СВОЙСТВА СТРОЕНИЕ (СТРУКТУРА) ХИМИЧЕСКИЙ СОСТАВ А как повлиять на хим-ий состав и структуру? Этапы технологии металлов:
- 6. I часть «Закономерности формирования структуры и способы управления свойствами материалов» 3 главы ( I модуль )
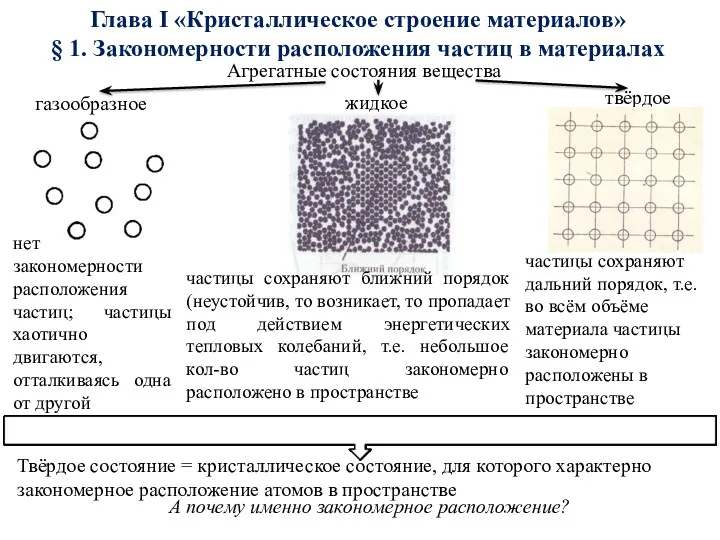
- 7. Глава I «Кристаллическое строение материалов» § 1. Закономерности расположения частиц в материалах Агрегатные состояния вещества газообразное
- 8. § 2. Устойчивость кристаллического состояния взаимодействие электронов и «+» ядра взаимодействие «+» ядер соседних атомов Fприт
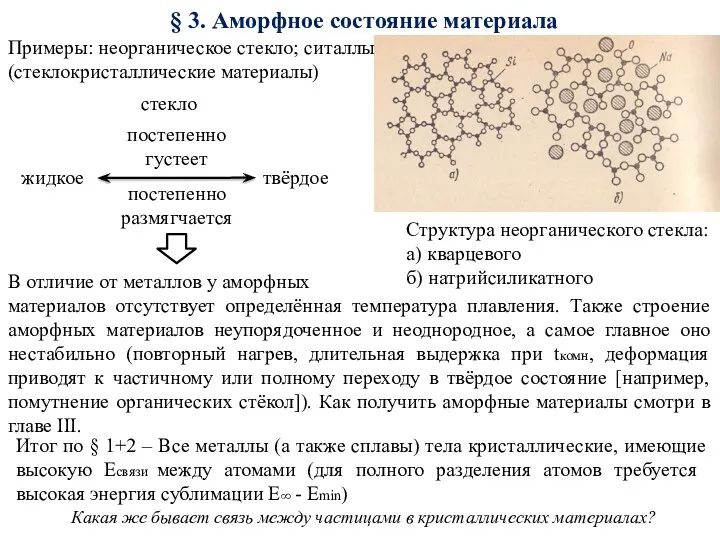
- 9. § 3. Аморфное состояние материала твёрдое жидкое стекло Структура неорганического стекла: а) кварцевого б) натрийсиликатного Примеры:
- 10. § 4. Типы связей в кристаллических материалах А. Молекулярная связь (силы Ван-дер-Ваальса): - между атомами/молекулами/ионами (H2,
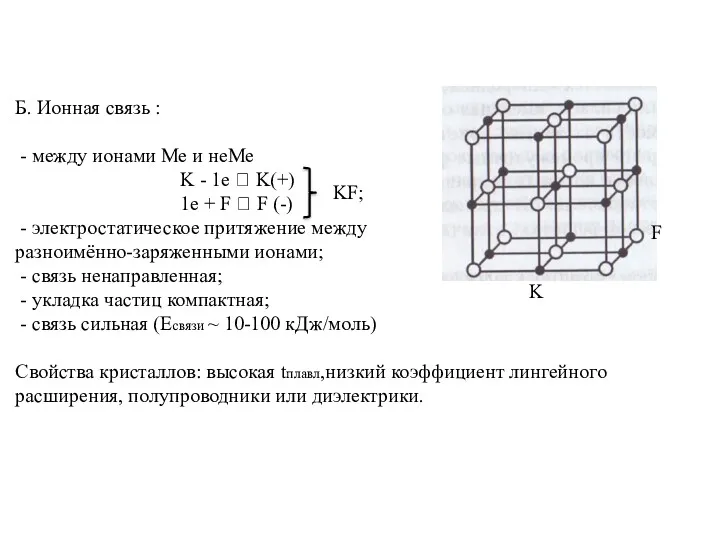
- 11. Б. Ионная связь : - между ионами Ме и неМе K - 1e ? K(+) 1e
- 12. В. Ковалентная связь - между элементами подгрупп IVB-VIB: C, Se, Si, Ge, т.е. металлоиды и полупроводники,
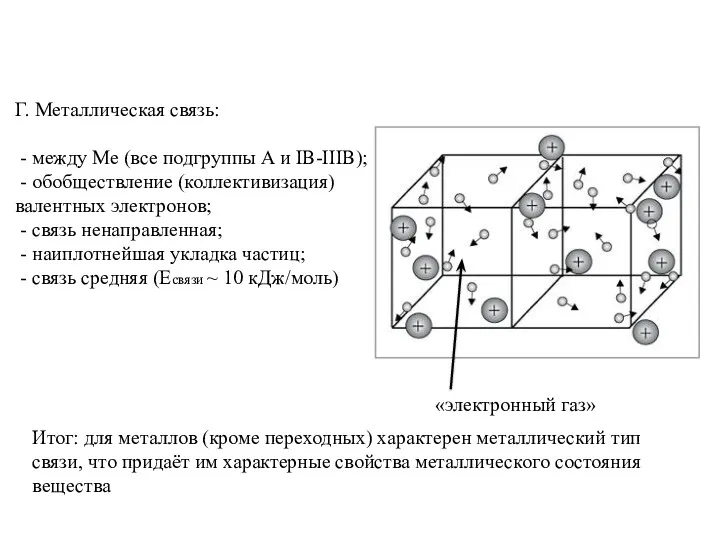
- 13. Г. Металлическая связь: - между Ме (все подгруппы А и IB-IIIB); - обобществление (коллективизация) валентных электронов;
- 14. Свойства металлического состояния высокая пластичность (т.к. есть периодичность строения и связь ненаправленная) высокая электропроводность (т.к. есть
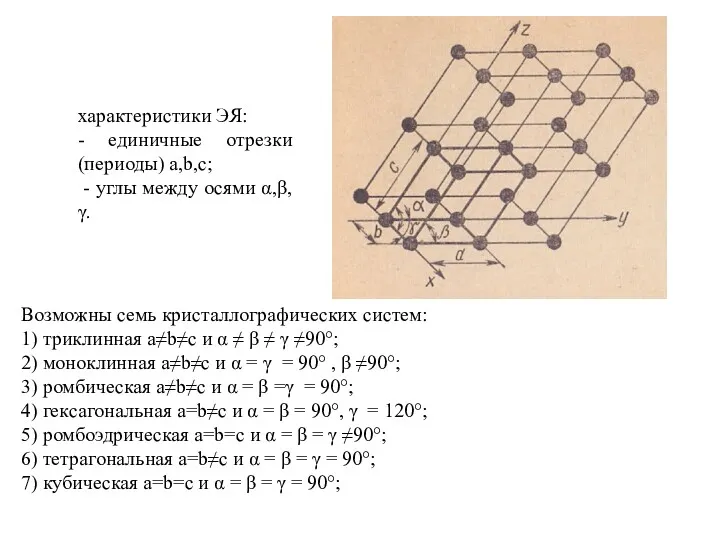
- 15. § 5. Атомно-кристаллическая структура Ме (идеальный случай) Атомно-кристаллическая структура – это взаимное расположение атомов (т.е. ионов)
- 16. характеристики ЭЯ: - единичные отрезки (периоды) a,b,c; - углы между осями α,β,γ. Возможны семь кристаллографических систем:
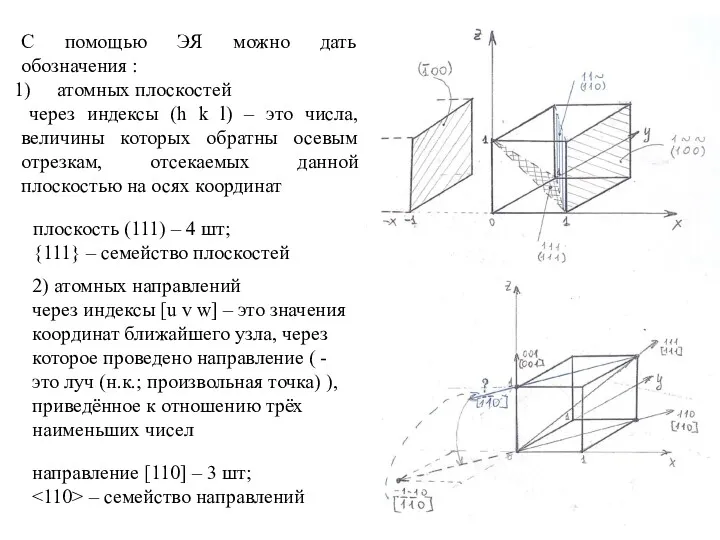
- 17. С помощью ЭЯ можно дать обозначения : атомных плоскостей через индексы (h k l) – это
- 18. КР характеризуется следующими показателями: а) n – число атомов, приходящихся на одну ЭЯ; б) плотность КР
- 19. кубическая Объёмоцентрированная (ОЦК) – V, Cr, Mo, Ta, … кубическая гранецентрированная (ГЦК) – Ni, Cu, Al,
- 20. Некоторые Ме имеют простую кубическую решётку (обозначается K6) – Si и др. Некоторые Ме имеют тетрагональную
- 22. Скачать презентацию












 Идеал газ. Молекулалы-кинетикалық теорияның негізгі теңдеуі. Молекулалық орташа квадраттық жылдамдығына есептер шығару
Идеал газ. Молекулалы-кинетикалық теорияның негізгі теңдеуі. Молекулалық орташа квадраттық жылдамдығына есептер шығару Химические уравнения. Закон сохранения массы веществ
Химические уравнения. Закон сохранения массы веществ Биохимия и молекулярная биология. Биосинтез мембранных липидов. Лекция 9
Биохимия и молекулярная биология. Биосинтез мембранных липидов. Лекция 9 Hydrochloric acid HCl
Hydrochloric acid HCl Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Гидролиз солей
Гидролиз солей Макромолекулалардың молекулалық массасы және молекулалық массалық таралу функциялары
Макромолекулалардың молекулалық массасы және молекулалық массалық таралу функциялары Физические и химические явления
Физические и химические явления Изучение упругости диссоциации карбоната кальция
Изучение упругости диссоциации карбоната кальция Курс биохимии. Биохимия крови
Курс биохимии. Биохимия крови Значення хімічних процесів у природі
Значення хімічних процесів у природі Знакомство с образцами химических средств санитарии и гигиены
Знакомство с образцами химических средств санитарии и гигиены Тұздар. Құрамы және химиялық қасиеттері
Тұздар. Құрамы және химиялық қасиеттері Застосуванння електролiзу
Застосуванння електролiзу Современные конструкционные материалы
Современные конструкционные материалы Свойства воды. Оценка качества
Свойства воды. Оценка качества Исследовательская работа на тему: Удивительные свойства воды
Исследовательская работа на тему: Удивительные свойства воды Термический анализ
Термический анализ Метаболизм нуклеотидов
Метаболизм нуклеотидов Спирты. Виды спирта
Спирты. Виды спирта Степень окисления – Условный заряд атомов химического элемента в соединении
Степень окисления – Условный заряд атомов химического элемента в соединении Химия в продуктах питания
Химия в продуктах питания Відносна густина газів
Відносна густина газів Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для
Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для Химическая термодинамика
Химическая термодинамика Альдегиды и кетоны. Циветон
Альдегиды и кетоны. Циветон Алюминий
Алюминий Виды и свойства текстильных материалов из химических волокон. 6 класс
Виды и свойства текстильных материалов из химических волокон. 6 класс