Слайд 2

Идеал газ
Идеал газ дегеніміз – молекулалары шексіз аз көлем алатын серпімді
шариктер болып табылатын және өзара әрекеттесуі тек олардың бір-бірімен тікелей немесе ыдыстың қабырғасымен соқтығысуы кезінде ғана білінетін газ болып табылады.
Есептеулерді жеңілдету үшін МКТ нақты газдардың қарапайым физикалық моделі –идеал газ моделі енгізілді.
Слайд 3
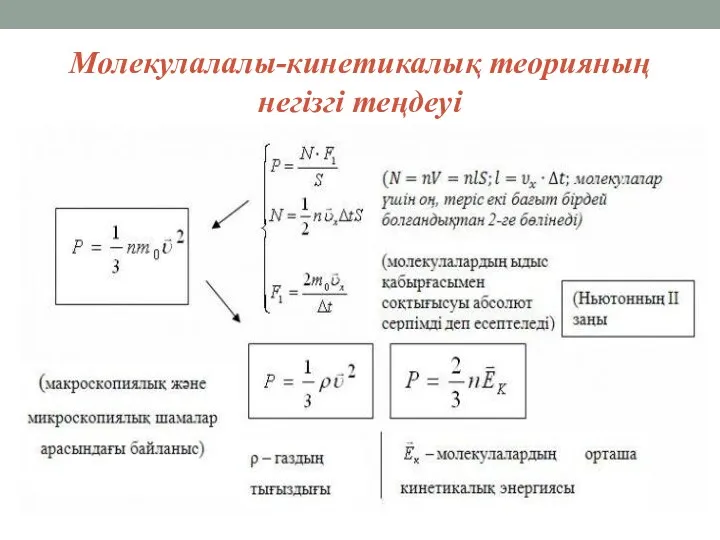
Молекулалалы-кинетикалық теорияның негізгі теңдеуі
Слайд 4

Молекулалы-кинетикалық теорияның негізгі теңдеуі:
Ол макро және микродүниелерді байланыстырып тұр;
Тәжірибе арқылы алынған
барлық газ заңдарын теориялық жолмен алуға мүмкіндік береді;
Ол микроәлемде өтіп жатқан процестер жайлы ақпара береді.
Слайд 5

Температура - идеал газ молекуласының орташа кинетикалық энергиясының өлшемi
Слайд 6

Температураның абсолюттi нөлi (Т = 0) деп молекулалық қозғалыстардың тоқтаған кезiн
(E = 0) айтады. Бұл табиғаттағы ең төмен температура. Осы анықтама негiзiнде ағылшын ғалымы У.Кельвин температураның абсолюттi шкаласы ұғымын енгiздi. Бұл шкала бойынша температура абсолюттi нөлден бастап саналады және оның бөлiктерi Цельсий шкаласының градусына тең. Абсолюттi T температура мен Цельсий шкаласы бойынша t температураның арасындағы байланыс Т = t+273 теңдiгiмен берiледi. ХБЖ жүйесiнде абсолюттi температура кельвинмен өлшенедi және ол К әрпiмен белгiленедi. Бiр кельвин Цельсий шкаласы бойынша бiр градусқа тең (1 К=1oС).
(1) өрнегiн молекулалық-кинетикалық теорияның PV/N=2/3 түрiндегi негiзгi теңдеуiмен теңестiрiп
(2)
Осылайша, абсолюттi температура газ молекулаларының жылулық қозғалысының орташа кинетикалық энергиясының өлшемi болып табылады.
Слайд 7

Слайд 8

Газ молекуласының жылдамдығы.
Газ температурасы белгiлi болса, онда оның молекуласының қозғалысының
орташа түзу сызықты жылдамдығын есептеуге болады. теңдеуiмен орташа кинетикалық энергия анықтамасынан теңдiгiмен теңестiрiп жылдамдықтың орташа квадраты үшiн келесi өрнектi аламыз: . Бұл шамадан алынған квадраттық түбiр орташа квадраттық жылдамдық деп аталады:
Слайд 9

Менделеев-Клапейрон теңдеуі
Молекулалық кинетикалық теорияның негiзгi теңдеуi p қысым, V көлем және
T температура арасында байланыс орнатуға мүмкiндiк бередi. Бұндай байланысты жазатын өрнек күй теңдеуi деп аталады. Егер газ молекуласы концентрациясының өрнегiн n=N/V=mNA/VM түрiнде алса, онда p=nkT теңдiгiнен мынау шығады:
pV = mkNAT/M.
Больцман тұрақтысының k Авогадро санына NA көбейтiндiсiн универсал газ тұрақтысы деп атап, R әрпiмен белгiлейдi:
R = k NA = 8.31·103 Дж/(кмоль·К).
Бұл енгiзiлген R тұрақтыны тағы да пайдаланып кез келген массасы m үшiн идеал газ күйiнiң теңдеуiн аламыз:
pV = mRT/M.
Бұл Менделеев-Клапейронның күй теңдеуi деп аталады.
Слайд 10

Слайд 11

Слайд 12

Слайд 13

Слайд 14

№6. T=267 К температурасы Цельсий шкаласы бойынша қандай температураға сәйкес?
а) 540 в) 6 с) -6 д) -540 е) дұрыс
жауабы жок.
№7. Идеал газдың қандай х параметрін формуласымен анықтауға болады?
а) көлем в) қысым с) температура
д) молекулалар концентрациясы
е) молекулалардың орташа квадраттық жылдамдығы
№8. Авогадро тұрақтысы:
а) NA≈6·1023моль-1. в) NA≈0,6·1023моль-1.
с) NA≈6·1023моль. д) NA≈1,38·1023моль-1.
е) NA≈8,31*1023моль-1.
№9. Газдың абсолюттік температурасын 3 есе арттырса молекулалардың орташа квадраттық жылдамдығы қалай өзгереді?
а) 3 есе көбейеді в) 9 есе көбейеді
с) 6 есе көбейеді д) есе көбейеді
е) 2 есе көбейеді
№10. Герметикалық жабық ыдыста су және су буы бар. Суды қыздырғанда су буы молекулаларының концентрациясы қалай өзгереді?
а) артады
в) кемиді
с) өзгермейді
д) бастапқыда кемиді, кейін артады
е) бастапқыда артады, кейін кемиді













 Фенол қосылыстары
Фенол қосылыстары Антибиотики как ЛС
Антибиотики как ЛС Металлы и неметаллы
Металлы и неметаллы Основи. Гідроксиди Натрію і Кальцію
Основи. Гідроксиди Натрію і Кальцію Нобелевская премия по химии
Нобелевская премия по химии Высокоэффективная жидкостная хроматография
Высокоэффективная жидкостная хроматография Органические вещества
Органические вещества Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета
Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета Реакции ионного обмена в растворах электролитов. рH раствора как показатель кислотности среды
Реакции ионного обмена в растворах электролитов. рH раствора как показатель кислотности среды Вещества и их системы. Растворы. Массовая доля растворенного вещества. 11 класс
Вещества и их системы. Растворы. Массовая доля растворенного вещества. 11 класс Құймалар. Механикалық қоспа
Құймалар. Механикалық қоспа История развития и предмет исследования супрамолекулярной химии. Классификация супрамолекулярных соединений
История развития и предмет исследования супрамолекулярной химии. Классификация супрамолекулярных соединений Кремний и его соединения. Нахождение в природе
Кремний и его соединения. Нахождение в природе Реакция обменного разложения веществ водой - гидролиз
Реакция обменного разложения веществ водой - гидролиз Оксид серы(4). Сернистая кислота и её соли
Оксид серы(4). Сернистая кислота и её соли Кафедра химической технологии лекарственных веществ (ХТЛВ)
Кафедра химической технологии лекарственных веществ (ХТЛВ) Електролітична дисоціація
Електролітична дисоціація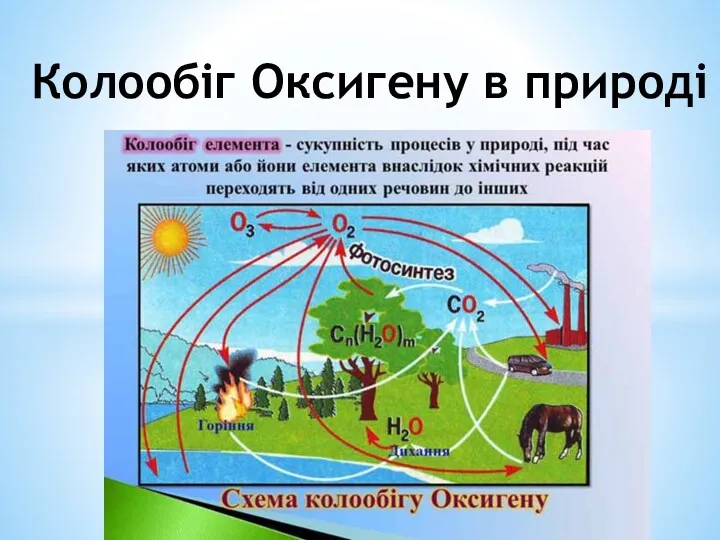 Колообіг оксигену в природі
Колообіг оксигену в природі Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Хімія металургійних процесів. Теорія сплавів
Хімія металургійних процесів. Теорія сплавів Классификация химических реакций по механизму реакции
Классификация химических реакций по механизму реакции Көмірсутектер.Олардың жіктелуі, құрылысы,изомериясы және номенклатурасы
Көмірсутектер.Олардың жіктелуі, құрылысы,изомериясы және номенклатурасы Органическая химия. Этапы развития органической химии
Органическая химия. Этапы развития органической химии Элемент свинец Рb
Элемент свинец Рb Щелочи
Щелочи Спирты. Действие этанола на организм человека (10 класс)
Спирты. Действие этанола на организм человека (10 класс) Вирощування кристалів солей
Вирощування кристалів солей Термопластичные полимеры
Термопластичные полимеры