Реакции ионного обмена в растворах электролитов. рH раствора как показатель кислотности среды презентация
Содержание
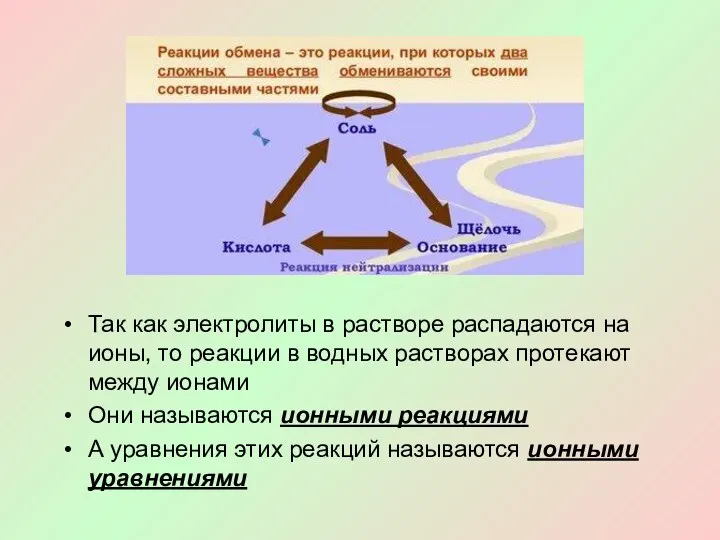
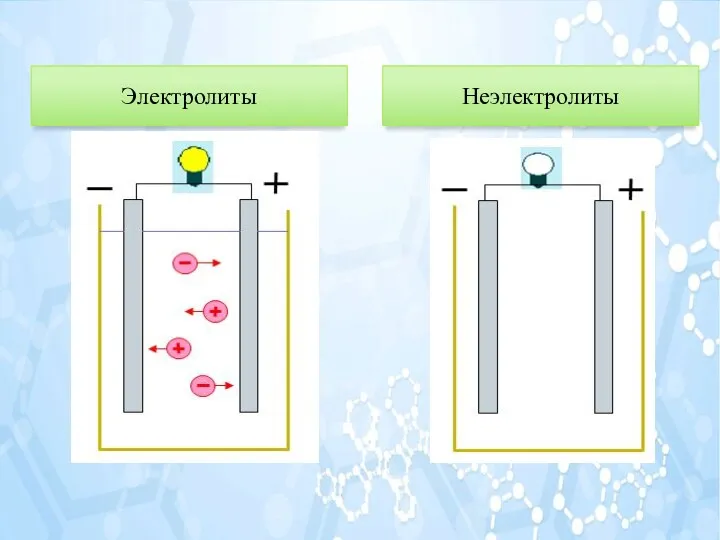
- 2. Так как электролиты в растворе распадаются на ионы, то реакции в водных растворах протекают между ионами
- 3. Реакции обмена протекают между ионами, поэтому они называются реакциями ионного обмена Реакции ионного обмена идут до
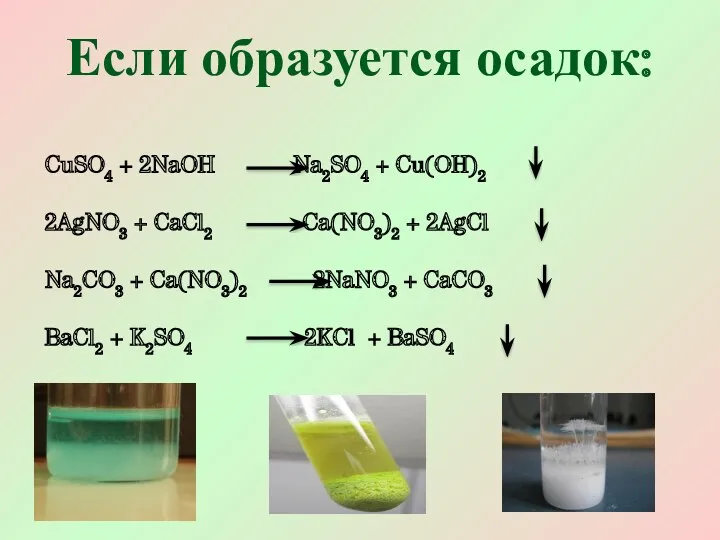
- 4. Если образуется осадок: CuSO4 + 2NaOH Na2SO4 + Cu(OH)2 2AgNO3 + CaCl2 Ca(NO3)2 + 2AgCl Na2CO3
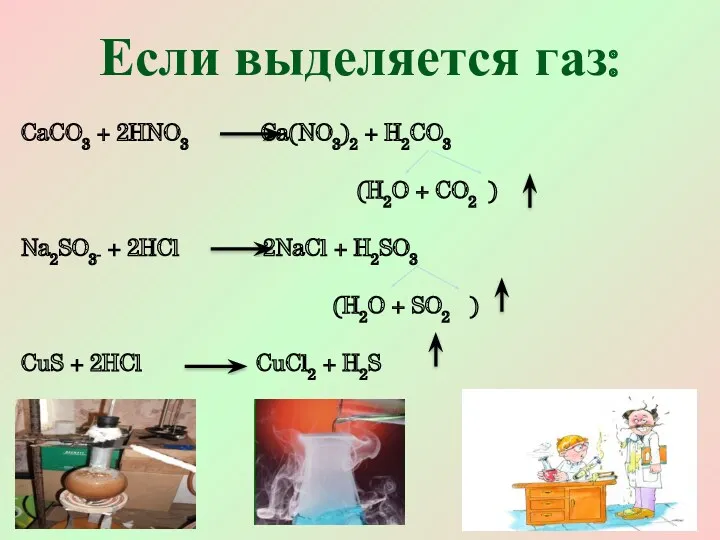
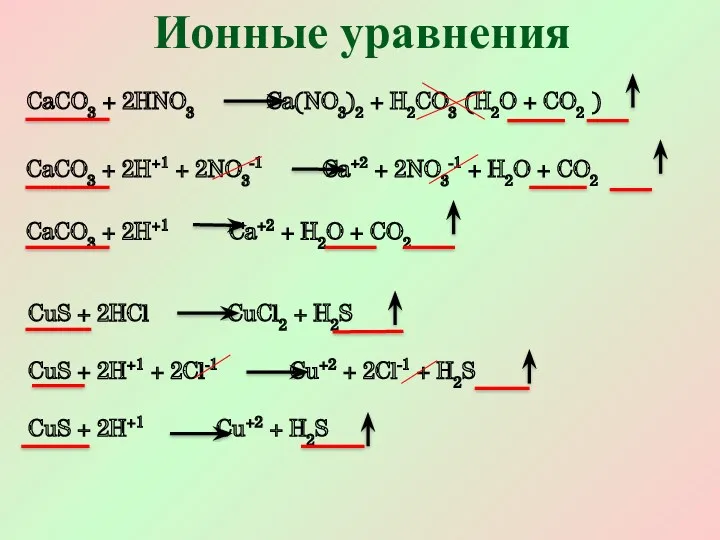
- 5. Если выделяется газ: CaCO3 + 2HNO3 Ca(NO3)2 + H2CO3 (H2O + CO2 ) Na2SO3 + 2HCl
- 6. Если образуется вода: CuO + H2SO4 CuSO4 + H2O Fe(OH)3 + 3HCl FeCl3 + 3H2O NaOH
- 7. Если НЕ образуются осадок, газ, вода, то реакции обмена обратимы: Обратимые реакции – это реакции, которые
- 8. Последовательность действий Выполнение действий 1. Записать уравнение реакции в молекулярном виде, выставить коэффициенты АlСl3 + 3
- 9. Последовательность действий Выполнение действий 2. Используя таблицу растворимости определить растворимость каждого вещества АlСl3 – р. КСl
- 10. Последовательность действий Выполнение действий 3. Составить полное ионное уравнение, записав электролиты в виде ионов, неэлектролиты в
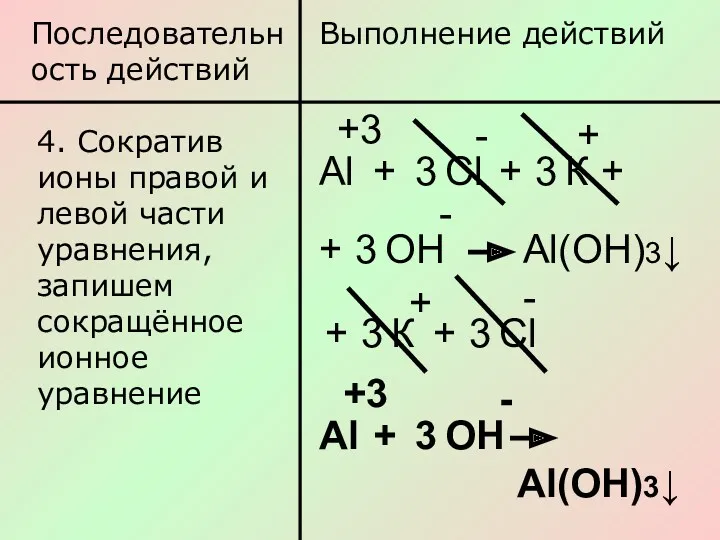
- 11. Последовательность действий Выполнение действий 4. Сократив ионы правой и левой части уравнения, запишем сокращённое ионное уравнение
- 12. Ионные уравнения Для реакций ионного обмена составляют полные и сокращенные ионные уравнения. При этом на ионы
- 13. Ионные уравнения CaCO3 + 2HNO3 Ca(NO3)2 + H2CO3 (H2O + CO2 ) CaCO3 + 2H+1 +
- 15. Теория электролитической диссоциации 1887 г. Аррениус Сванте Август (1859–1927)
- 16. Степень электролитической диссоциации (α) : α = n /N где n – число молекул распавшихся на
- 17. Диссоциация слабых электролитов СН3СООН ↔ СН3СОО- + Н+ Кравн. = Кдис. = Константа диссоциации — это
- 18. Диссоциация воды. Водородный показатель.
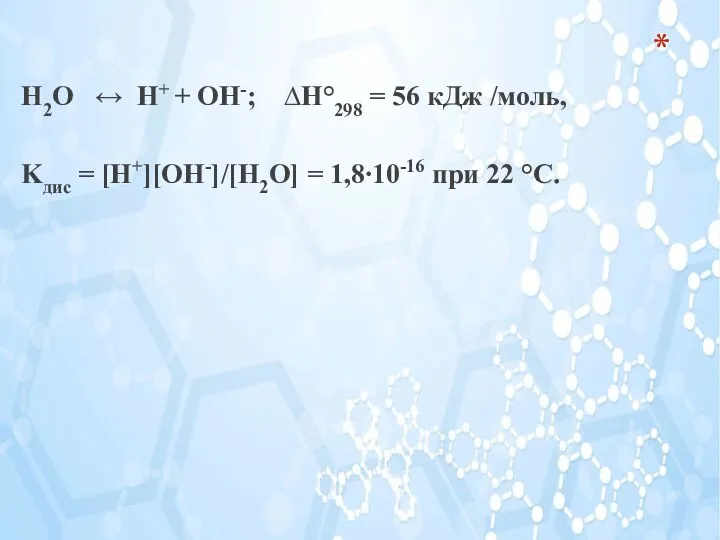
- 19. Н2О ↔ H+ + ОH-; ∆Н°298 = 56 кДж /моль, Kдис = [H+][OH-]/[H2O] = 1,8∙10-16 при
- 20. [Н2О] = 1000/18 = 55,56 моль/дм3 К дис [Н2О] = [H+] [ОН-]= 1,8∙10-16 ∙55,56 = 10-14
- 21. Кислотные и щелочные свойства растворов В кислой среде [H+]>[OH-]; [H+] > 10–7 моль/дм3, В щелочной [H+]
- 22. Водородный показатель рН Сёренсен – 1909 г. Водородный показатель рН рН= - lg[H+] pОH = -lg[ОH-]
- 23. Примеры решения задач Пример: В растворе соляной кислоты концентрация [H+] = 10-2 моль/дм3. Определите, какая среда
- 24. Пример: Дан раствор КОН концентрацией 0,001 моль/дм3. Найти рН этого раствора. Решение: КОН ↔ К+ +
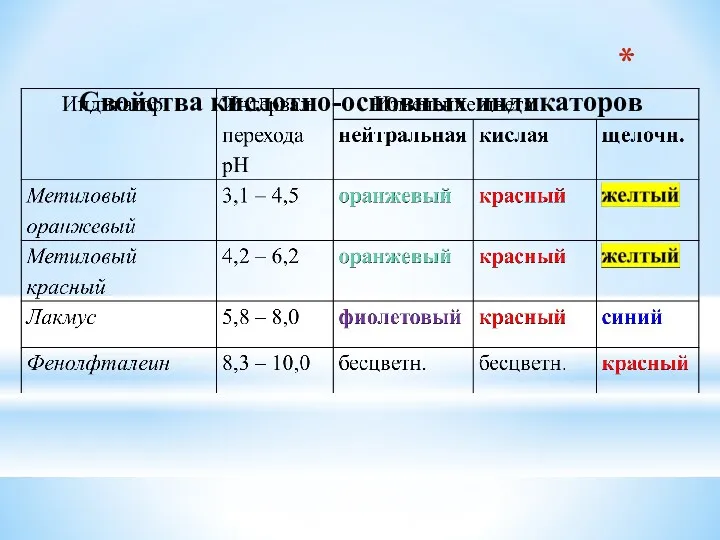
- 25. Свойства кислотно-основных индикаторов
- 27. Скачать презентацию











![[Н2О] = 1000/18 = 55,56 моль/дм3 К дис [Н2О] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/613626/slide-19.jpg)
![Кислотные и щелочные свойства растворов В кислой среде [H+]>[OH-]; [H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/613626/slide-20.jpg)

![Примеры решения задач Пример: В растворе соляной кислоты концентрация [H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/613626/slide-22.jpg)

 Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Взаимодействие кислоты с основанием (реакция нейтрализации)
Взаимодействие кислоты с основанием (реакция нейтрализации)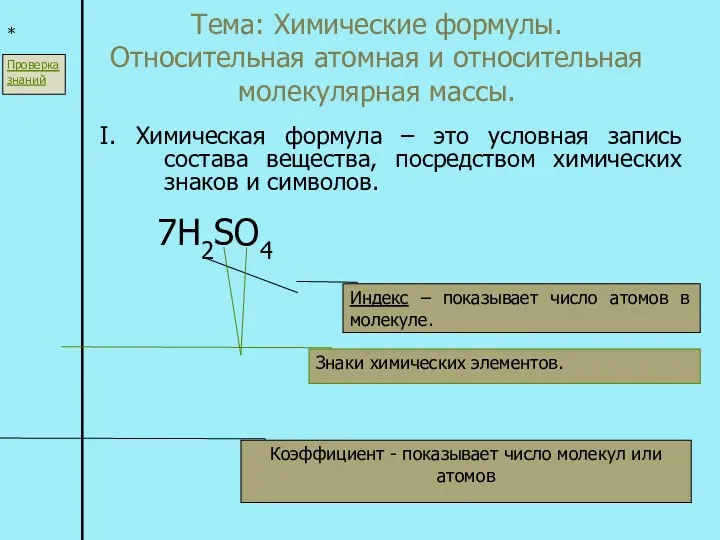 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Автомобильные пластичные смазки
Автомобильные пластичные смазки Кристаллы. Кристаллические вещества
Кристаллы. Кристаллические вещества Периодическая система химических элементов Д.И. Менделеева. Строение атома
Периодическая система химических элементов Д.И. Менделеева. Строение атома Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа
Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа Полимеры органические и неорганические
Полимеры органические и неорганические Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Электролиз
Электролиз Роль химии в современной цивилизации
Роль химии в современной цивилизации Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Осмий. Нахождение в природе
Осмий. Нахождение в природе Альдегиды и кетоны
Альдегиды и кетоны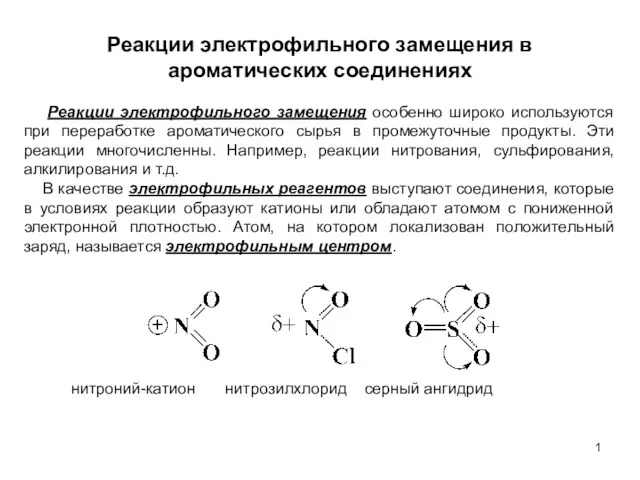 Реакции электрофильного замещения в ароматических соединениях. (Лекция 6)
Реакции электрофильного замещения в ароматических соединениях. (Лекция 6) Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты
Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар
Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Объемная доля компонента газовой смеси
Объемная доля компонента газовой смеси Органічна хімія
Органічна хімія Первичная переработка нефти
Первичная переработка нефти Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Лекция 3. Протолитические равновесия и процессы
Лекция 3. Протолитические равновесия и процессы Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования