Содержание
- 2. В зависимости от количества гидроксильных групп в молекуле спирты делят на: а) одноатомные (содержат одну гидроксильную
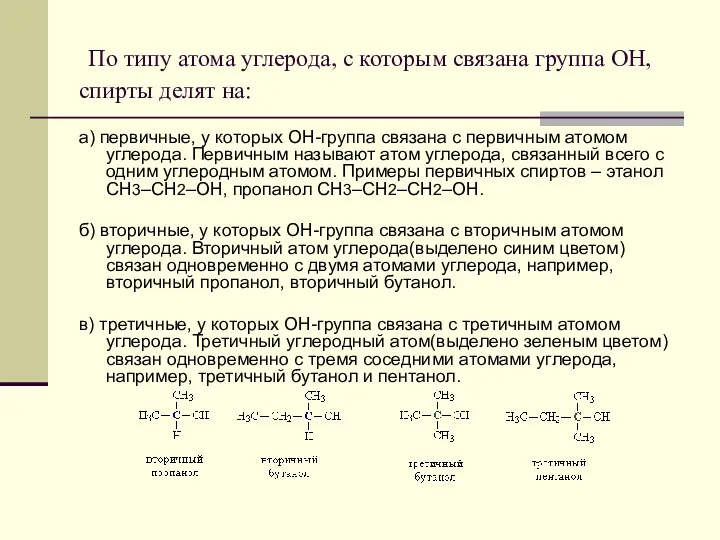
- 3. По типу атома углерода, с которым связана группа ОН, спирты делят на: а) первичные, у которых
- 4. Строение: Строение самого простого спирта — метилового (метанола) — можно представить формулами: структурные формулы электронная формула
- 5. Однако эта поляризация снижается за счет донорных свойств алкильных радикалов: Таким образом, подвижность атома водорода в
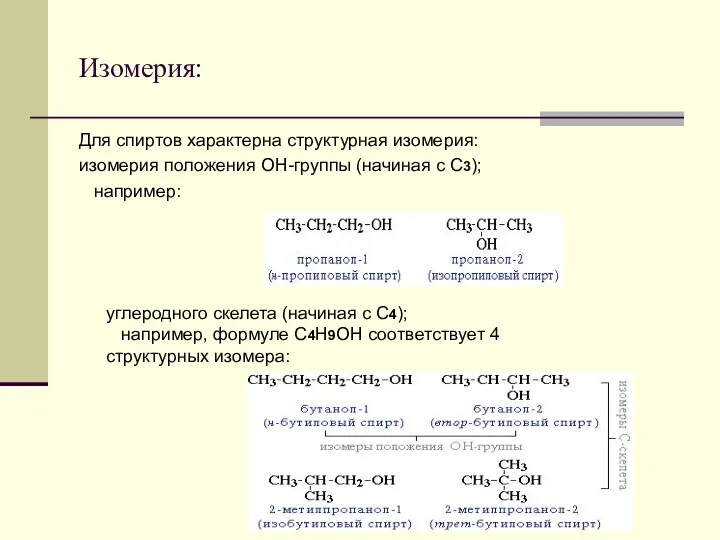
- 6. Изомерия: Для спиртов характерна структурная изомерия: изомерия положения ОН-группы (начиная с С3); например: углеродного скелета (начиная
- 7. межклассовая изомерия с простыми эфирами (например, этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3). Возможна также пространственная
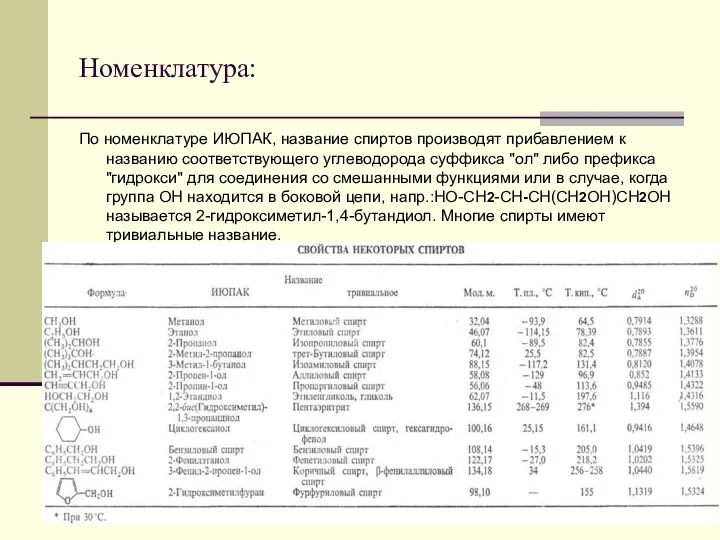
- 8. Номенклатура: По номенклатуре ИЮПАК, название спиртов производят прибавлением к названию соответствующего углеводорода суффикса "ол" либо префикса
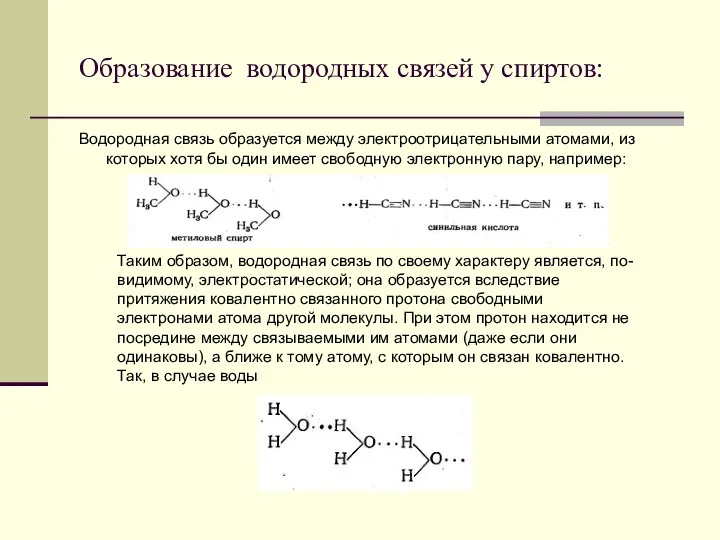
- 9. Образование водородных связей у спиртов: Водородная связь образуется между электроотрицательными атомами, из которых хотя бы один
- 10. Физические свойства: Спирты-жидкости или твердые вещества, хорошо растворимы во многих органических растворителях. Низшие алифатические спирты растворимы
- 11. Химические свойства: 1.Взаимодействие со щелочными металлами 2C2H5OH+2Na->2C2H5ONa+H2 этилат натрия 2.Взаимодействие с галогеноводородами(гидрогалогенирование) C2H5OH+HBr->C2H5Br+HOH бромэтан 3.Отщепление воды(дегидратация)
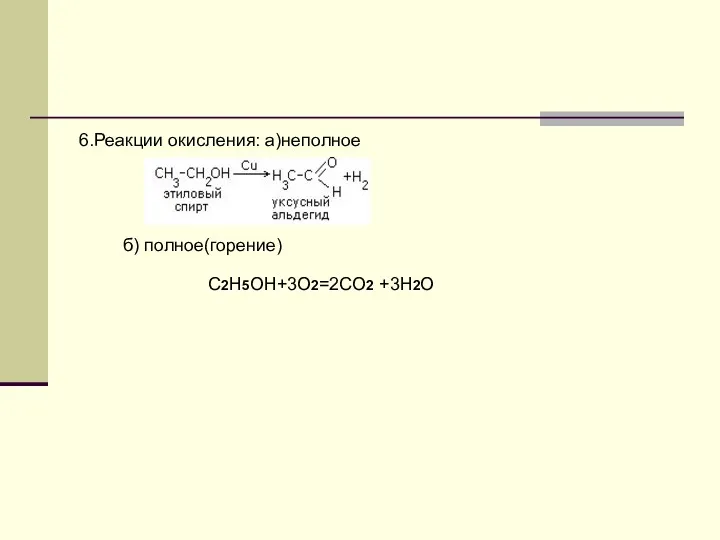
- 12. 6.Реакции окисления: а)неполное б) полное(горение) C2H5OH+3O2=2CO2 +3H2O
- 13. Получение: 1.Гидролиз моногалогенпроизводных водными растворами щелочей 2.Действие воды на этиленовые углеводороды 3.Восстановление альдегидов и кетонов 4.Сбраживание
- 14. Применение: Применяют спирты как полупродукты в синтезе различных органических соединений (формальдегида, ацетальдегида, ацетона, уксусной кислоты, диэтилового
- 15. Вредное влияние спиртов на организм человека: Из спирта делают хорошо распространенные алкогольные напитки. Распитие таких напитков
- 17. Скачать презентацию









 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей