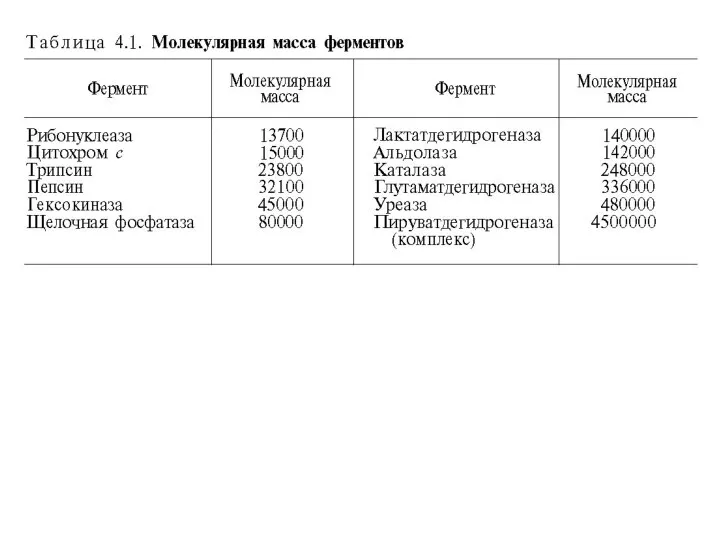
Содержание
- 2. План лекции 1. Определение 2. Классификация 3. Строение и функции 4. Механизм действия 5. Свойства 6.
- 3. Ферменты (от лат. fermentatio – брожение) или энзимы ( от греч. en zyme – в дрожжах)
- 4. Классификация ферментов по структуре: 1. Простые - состоят только из остатков аминокислот (гидролитические ферменты: пепсин, трипсин,
- 5. 1. Оксидоредуктазы – катализируют окислительно-восстановительные реакции, осуществляя перенос Н и О (Пример: каталаза, перокидаза) 2. Трансферазы
- 6. Шифр ферментов 1.1.1.27 - ЛДГ В каждом шифре 4 цифры: 1 - класс ферментов 2 -
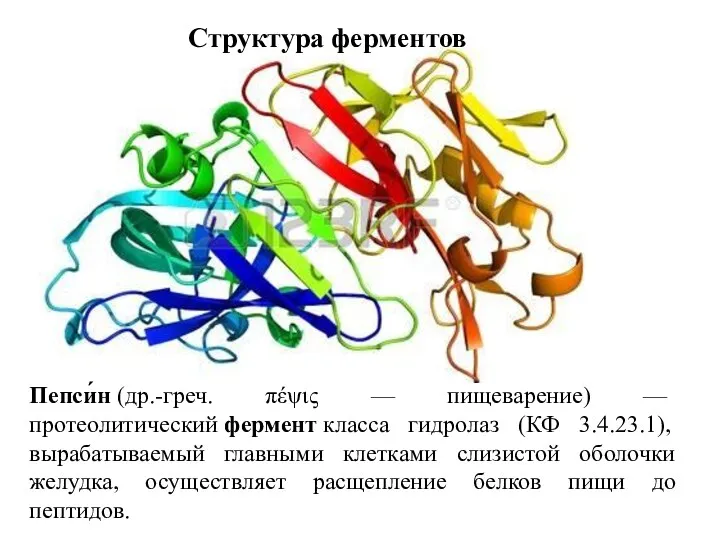
- 8. Структура ферментов Пепси́н (др.-греч. πέψις — пищеварение) — протеолитический фермент класса гидролаз (КФ 3.4.23.1), вырабатываемый главными
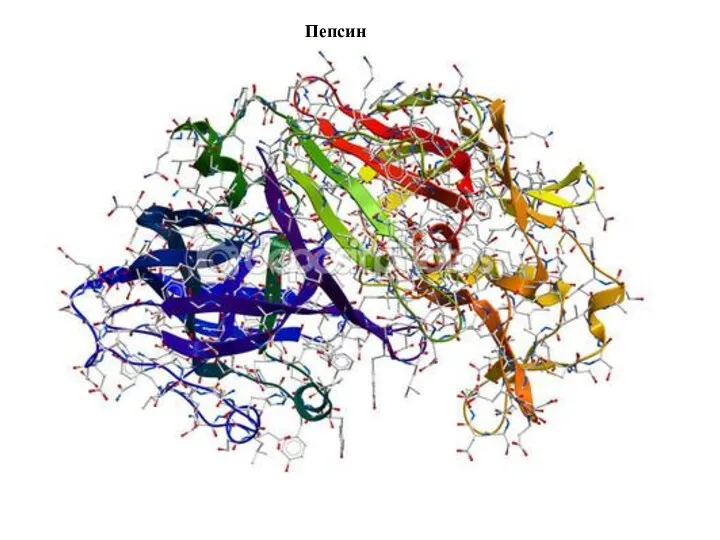
- 9. Пепсин
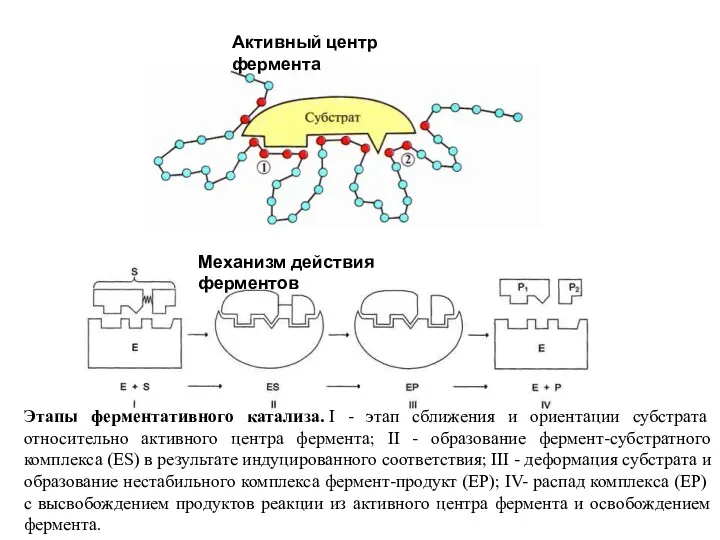
- 10. Активный центр фермента Этапы ферментативного катализа. I - этап сближения и ориентации субстрата относительно активного центра
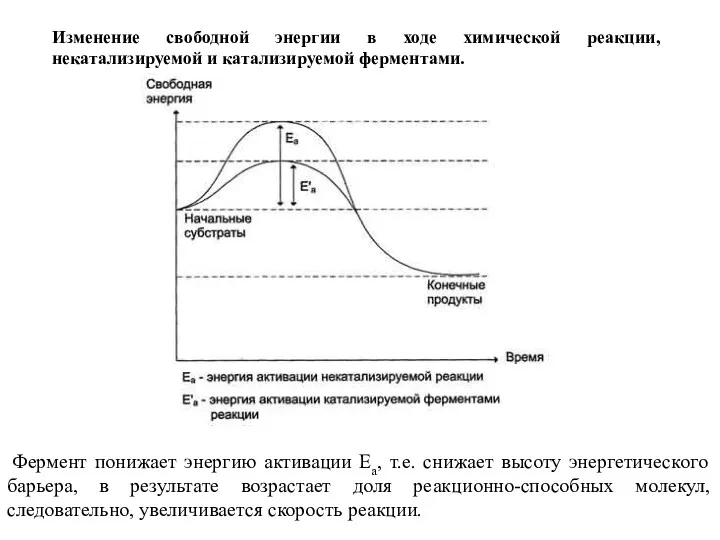
- 11. Фермент понижает энергию активации Еа, т.е. снижает высоту энергетического барьера, в результате возрастает доля реакционно-способных молекул,
- 12. Уравнение Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от
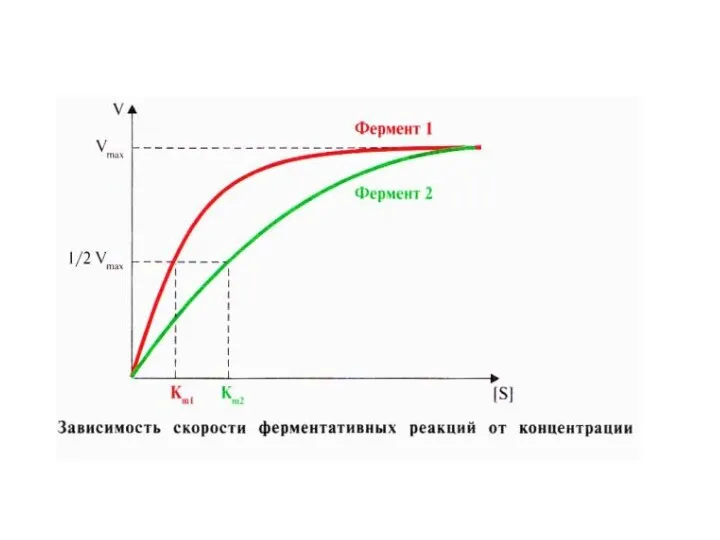
- 13. Кривая насыщения химической реакции Иллюстрирующая соотношение между концентрацией субстрата [S] и скоростью реакции V
- 14. Специфичность Ферменты проявляют высокую специфичность по отношению к своим субстратам (субстратная специфичность). Это достигается частичной комплементарностью
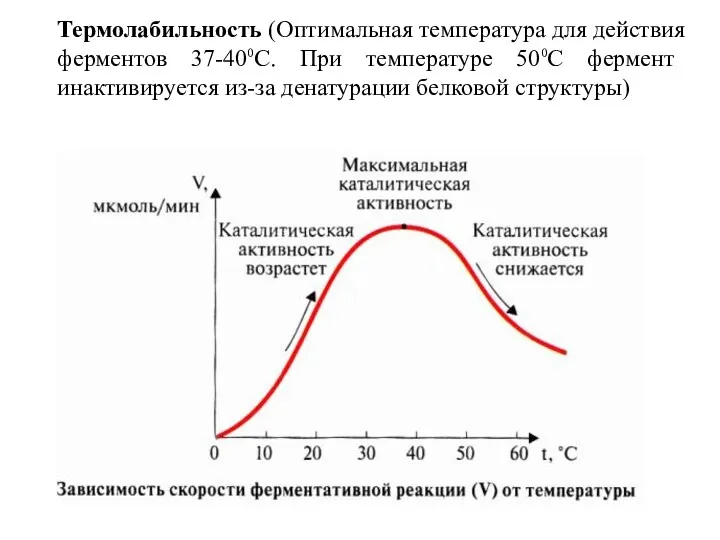
- 15. Термолабильность (Оптимальная температура для действия ферментов 37-40⁰С. При температуре 50⁰С фермент инактивируется из-за денатурации белковой структуры)
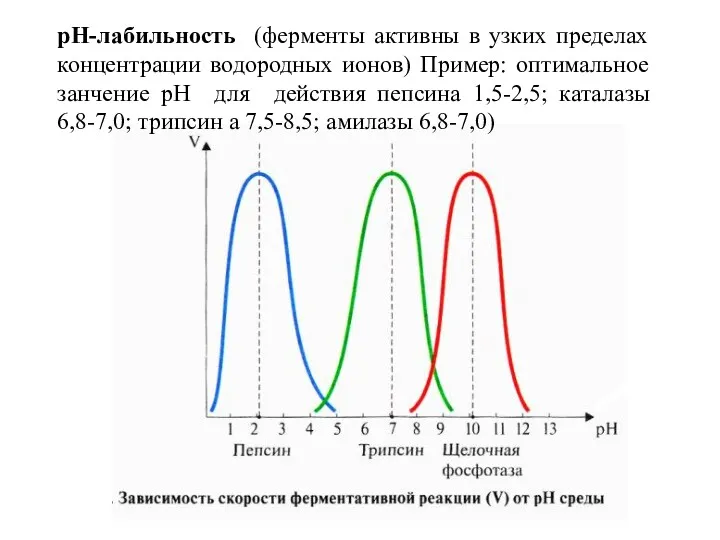
- 16. pH-лабильность (ферменты активны в узких пределах концентрации водородных ионов) Пример: оптимальное занчение рН для действия пепсина
- 18. Единицы измерения активности
- 19. Дегидрогеназы - аэробные (глютамат ДГ), - анаэробные Оксигеназы - монооксигеназы - диоксигеназы Редуктазы Оксидоредуктазы Коферменты: НАД,
- 20. Трансферазы Ферменты: Аминотрансферазы Фосфотрансферазы Гликозилтрансферазы Коферменты: АТФ, ГТФ, УДФ, ЦДФ, тетрогидрофолиевая кислота, фосфопиридоксаль, SH-Коэнзим А, ФАФС.
- 21. Гидролазы Ферменты: Пептидгидролазы: - аминопептидазы - карбоксипептидаза - дипептидазы - пепсин - трипсин - химотрипсин Гликозидазы
- 22. Лиазы Коферменты: - Фосфопиридоксаль - Тиаминпирофосфат Если разрыв связи С-С, то 4.1. С-О, то 4.2. С-N,
- 23. Изомеразы Коферменты: кобамидные коферменты (витамин B12) Цис-трансизомеразы - 5.2. Внутримолекулярные - 5.4.
- 25. Скачать презентацию






![Кривая насыщения химической реакции Иллюстрирующая соотношение между концентрацией субстрата [S] и скоростью реакции V](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/181332/slide-12.jpg)







 Плод. Строение плода
Плод. Строение плода Анатомо-физиологические особенности лимфатической системы
Анатомо-физиологические особенности лимфатической системы Профессия кинолог
Профессия кинолог Витамины группы B
Витамины группы B Разнообразие птиц
Разнообразие птиц Класс Двудольные растения. Семейства Крестоцветные и Розоцветные
Класс Двудольные растения. Семейства Крестоцветные и Розоцветные Тыңайтқыштар
Тыңайтқыштар Механизмы репарации
Механизмы репарации Птицы. Водно-подводные птицы, водоплавающие птицы, водно-воздушные птицы, наземно-водные птицы
Птицы. Водно-подводные птицы, водоплавающие птицы, водно-воздушные птицы, наземно-водные птицы Строение организма человека
Строение организма человека Избирательность действия ксенобиотиков
Избирательность действия ксенобиотиков Гипоталамус - гипофиз - бүйрекүсті бездер жүйес
Гипоталамус - гипофиз - бүйрекүсті бездер жүйес Форменные элементы крови, строение и функции эритроцитов
Форменные элементы крови, строение и функции эритроцитов Энергетический обмен. Способы питания
Энергетический обмен. Способы питания Животные леса
Животные леса Мінеральні речовини в організмі тварин
Мінеральні речовини в організмі тварин Экологическая характеристика организмов
Экологическая характеристика организмов Животные холодных стран
Животные холодных стран История изучения клетки. Клеточная теория
История изучения клетки. Клеточная теория Типы, состав, структура, свойства РНК. (Лекция 5)
Типы, состав, структура, свойства РНК. (Лекция 5) Углеводы. Строение и функции основных углеводов
Углеводы. Строение и функции основных углеводов Бактериофаги
Бактериофаги Культивирование бактерий. Выделение чистых культур
Культивирование бактерий. Выделение чистых культур Прикладные аспекты. Получение антител
Прикладные аспекты. Получение антител презентация по теме: Взаимоотношения организмов разных видов.
презентация по теме: Взаимоотношения организмов разных видов. Развитие эволюционных идей
Развитие эволюционных идей Kakie_byvayut_zhivotnye
Kakie_byvayut_zhivotnye Вегетативная нервная система
Вегетативная нервная система