Содержание
- 2. Химическая термодинамика рассматривает энергетические аспекты различных процессов и определяет условия их самопроизвольного протекания.
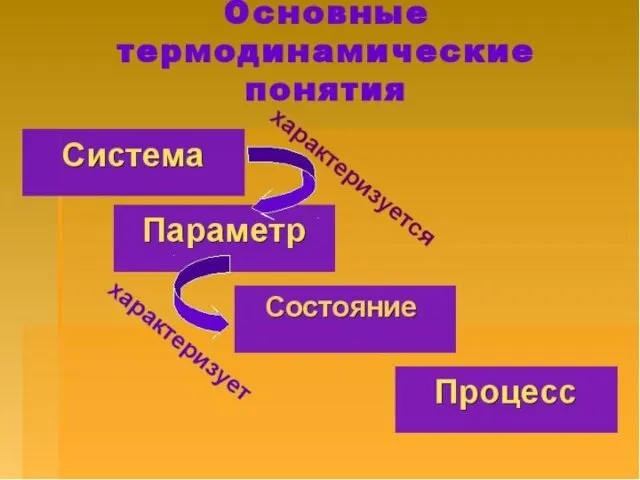
- 4. – это все, что находится в прямом или косвенном контакте с системой. Окружающая среда Система –
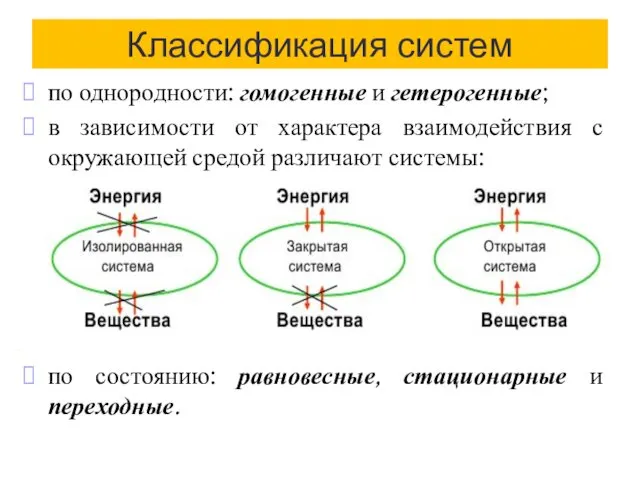
- 5. Классификация систем по однородности: гомогенные и гетерогенные; в зависимости от характера взаимодействия с окружающей средой различают
- 6. Т/д равновесное состояние - const всех свойств во времени и отсутствие потока вещества и энергии в
- 7. Совокупность всех физических и химических свойств системы называют состоянием системы. Его характеризуют термодинамическими параметрами, которые бывают:
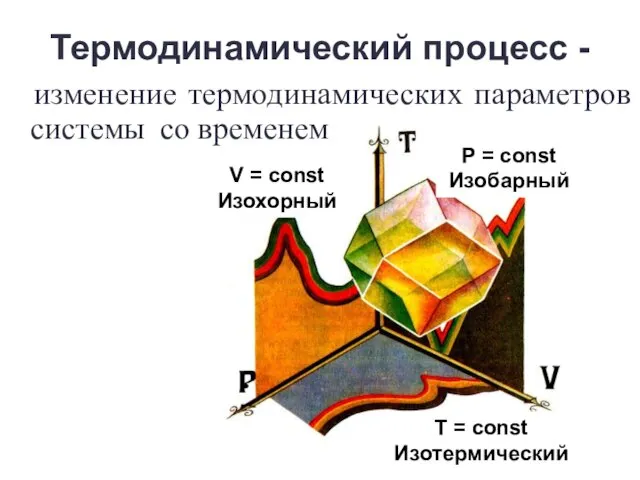
- 8. Термодинамический процесс - изменение термодинамических параметров системы со временем
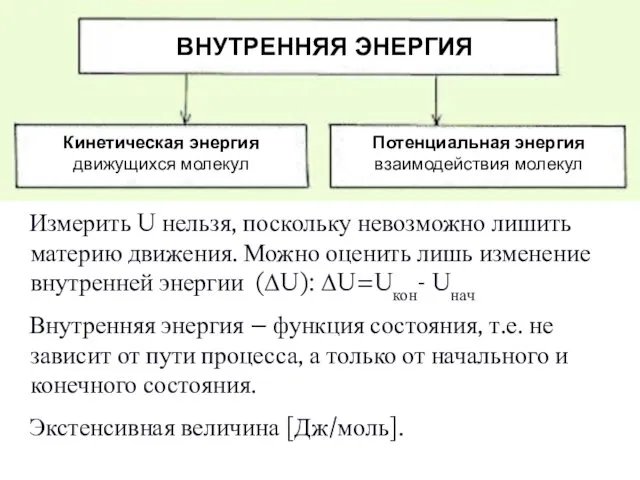
- 9. Измерить U нельзя, поскольку невозможно лишить материю движения. Можно оценить лишь изменение внутренней энергии (ΔU): ΔU=Uкон-
- 10. Теплота и работа Теплота (Q) - хаотический вид передачи энергии Работа (W) – направленный вид передачи
- 11. Первое начало термодинамики
- 12. Формулировки 2.Энергия изолированной системы постоянна. 3. Вечный двигатель I рода невозможен, т.е. машина, производящая работу без
- 13. Математический вид: Q=ΔU + W= ΔU + pΔV Количество теплоты, подведенное к системе, идет на изменение
- 14. Первый закон термодинамики в применении к некоторым процессам Изотермические процессы (Т = const): U = const,
- 15. Закон Гесса Тепловой эффект реакции не зависит от пути процесса ,а зависит только начальным и конечным
- 16. Следствия из закона Гесса 1. ΔНр-ии =∑νΔH0обр(прод) - ∑νΔH0обр(исх) Стандартной энтальпией образования (ΔH0обр ) - тепловой
- 17. 2. ΔНр-ии= ∑νΔ H0сгор(исх) - ∑νΔH0сгор (прод) Стандартная энтальпия сгорания (ΔH0сгор ) - тепловой эффект (изменение
- 18. Второе начало термодинамики
- 19. I закон термодинамики дает данные лишь о тепловом выделении и говорит о превращении одной формы энергии
- 20. Формулировки второго закона термодинамики Теплота не может самопроизвольно переходить от более холодного тела к более горячему
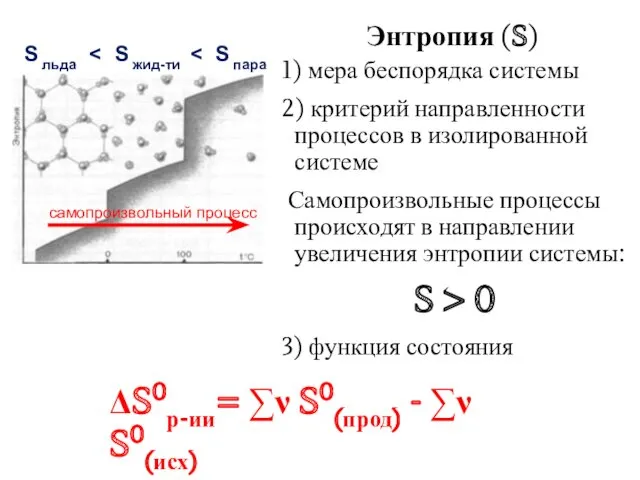
- 21. Энтропия (S) 1) мера беспорядка системы 2) критерий направленности процессов в изолированной системе Самопроизвольные процессы происходят
- 22. Термодинамические потенциалы критерии направленности процессов в открытой и закрытой системах: энергия Гиббса энергия Гельмгольца Расчет энергии
- 23. Биохимические реакции, сопровождающиеся уменьшением энергии Гиббса, называются экзергоническими реакциями. Биохимические реакции, сопровождающиеся увеличением энергии Гиббса, называются
- 24. Кинетика и катализ
- 25. Химическая кинетика изучает скорость и механизм химических реакций и зависимость их от различных факторов.
- 26. Скорость химической реакции – изменение количества вещества в единицу времени в единице объема (для гомогенных) или
- 28. Закон действующих масс (К. Гульдберг и П. Вааге) Скорость хим. реакции прямо пропорциональна произведению концентраций реагирующих
- 29. 2CO(г)+О2(г)= О2(г) Кинетическое уравнение химической реакции Общий порядок равен: n = 2 + 1 = 3.
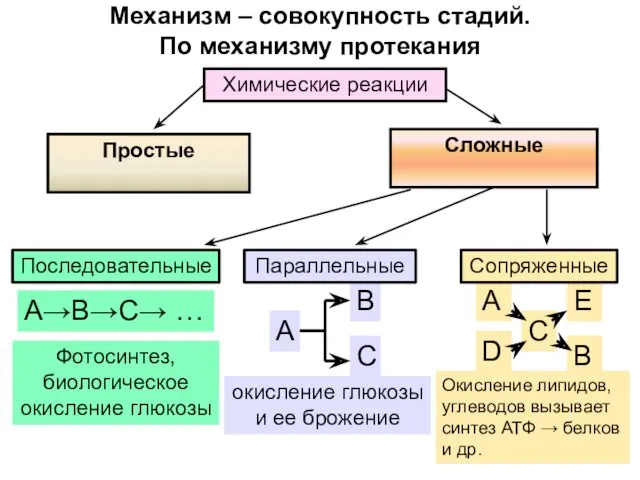
- 30. Механизм – совокупность стадий. По механизму протекания
- 31. Простые реакции – одна стадия; стехиометрическое уравнение отражает реальный ход процесса NO2 + NO2 → N2O4
- 32. Механизм процесса характеризует молекулярность реакции - число молекул(частиц), участвующих в элементарном акте реакции. Реакции делятся на:
- 33. Для простых реакций: порядок = молекулярности 2NO2 → N2O4 Молекулярность – 2 Для сложных реакций: порядок
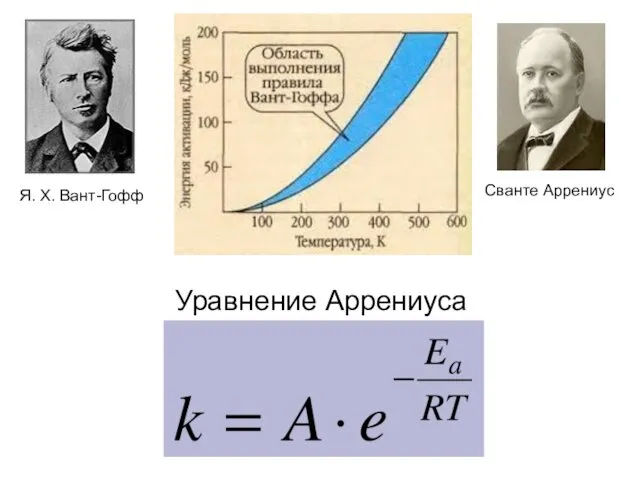
- 34. Правило Вант – Гоффа: При обычных температурах (Т где γ = 2 ÷ 4 (температурный коэффициент).
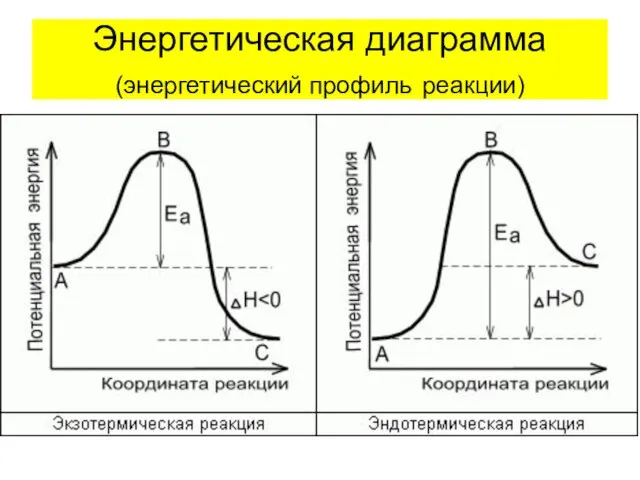
- 36. Энергетическая диаграмма (энергетический профиль реакции)
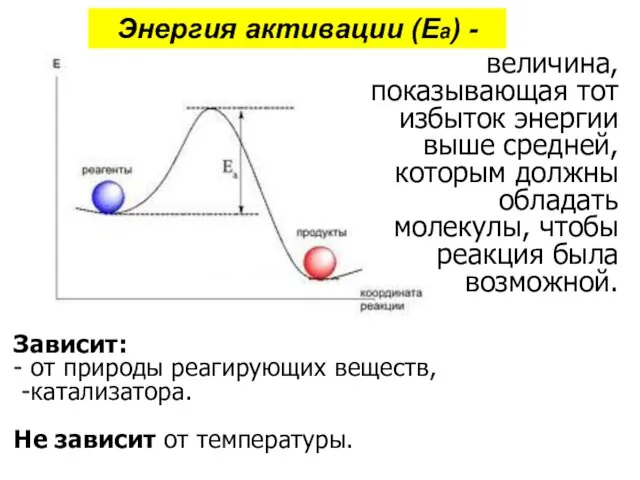
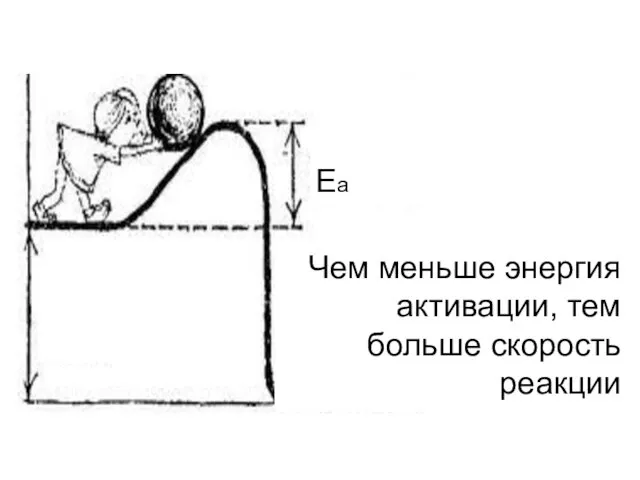
- 37. Энергия активации (Еа) - величина, показывающая тот избыток энергии выше средней, которым должны обладать молекулы, чтобы
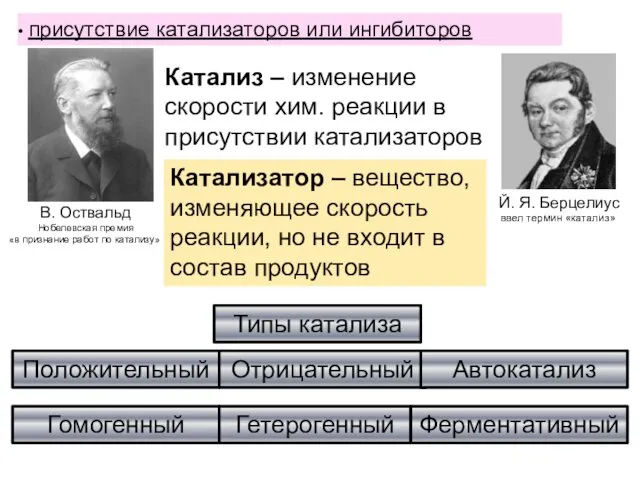
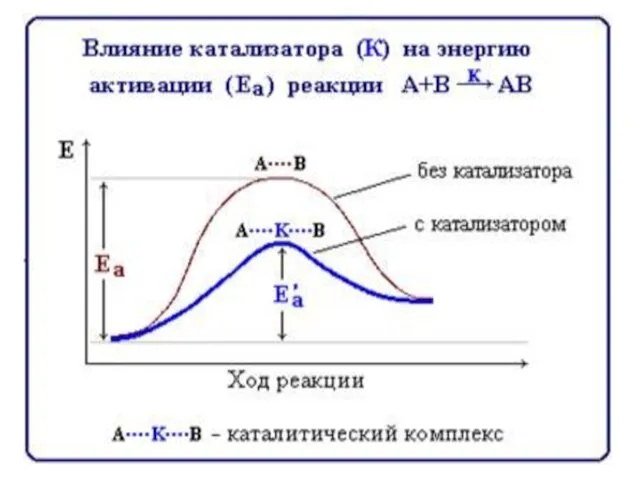
- 40. присутствие катализаторов или ингибиторов Й. Я. Берцелиус ввел термин «катализ». В. Оствальд Нобелевская премия «в признание
- 41. Положительный и отрицательный, (когда скорость реакции уменьшается, в таком случае катализатор называют ингибитором). Гетерогенный (когда реагирующие
- 43. Ферментативный катализ -каталитические реакции, протекающие с участием ферментов (пищеварение, брожение спиртов, биологическое окисление). Ферменты – биологические
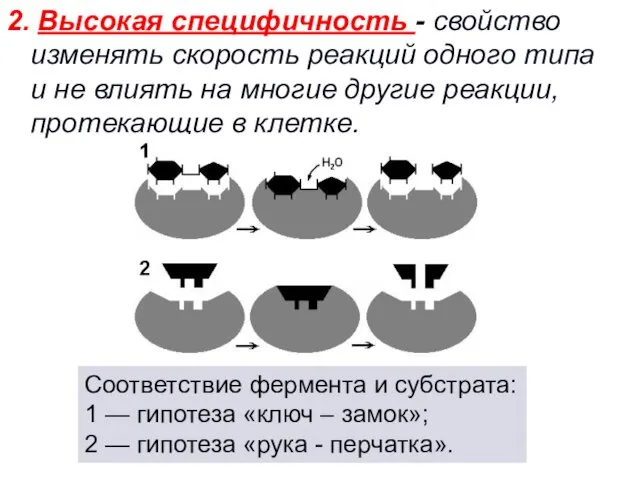
- 44. 2. Высокая специфичность - свойство изменять скорость реакций одного типа и не влиять на многие другие
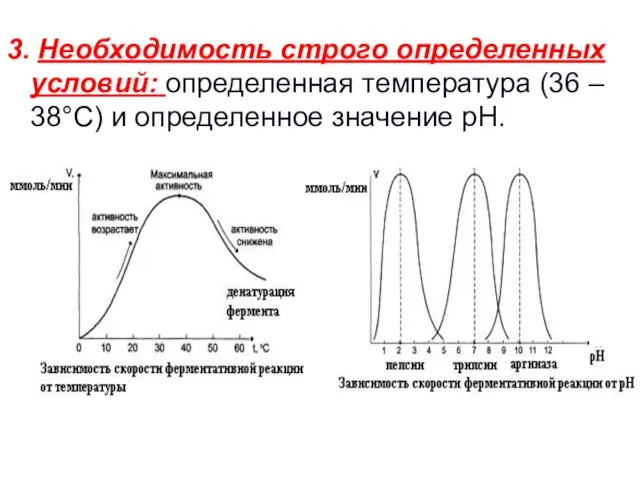
- 45. 3. Необходимость строго определенных условий: определенная температура (36 – 38°С) и определенное значение рН.
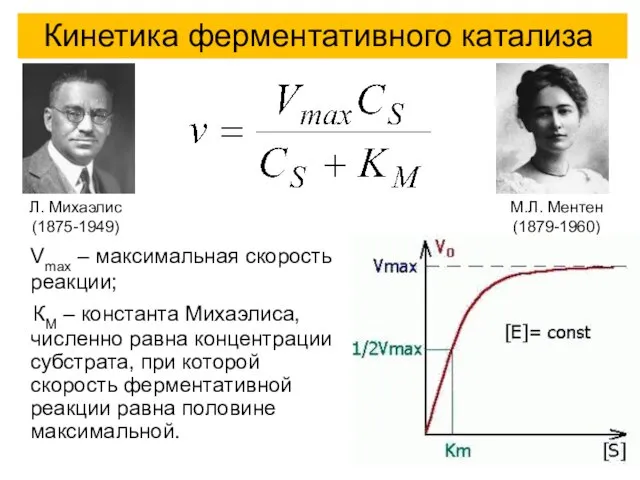
- 46. Кинетика ферментативного катализа
- 48. Скачать презентацию






























 Поверхностные явления. Типы поверхностных явлений
Поверхностные явления. Типы поверхностных явлений Графит
Графит Серная кислота и её свойства
Серная кислота и её свойства Оксиды, их классификация и свойства
Оксиды, их классификация и свойства Алкадиены. Строение алкадиенов
Алкадиены. Строение алкадиенов Курс биохимии. Биохимия крови
Курс биохимии. Биохимия крови Действующие вещества. Лексикон
Действующие вещества. Лексикон Классификация минералов в соответствии с систематикой, утвержденной IMA
Классификация минералов в соответствии с систематикой, утвержденной IMA Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Кислород. Промышленный способ (перегонка жидкого воздуха)
Кислород. Промышленный способ (перегонка жидкого воздуха) Атомовиты. Анатомо-физиологические свойства
Атомовиты. Анатомо-физиологические свойства Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества
Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества Гидроочистка нефти и газа
Гидроочистка нефти и газа Поверхностные явления
Поверхностные явления Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Центрифугирование в почвоведении
Центрифугирование в почвоведении Классификация химических реакций (11 класс)
Классификация химических реакций (11 класс) Особливості горіння дисперсних систем
Особливості горіння дисперсних систем Первая группа периодической системы Менделеева. Щелочные металлы
Первая группа периодической системы Менделеева. Щелочные металлы Оптические свойства салических породообразующих минералов (лекция 8)
Оптические свойства салических породообразующих минералов (лекция 8) Альдегиды и кетоны
Альдегиды и кетоны Углеводы. Молекулярные формулы
Углеводы. Молекулярные формулы Трансмиссионные масла
Трансмиссионные масла Атомно-молекулярное учение. (Лекция 1)
Атомно-молекулярное учение. (Лекция 1) Закон постоянства состава
Закон постоянства состава Путешествие на остров Соединений химических элементов. Урок-игра
Путешествие на остров Соединений химических элементов. Урок-игра Кобальт. Химический элемент
Кобальт. Химический элемент 20230306_oni_byli_pervymi
20230306_oni_byli_pervymi