Содержание
- 2. Жозеф Луи Пруст 1754–1826 гг. Впервые сформулировал закон постоянства состава.
- 3. Жозеф Луи Пруст 1754–1826 гг. «От одного полюса Земли до другого соединения имеют одинаковый состав и
- 4. Закон постоянства состава полностью справедлив для веществ молекулярного строения и не всегда выполняется для веществ немолекулярного
- 5. Качественный и количественный состав вещества отображается с помощью химических формул. H2O
- 6. Химическая формула обозначает Определенное химическое соединение Название соединения Одну молекулу вещества 1 моль вещества
- 7. Химическая формула отображает Качественный состав вещества: атомы каких элементов входят в состав вещества Количественный состав: число
- 8. Также по химической формуле можно рассчитать относительную молекулярную и молярную массы вещества. Mr M
- 9. СO2 Вещество: углекислый газ; 1 молекула или 1 моль углекислого газа; Углекислый газ — сложное вещество,
- 10. Массовая доля элемента в составе сложного вещества w(Э) = Ar (Э) ∙ x/Mr
- 11. Массовая доля элемента в составе сложного вещества w(С) = 12 : 44 = 0,27 или 27%
- 12. Массовая доля компонента в составе смеси
- 13. Объёмная доля компонента в составе газовой смеси
- 14. Массовая доля растворенного вещества в составе раствора
- 15. Молярная концентрация вещества
- 16. Массовая доля чистого вещества w(чистого вещества) = 1 – w(примесей)
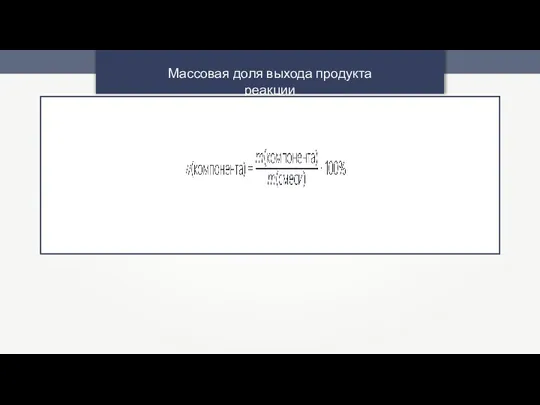
- 17. Массовая доля выхода продукта реакции
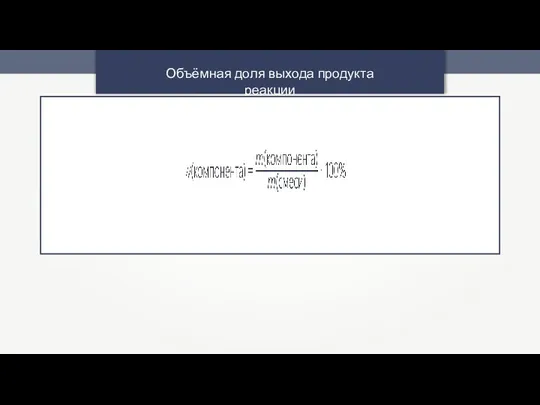
- 18. Объёмная доля выхода продукта реакции
- 19. Задание Дано: w(С) = 0,02 m(стали) = 200кг Найти: m(Fe) — ? m(C) — ? Решение:
- 20. Задание Дано: φ(О2) = 0,3 φ(N2) = 0,6 φ(H2) = 0,1 V(смеси) = 450м3 Найти: V(О2)
- 21. Задание Дано: m(уксуса) = 800г w(СН3СООН)=0,09 Найти: m(Н2О) — ? m(СН3СООН) — ? Решение: Задача 3.
- 22. Задание Дано: m1(р-ра) = 120г w1(CaCl2) = 0,5 w2(CaCl2) = 0,05 Найти: V(H2O) — ? Решение:
- 23. Задание Дано: w(примесей) = 0,12 m(руды) = 600кг Найти: m(Ва) — ? Решение: Задача 5. Рассчитайте
- 24. Задание Дано: m(С2Н6) = 6г mпракт(С2Н4) = 4,8г Найти: η(С2Н4) — ? Решение: Задача 6. В
- 25. Задание Дано: V(р-ра) = 5л m(NaCl) = 80г Найти: с(NaCl) — ? Решение: Задача 7. В
- 27. Скачать презентацию





















 Карбоновые кислоты, альдегиды
Карбоновые кислоты, альдегиды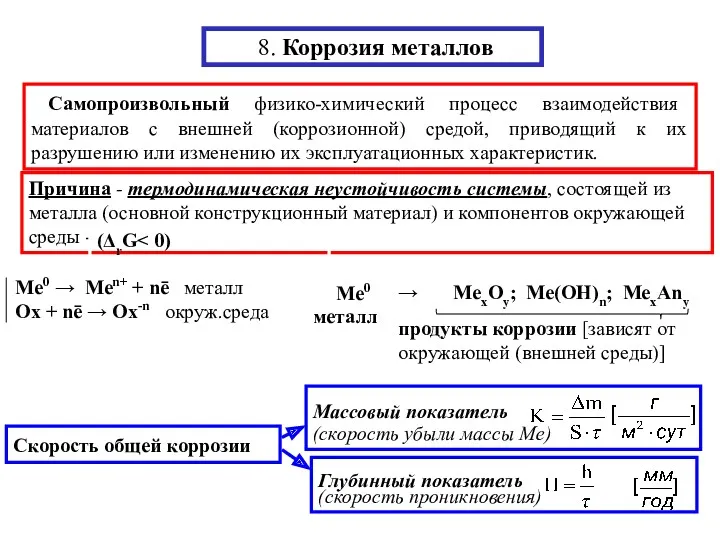 Коррозия металлов
Коррозия металлов Моющие средства
Моющие средства Мұнай эмульсиясының құрамы және фаза аралық беттерінің құрылымы. Эмульсия инверсиясы
Мұнай эмульсиясының құрамы және фаза аралық беттерінің құрылымы. Эмульсия инверсиясы Способы выражения состава раствора
Способы выражения состава раствора Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Хімія в житті людини
Хімія в житті людини Удивительные свойства воды
Удивительные свойства воды Своя игра. Химия. 7 класс
Своя игра. Химия. 7 класс Органічні сполуки: ліпіди
Органічні сполуки: ліпіди Хлороводород. Соляная кислота
Хлороводород. Соляная кислота Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Металдардың химиялық белсенділігі
Металдардың химиялық белсенділігі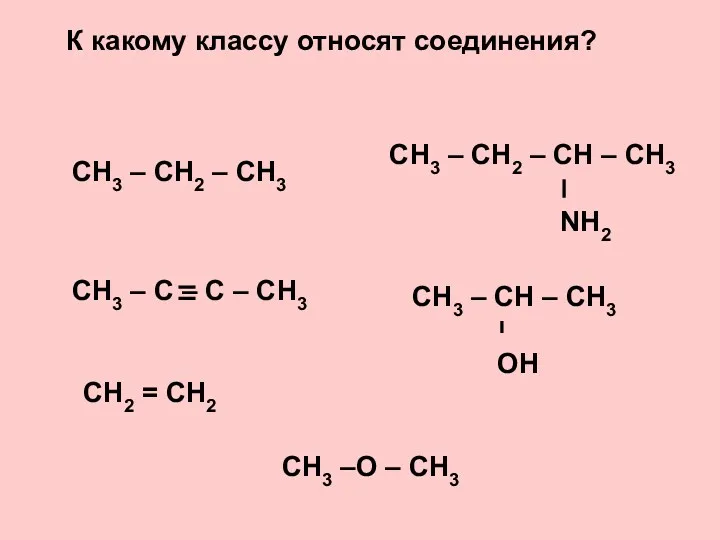 16_OP_05_Alkany
16_OP_05_Alkany Химия (Органическая химия)
Химия (Органическая химия) Др
Др Химиялық элементтердін Д.И. Менделеев жасаған периодтық жүйесі
Химиялық элементтердін Д.И. Менделеев жасаған периодтық жүйесі Алкалоиды. Классификация алкалоидов:
Алкалоиды. Классификация алкалоидов: Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном Химическая связь
Химическая связь Коллигативные свойства растворов. Осмос и диффузия в растительной клетке
Коллигативные свойства растворов. Осмос и диффузия в растительной клетке Фибоначчи. Закономерности химических элементов ряда
Фибоначчи. Закономерности химических элементов ряда Гибридизация
Гибридизация Металлическая связь. Агрегатные состояния вещества
Металлическая связь. Агрегатные состояния вещества Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Topic 3.2
Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Topic 3.2 Химический элемент медь
Химический элемент медь Свойства катализатора. Промотирование и модифицирование
Свойства катализатора. Промотирование и модифицирование