Содержание
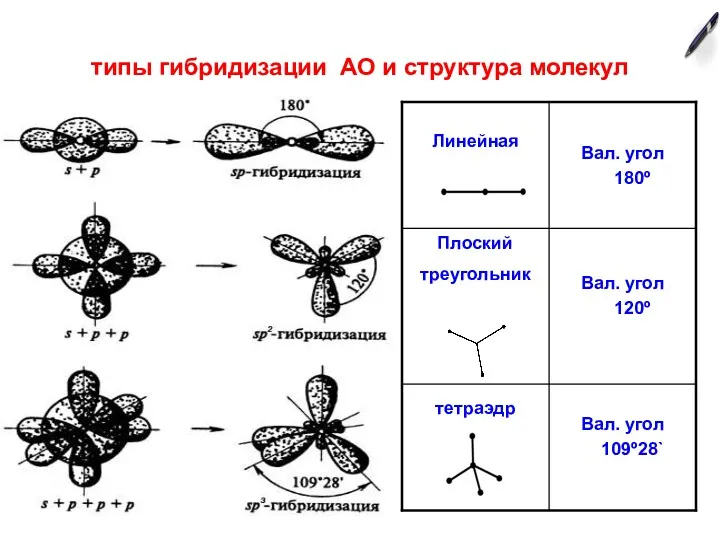
- 2. типы гибридизации АО и структура молекул
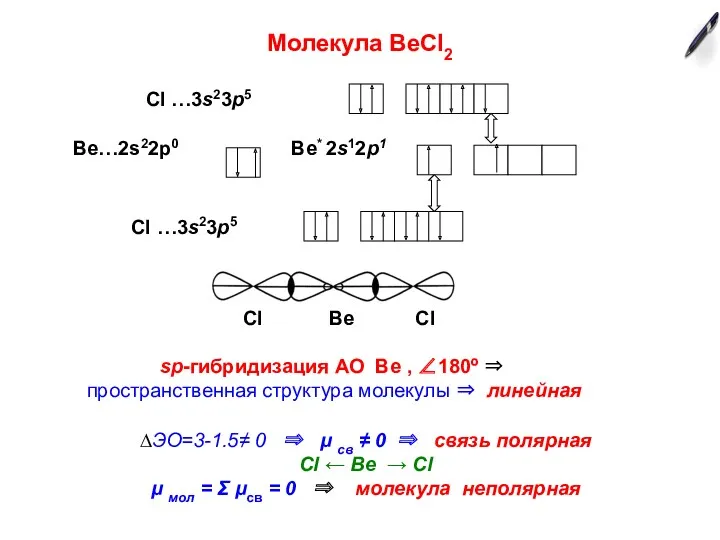
- 3. Молекула ВеСl2 Cl Be Cl sp-гибридизация АО Ве , ∠180º ⇒ пространственная структура молекулы ⇒ линейная
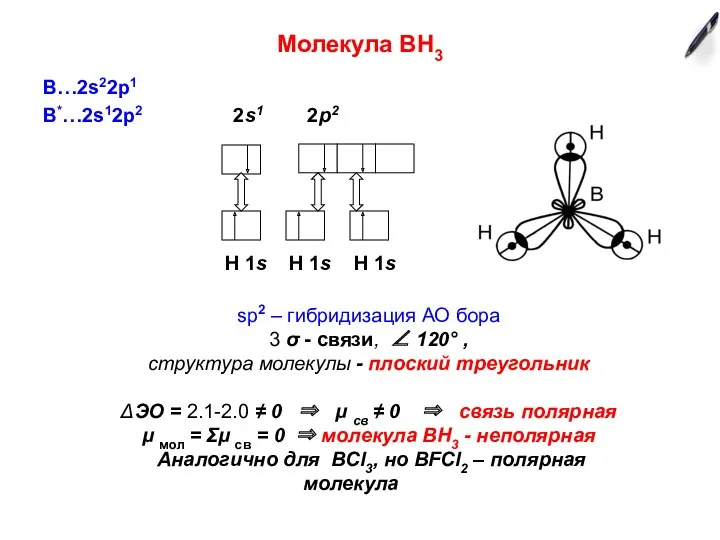
- 4. Молекула ВН3 В…2s22p1 В*…2s12p2 2s1 2p2 H 1s H 1s H 1s sp2 – гибридизация АО
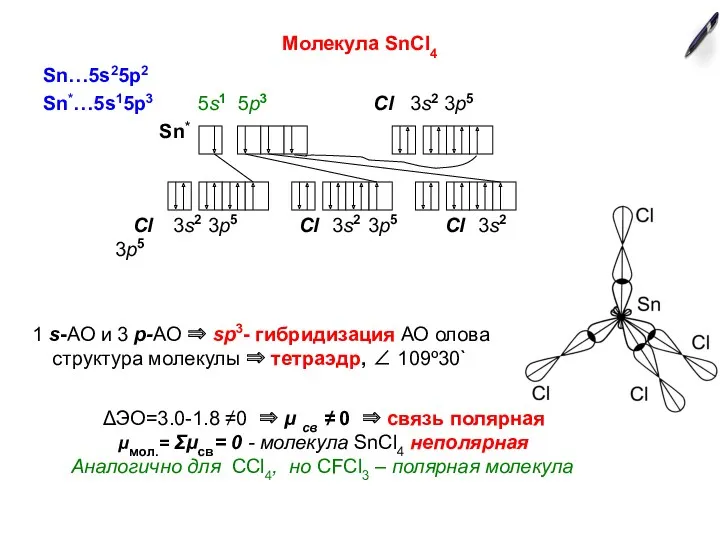
- 5. Молекула SnCl4 Sn…5s25p2 Sn*…5s15p3 5s1 5p3 Cl 3s2 3p5 Sn* Cl 3s2 3p5 Cl 3s2 3p5
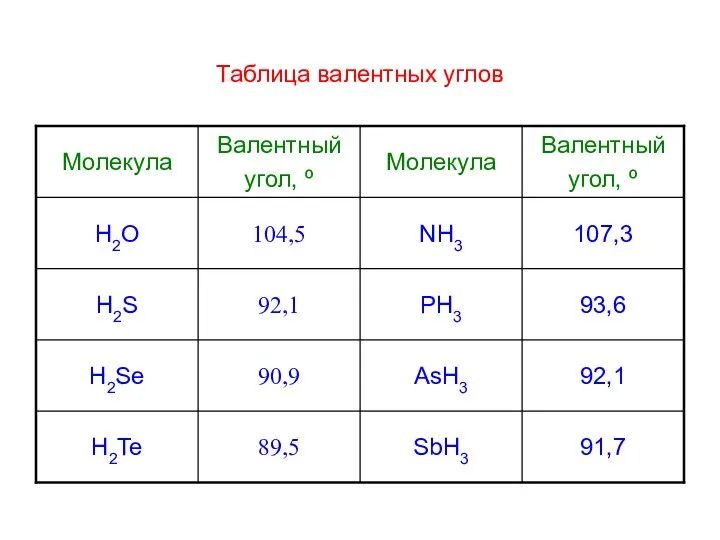
- 6. Таблица валентных углов
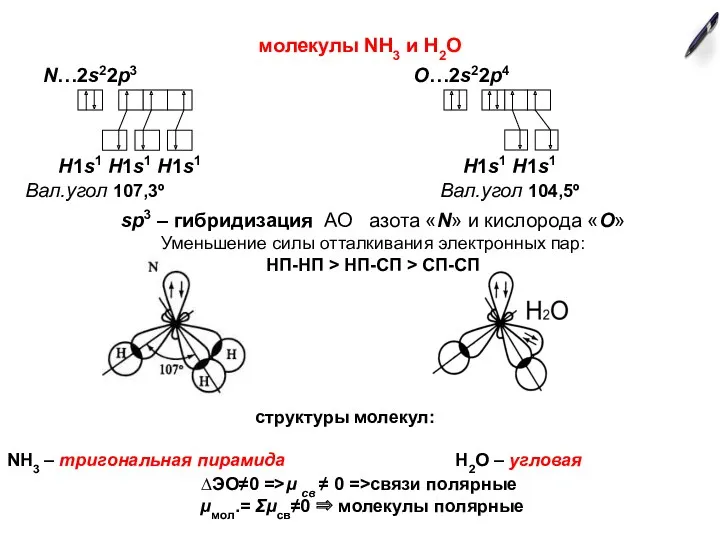
- 7. молекулы NН3 и Н2О N…2s22p3 O…2s22p4 H1s1 H1s1 H1s1 Н1s1 Н1s1 Вал.угол 107,3º Вал.угол 104,5º sp3
- 8. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ (§3.3; 3.4) Сложные соединения, в узлах кристаллической решетки кото-рых находятся сложные частицы, способные к
- 9. Состав комплекса: Комплексообразователь и лиганды Лиганды: простые анионы (F–,Cl–, Br–,S2–), сложные анионы (OH–,CN–, NCS–, NO2–), нейтральные
- 10. Химическая связь в комплексных соединениях Между внешней и внутренней сферой – электростатическое ион-ионное взаимодействие Между комплексообразователем
- 11. Комплекс [AlBr4] Аl …3s23р1 , но комплексообразователь Al3+: …3s03р0 Al3+: …3s03р0 :Br :Br :Br :Br– лиганд
- 12. Комплекс [Ag(CN)2]– Ag …4d105s1 Комплексообразователь: Ag+ …4d105s0 Лиганд CN– , к.ч. 2 CN– CN– Ag+ ••
- 13. Теория кристаллического поля Комплексообразователь – d1-9 элемент Лиганды располагаются вокруг комплексообразователя так, чтобы силы притяжения были
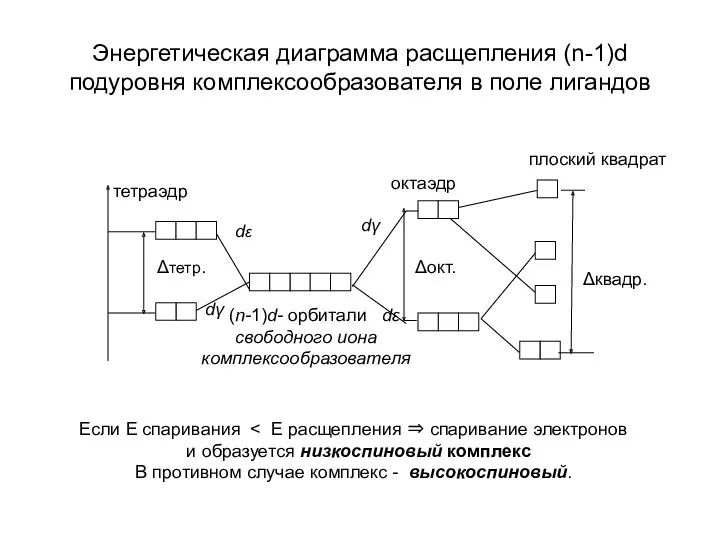
- 14. Энергетическая диаграмма расщепления (n-1)d подуровня комплексообразователя в поле лигандов тетраэдр Δтетр. dε dγ (n-1)d- орбитали dε
- 15. Обитали лигандов, внедряясь в электронную оболочку комплексообразователя, оказывают влияние на состояние электронов на d- орбиталях. Неспаренные
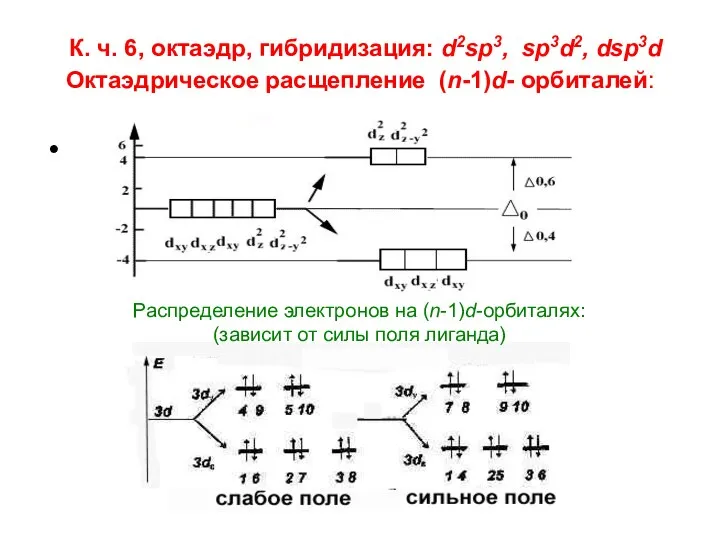
- 16. К. ч. 6, октаэдр, гибридизация: d2sp3, sp3d2, dsp3d Октаэдрическое расщепление (n-1)d- орбиталей: Распределение электронов на (n-1)d-орбиталях:
- 17. Комплекс [Fe(CN)6]3- Комплексообразователь Fe3+: 3d 54s0 , лиганд CN– сильного поля, к.ч.6 – октаэдрическое расщепление Диаграмма
- 18. Магнитные свойства комплексных соединений парамагнетики — вещества, намагничивающиеся во внешнем магнитном поле по направлению поля. Парамагнетики
- 20. Скачать презентацию



![Комплекс [AlBr4] Аl …3s23р1 , но комплексообразователь Al3+: …3s03р0 Al3+:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379689/slide-10.jpg)
![Комплекс [Ag(CN)2]– Ag …4d105s1 Комплексообразователь: Ag+ …4d105s0 Лиганд CN– ,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379689/slide-11.jpg)


![Комплекс [Fe(CN)6]3- Комплексообразователь Fe3+: 3d 54s0 , лиганд CN– сильного](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/379689/slide-16.jpg)

 Хром
Хром Металлы. Лекция № 9
Металлы. Лекция № 9 Решение упражнений по теме: Углеводы
Решение упражнений по теме: Углеводы Контрольная работа. Разбор. 9 класс
Контрольная работа. Разбор. 9 класс Защитные материалы
Защитные материалы Магнитные наночастицы: проблемы и достижения
Магнитные наночастицы: проблемы и достижения Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3)
Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3) Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Общая характеристика неметаллов
Общая характеристика неметаллов Аммиак. Строение, свойства, получение, применение
Аммиак. Строение, свойства, получение, применение Оксиды. Понятия об оксидах
Оксиды. Понятия об оксидах Путешествие на остров Соединений химических элементов. Урок-игра
Путешествие на остров Соединений химических элементов. Урок-игра Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул
Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул Алюминий и его соединения
Алюминий и его соединения Растворы. (Лекция 7)
Растворы. (Лекция 7) Химические методы определения U, Pu, Th
Химические методы определения U, Pu, Th Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Химическое равновесие
Химическое равновесие d997-13229e5e
d997-13229e5e Типы химических реакций
Типы химических реакций Методы выделения и очистки продуктов биотехнологических производств
Методы выделения и очистки продуктов биотехнологических производств Соли аммония
Соли аммония Минералогический состав почв
Минералогический состав почв Physical chemistry of nanostructured systems
Physical chemistry of nanostructured systems Азотсодержащие органические соединения
Азотсодержащие органические соединения История развитии химии
История развитии химии Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Аллотропные модификации кремния
Аллотропные модификации кремния