Содержание
- 2. Амины органические соединения, содержащие в своём составе аминогруппу –NH2 или замещённую аминогруппу (-NHR или NR2) производные
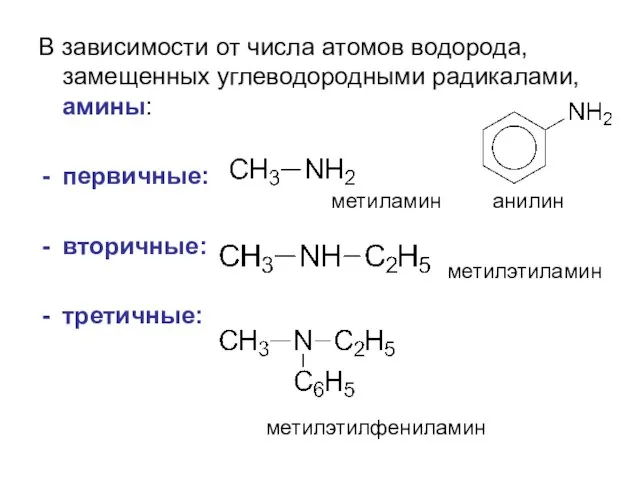
- 3. В зависимости от числа атомов водорода, замещенных углеводородными радикалами, амины: первичные: вторичные: третичные:
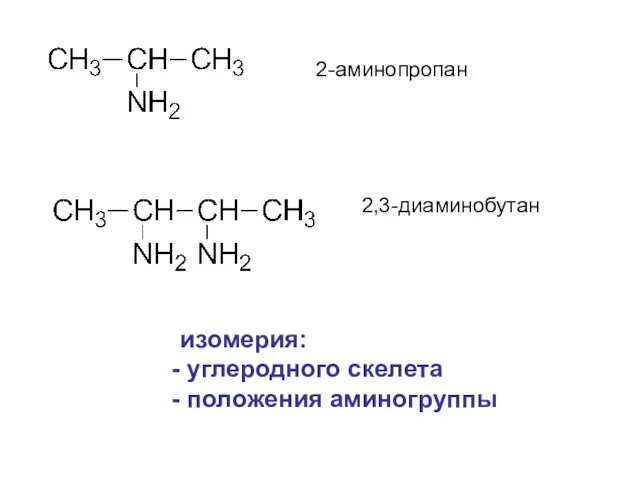
- 4. 2-аминопропан 2,3-диаминобутан изомерия: углеродного скелета положения аминогруппы
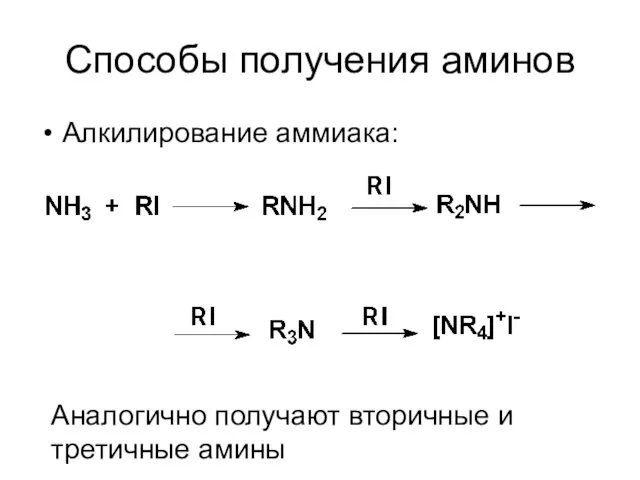
- 5. Способы получения аминов Алкилирование аммиака: Аналогично получают вторичные и третичные амины
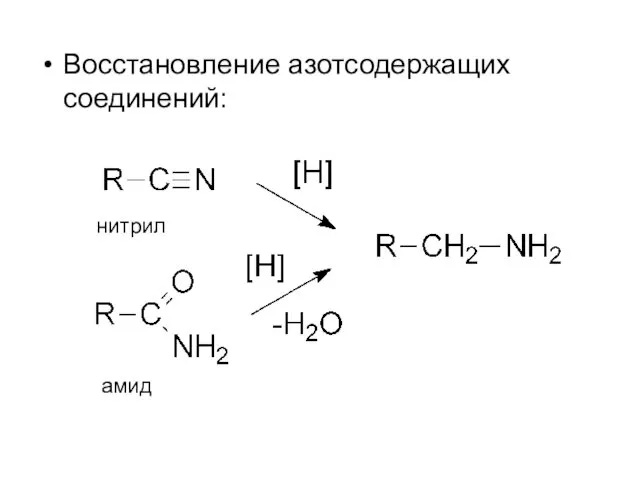
- 6. Восстановление азотсодержащих соединений: нитрил амид
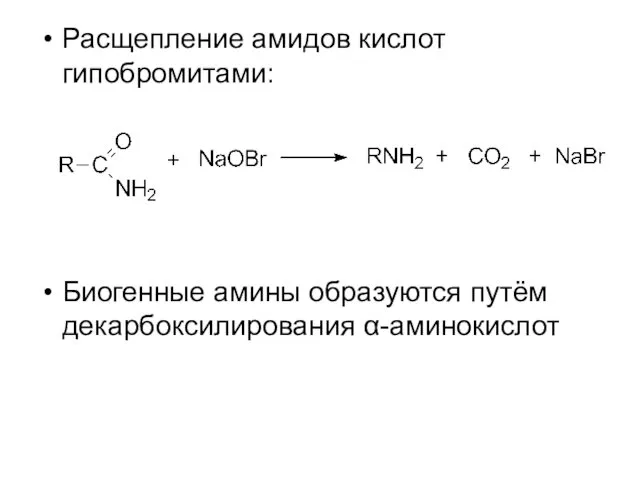
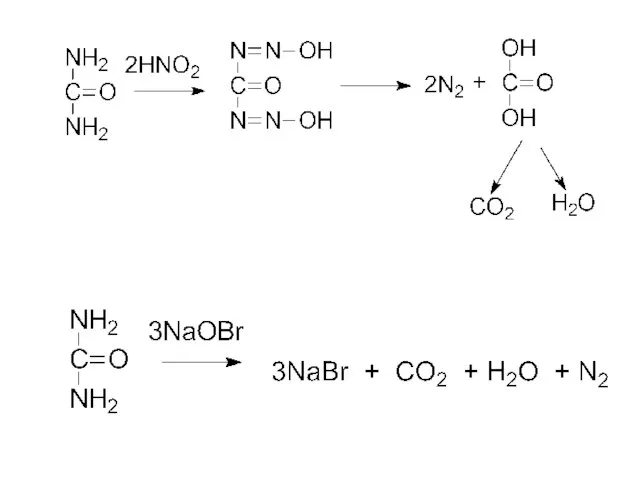
- 7. Расщепление амидов кислот гипобромитами: Биогенные амины образуются путём декарбоксилирования α-аминокислот
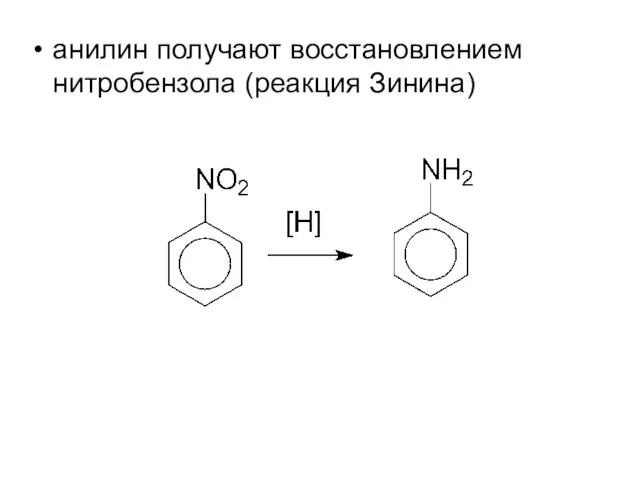
- 8. анилин получают восстановлением нитробензола (реакция Зинина)
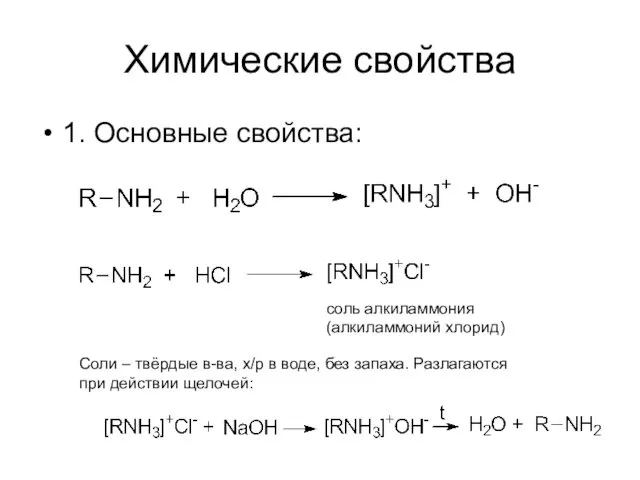
- 9. Химические свойства 1. Основные свойства:
- 10. Амины жирного ряда обладают более выраженными основными свойствами, чем аммиак. У аминов ароматического ряда основные свойства
- 11. 2. Взаимодействие с азотистой кислотой проходит с образованием различных продуктов для аминов разного строения. Это качественная
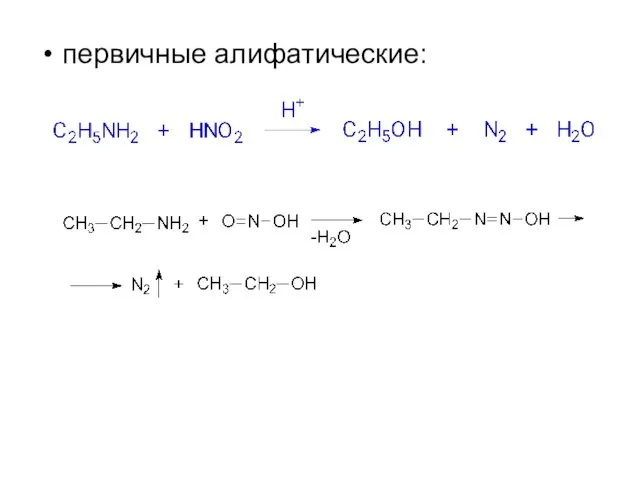
- 12. первичные алифатические:
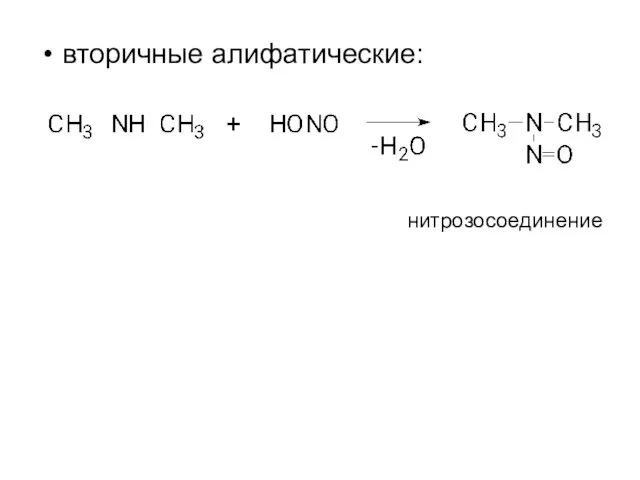
- 13. вторичные алифатические: нитрозосоединение
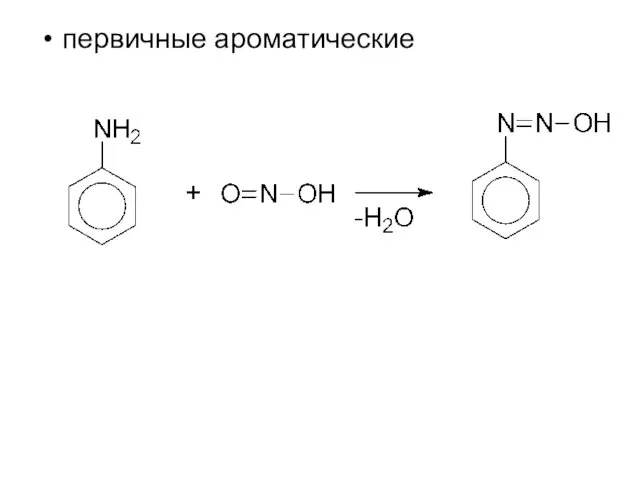
- 14. первичные ароматические
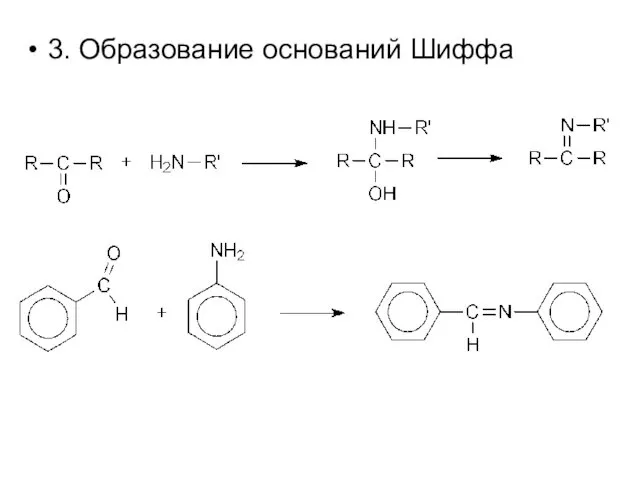
- 15. 3. Образование оснований Шиффа
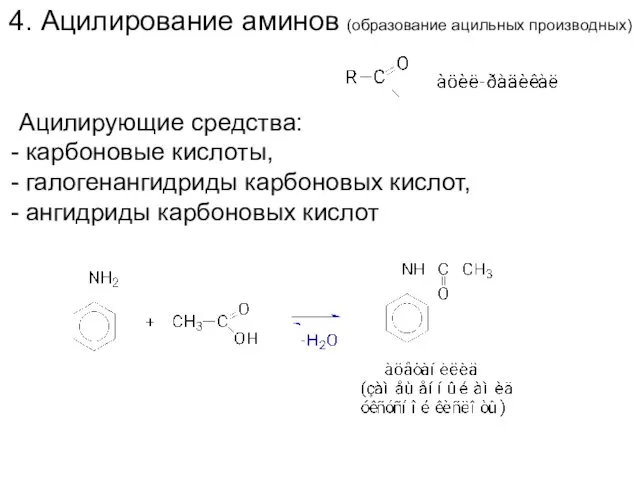
- 16. 4. Ацилирование аминов (образование ацильных производных) Ацилирующие средства: карбоновые кислоты, галогенангидриды карбоновых кислот, ангидриды карбоновых кислот
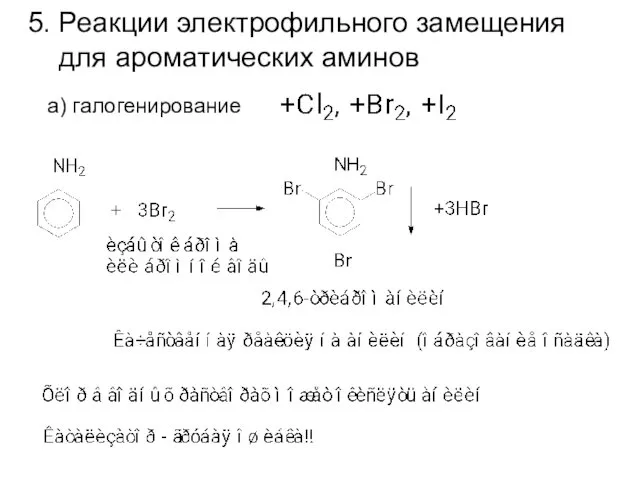
- 17. 5. Реакции электрофильного замещения для ароматических аминов а) галогенирование
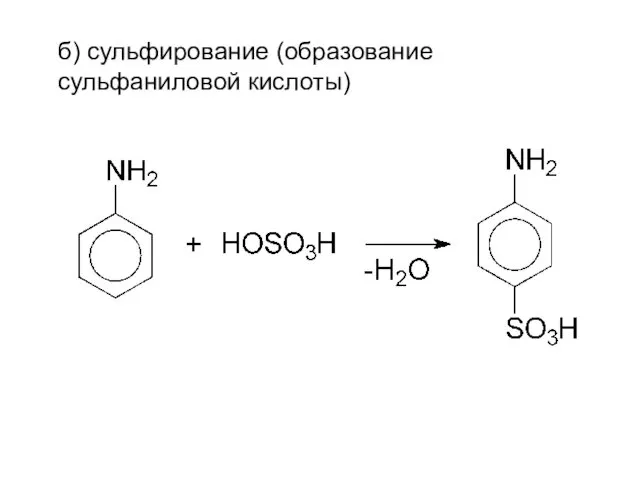
- 18. б) сульфирование (образование сульфаниловой кислоты)
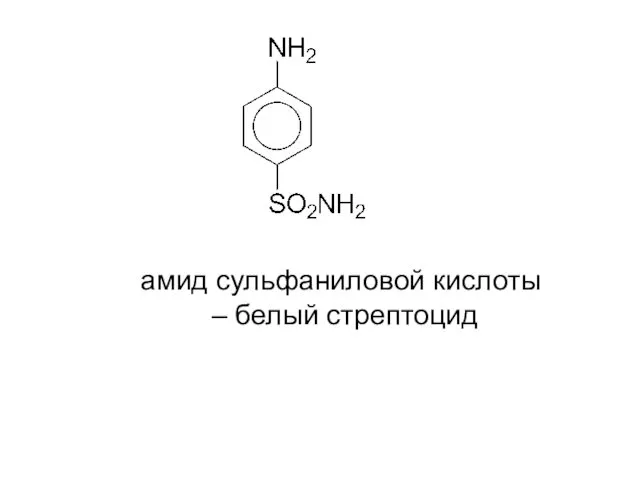
- 19. амид сульфаниловой кислоты – белый стрептоцид
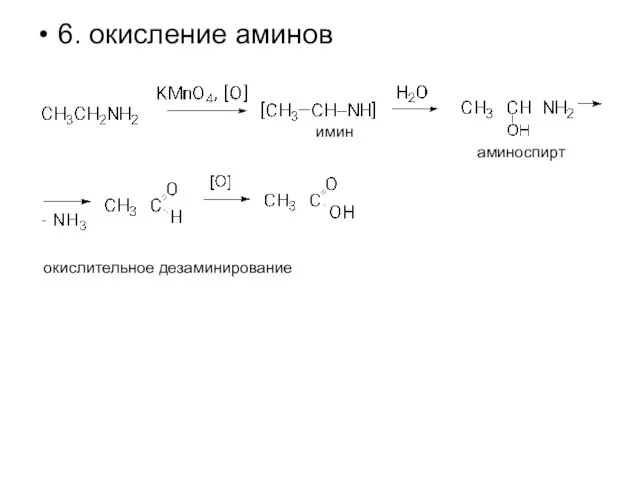
- 20. 6. окисление аминов окислительное дезаминирование имин аминоспирт
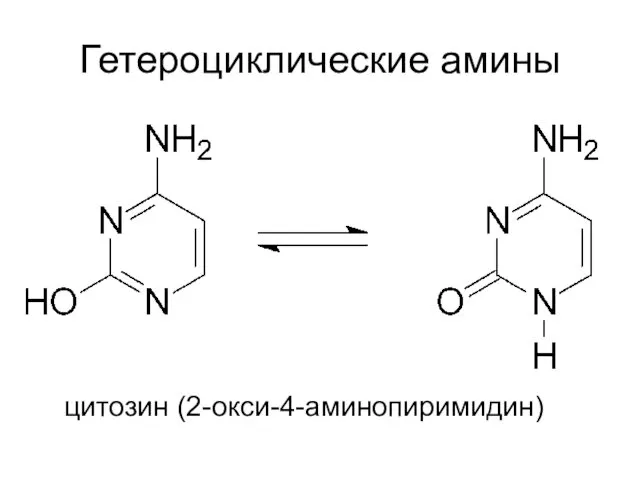
- 21. Гетероциклические амины цитозин (2-окси-4-аминопиримидин)
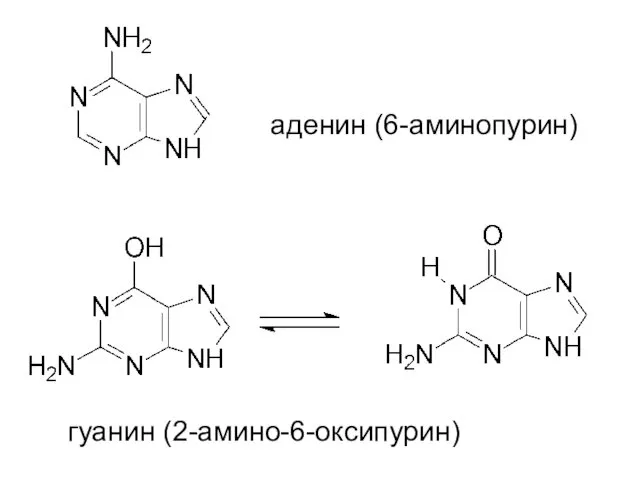
- 22. аденин (6-аминопурин) гуанин (2-амино-6-оксипурин)
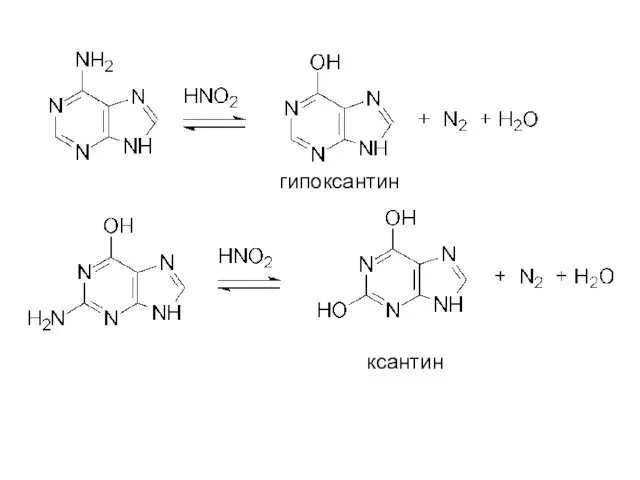
- 23. гипоксантин ксантин
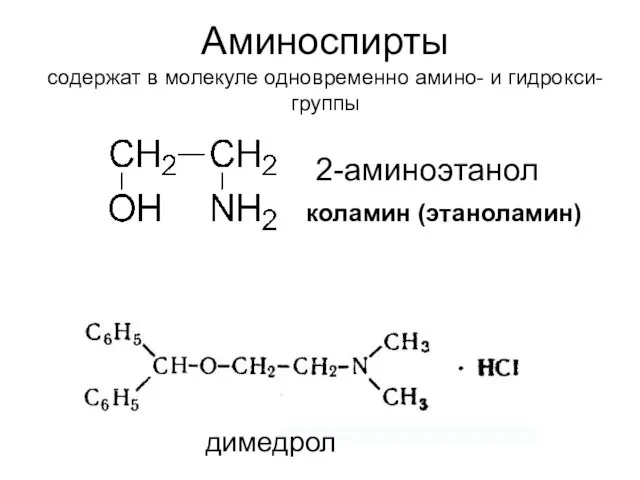
- 24. Аминоспирты содержат в молекуле одновременно амино- и гидрокси-группы коламин (этаноламин) холин (триметил-β-гидроксиэтилгидрат аммония): 2 2-аминоэтанол димедрол
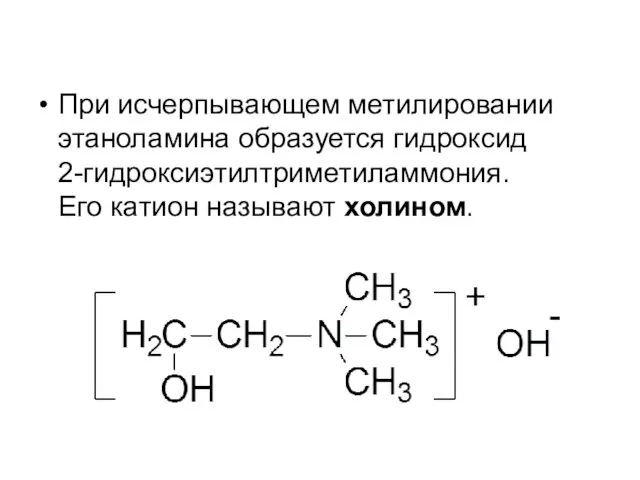
- 25. При исчерпывающем метилировании этаноламина образуется гидроксид 2-гидроксиэтилтриметиламмония. Его катион называют холином.
- 26. Холин – структурный элемент сложных липидов. Имеет большое значение как витаминоподобное вещество, регулирующее жировой обмен. В
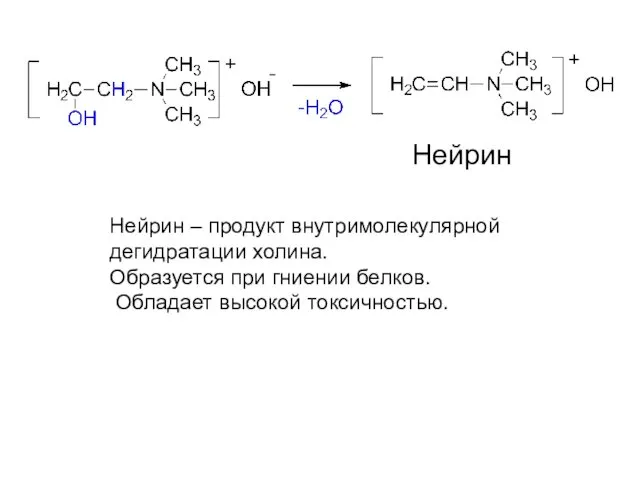
- 27. Нейрин Нейрин – продукт внутримолекулярной дегидратации холина. Образуется при гниении белков. Обладает высокой токсичностью.
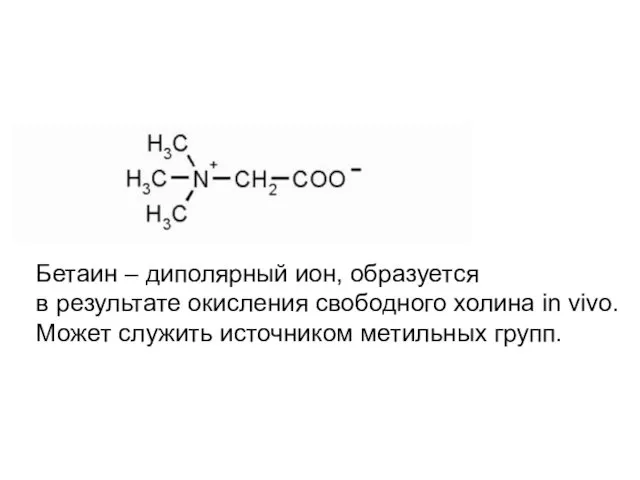
- 28. Бетаин – диполярный ион, образуется в результате окисления свободного холина in vivo. Может служить источником метильных
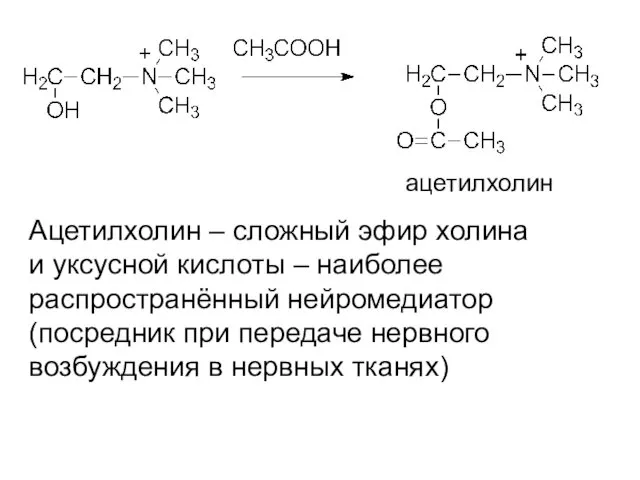
- 29. ацетилхолин Ацетилхолин – сложный эфир холина и уксусной кислоты – наиболее распространённый нейромедиатор (посредник при передаче
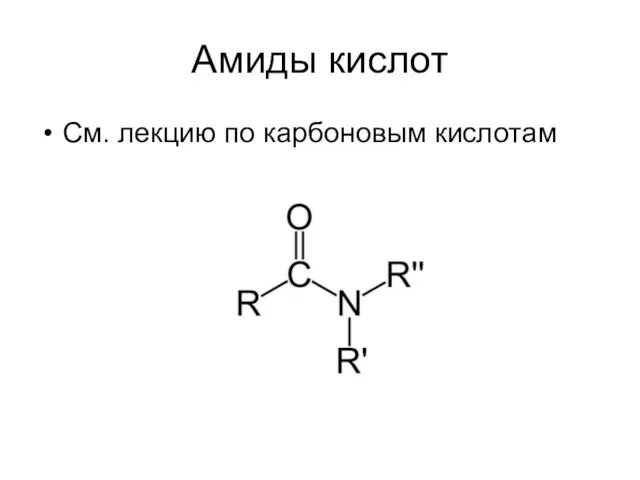
- 30. Амиды кислот См. лекцию по карбоновым кислотам
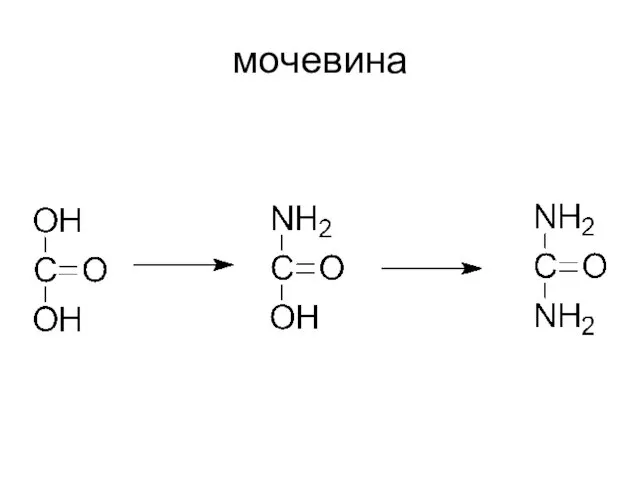
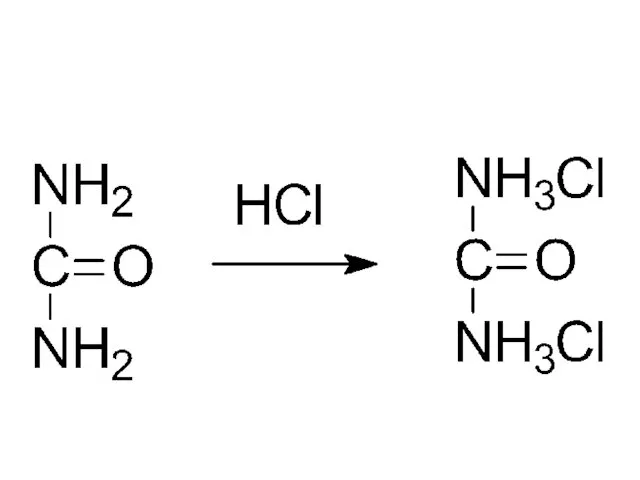
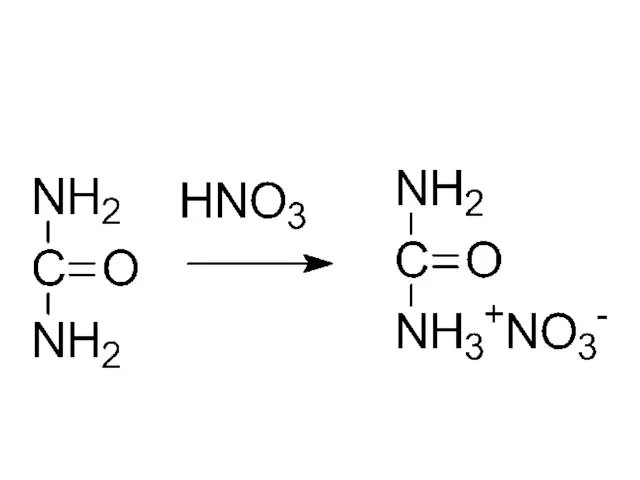
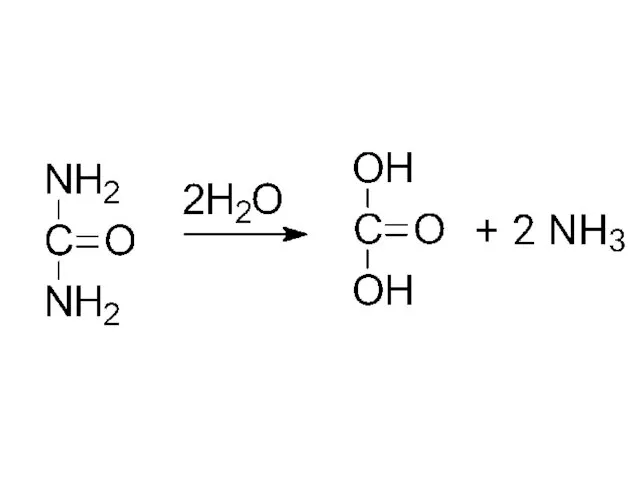
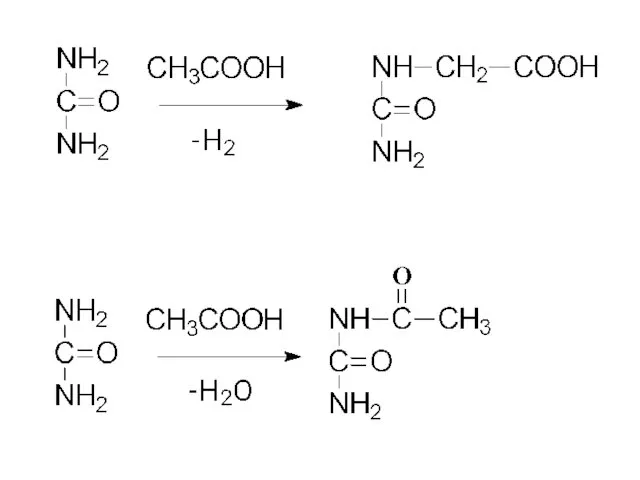
- 31. мочевина
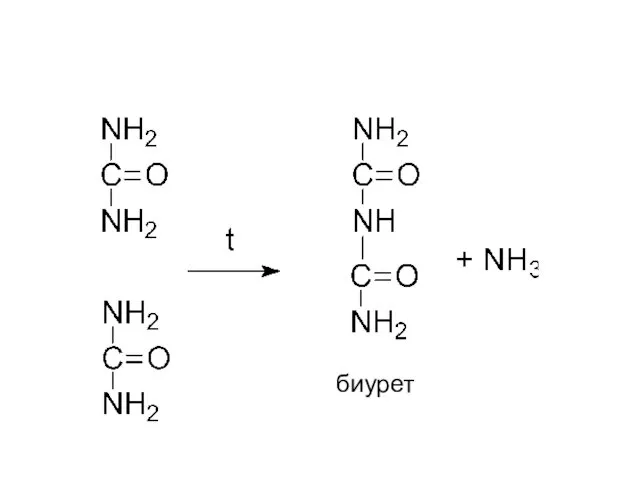
- 37. биурет
- 38. АМИНОКИСЛОТЫ
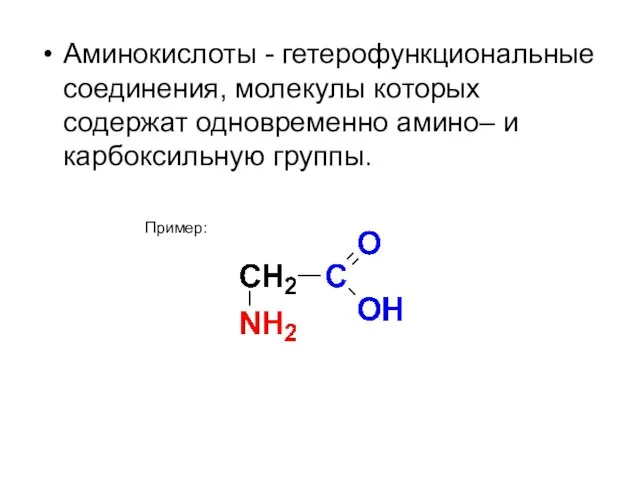
- 39. Аминокислоты - гетерофункциональные соединения, молекулы которых содержат одновременно амино– и карбоксильную группы. Пример:
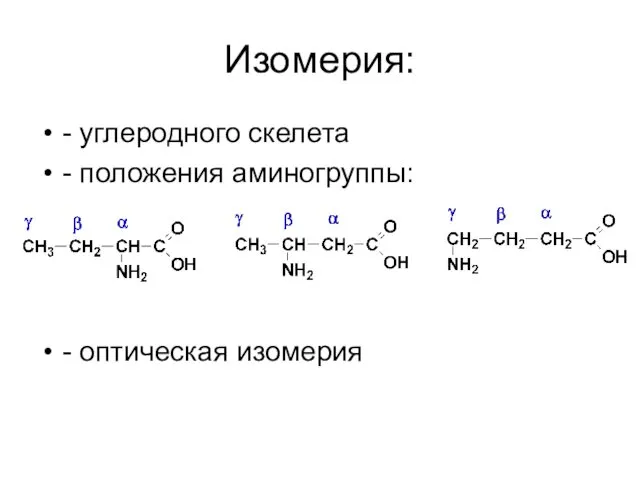
- 40. Изомерия: - углеродного скелета - положения аминогруппы: - оптическая изомерия
- 41. Получение аминокислот 1. Гидролиз белков 2. Действие аммиака на галогенкислоты:
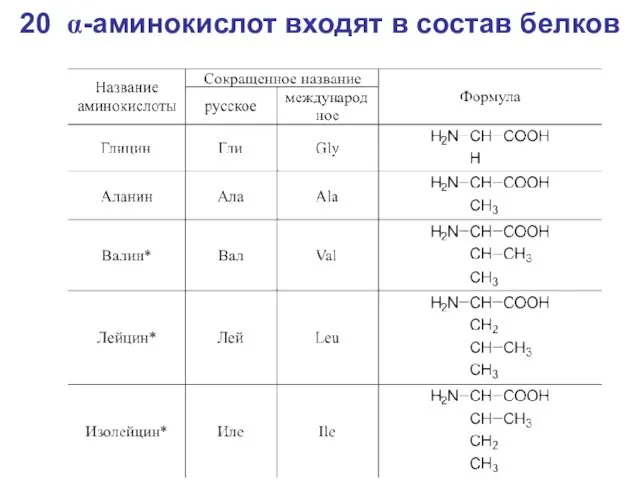
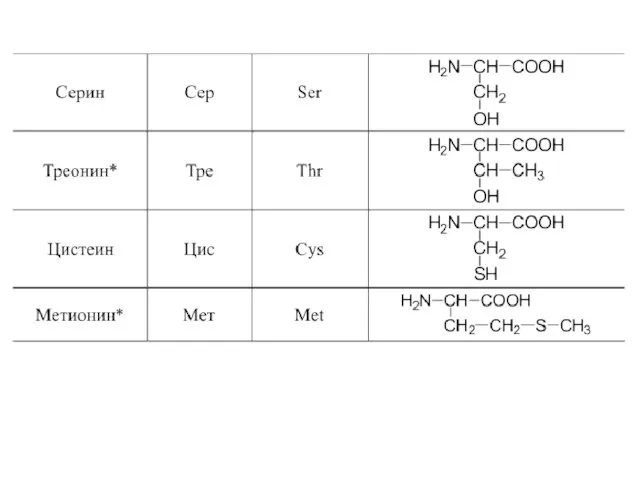
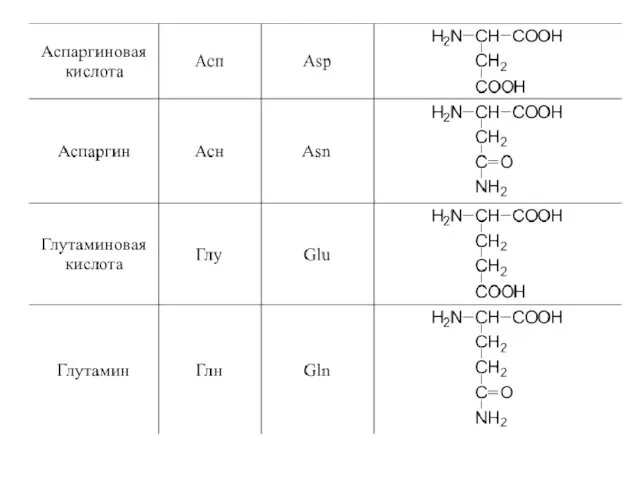
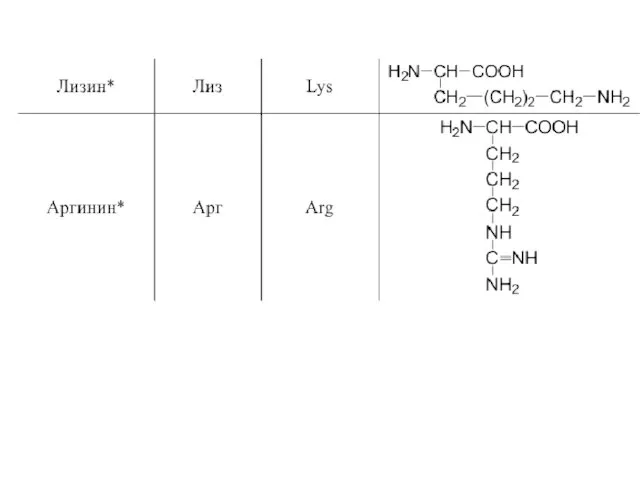
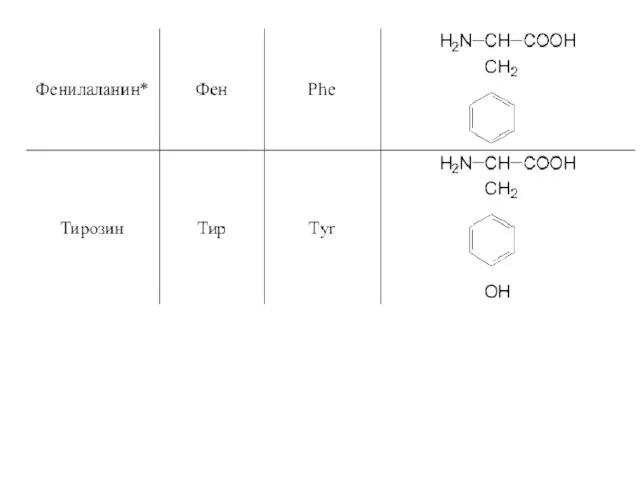
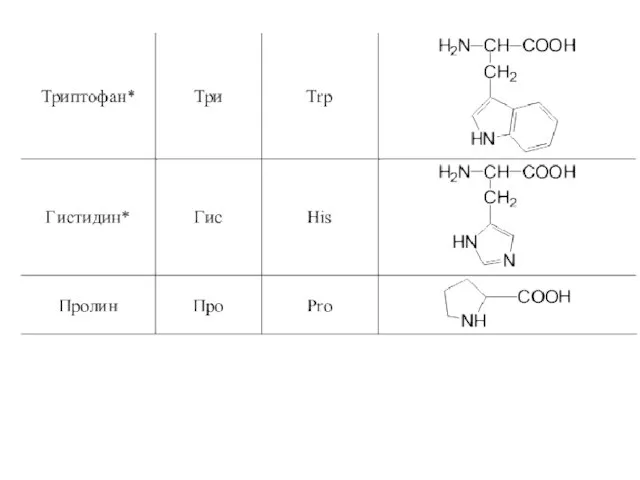
- 42. 20 α-аминокислот входят в состав белков
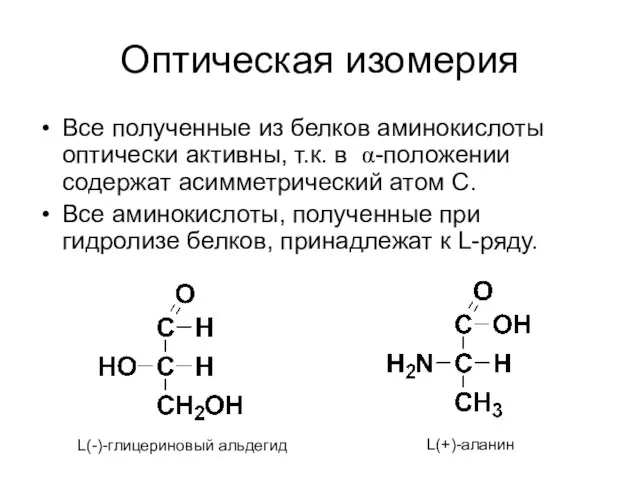
- 48. Оптическая изомерия Все полученные из белков аминокислоты оптически активны, т.к. в α-положении содержат асимметрический атом С.
- 49. Физические и химические свойства аминокислот
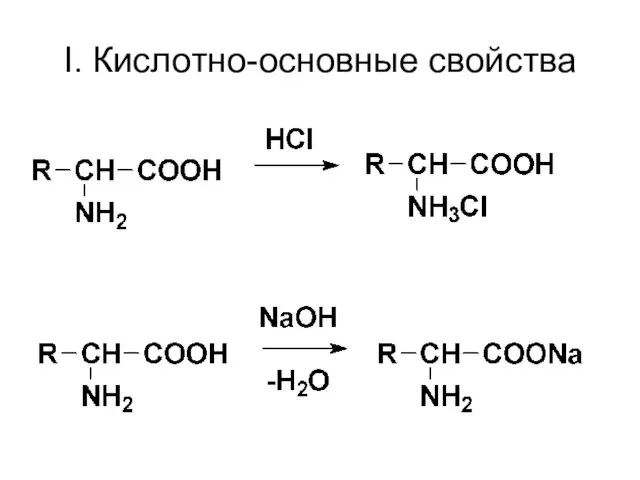
- 50. I. Кислотно-основные свойства
- 51. Высокая температура плавления, легкость кристаллизации, высокие дипольные моменты и хорошая растворимость аминокислот в воде объясняются их
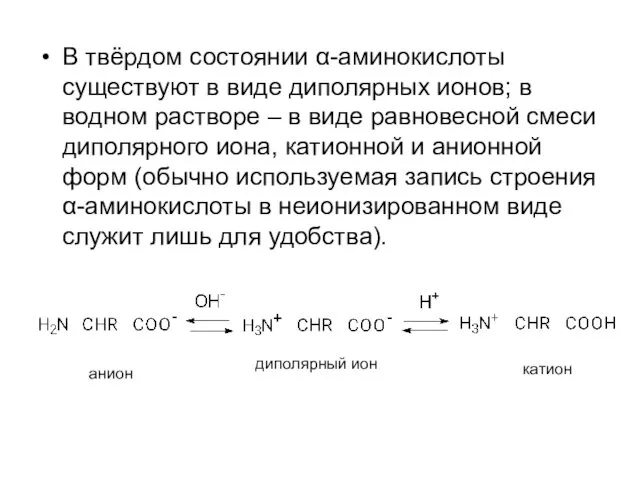
- 52. В твёрдом состоянии α-аминокислоты существуют в виде диполярных ионов; в водном растворе – в виде равновесной
- 53. Положение равновесия, т.е. соотношение различных форм аминокислоты, в водном растворе при определённых значениях рН существенно зависит
- 54. Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм α-аминокислоты
- 55. II. Все реакции карбоновых кислот, протекающие за счёт карбоксильной группы (-COOH), т.е. они образуют: соли (с
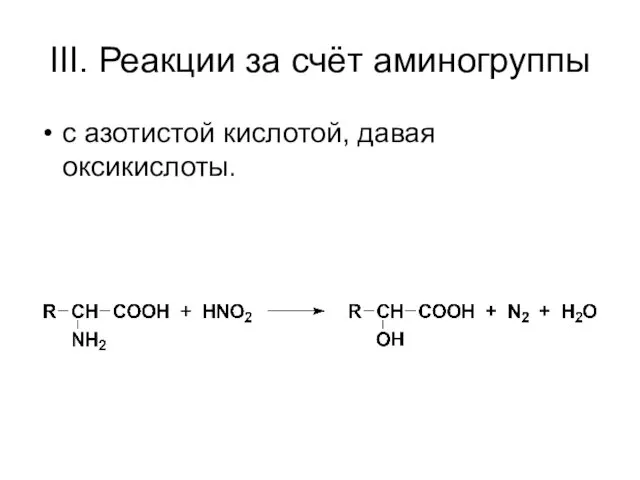
- 56. III. Реакции за счёт аминогруппы с азотистой кислотой, давая оксикислоты.
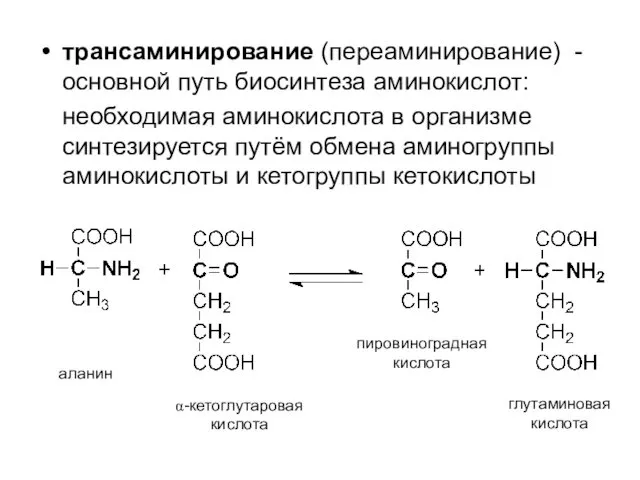
- 57. трансаминирование (переаминирование) - основной путь биосинтеза аминокислот: необходимая аминокислота в организме синтезируется путём обмена аминогруппы аминокислоты
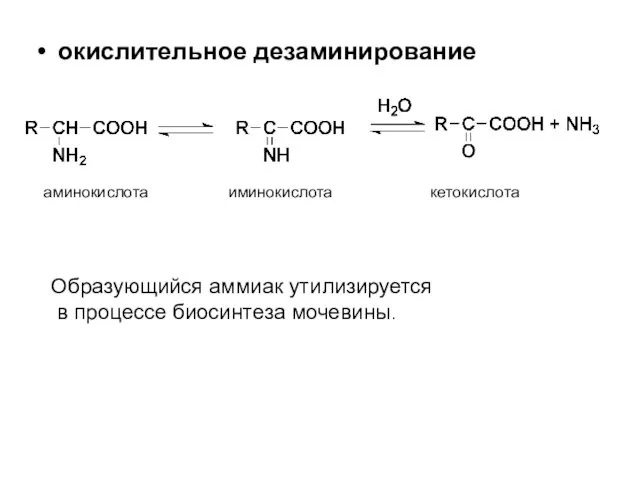
- 58. окислительное дезаминирование аминокислота иминокислота кетокислота Образующийся аммиак утилизируется в процессе биосинтеза мочевины.
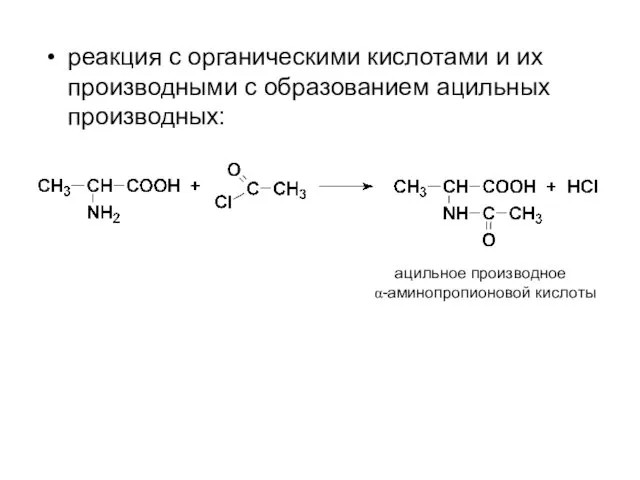
- 59. реакция с органическими кислотами и их производными с образованием ацильных производных: ацильное производное α-аминопропионовой кислоты
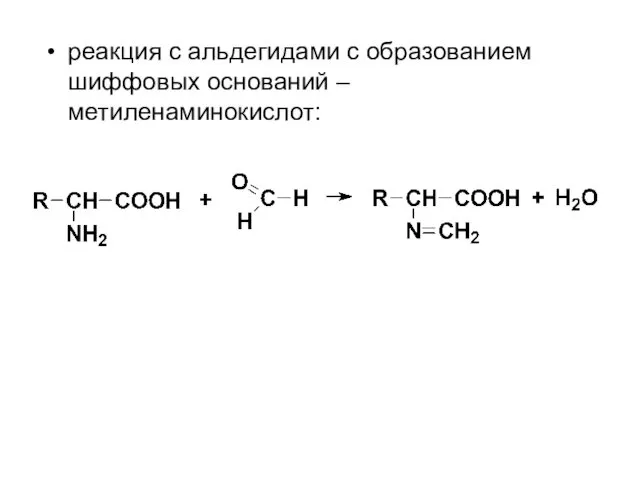
- 60. реакция с альдегидами с образованием шиффовых оснований – метиленаминокислот:
- 61. IV. Специфические свойства аминокислот Образование пептидов. Одновременное присутствие в молекулах α–аминокислот аминной и карбоксильной групп обусловливает
- 62. Номенклатура пептидов N-концевой аминокислотный остаток (имеющий свободную аминогруппу) пишут с левой стороны формулы, а С-концевой аминокислотный
- 64. Скачать презентацию













 Литий. Физические свойства лития
Литий. Физические свойства лития Игра Самый умный. Химия
Игра Самый умный. Химия Бинарный урок. Минеральные удобрения. (9 класс)
Бинарный урок. Минеральные удобрения. (9 класс) Білки та амінокислоти
Білки та амінокислоти Молекулы и атомы
Молекулы и атомы Химические и физические свойства воды
Химические и физические свойства воды Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас
Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас Хімія елементів VIIВ групи (Mn, Tc, Re)
Хімія елементів VIIВ групи (Mn, Tc, Re) Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical
Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical Серная кислота и ее соли
Серная кислота и ее соли Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Определение содержания общего белка и казеина в молоке формольным методом
Определение содержания общего белка и казеина в молоке формольным методом Геохимия магматического процесса
Геохимия магматического процесса Особенности сжигания газообразного топлива и топливосжигающие устройства
Особенности сжигания газообразного топлива и топливосжигающие устройства Карбонильные соединения
Карбонильные соединения Начала органической химии
Начала органической химии Простые вещества неметаллы
Простые вещества неметаллы Основные классы неорганических соединений
Основные классы неорганических соединений Водород и щелочные металлы
Водород и щелочные металлы Спирти. Феноли. Етери
Спирти. Феноли. Етери Подготовка к итоговой контрольной работе. (9 класс)
Подготовка к итоговой контрольной работе. (9 класс) Колообіг оксигену в природі
Колообіг оксигену в природі Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток
Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток КИСЛОРОД
КИСЛОРОД Отримання нанопорошків. Класифікація. Фізичні методи отримання нанопорошків. . Хімічні методи отримання наноматеріалів
Отримання нанопорошків. Класифікація. Фізичні методи отримання нанопорошків. . Хімічні методи отримання наноматеріалів Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу Алкодиены или диеновые углеводороды
Алкодиены или диеновые углеводороды Металдардыњ механикалыќ ќасиеттері-алюминий
Металдардыњ механикалыќ ќасиеттері-алюминий