Содержание
- 2. План Определение Классификации Номенклатура Нахождение в природе Насыщенные карбонильные соединения Изомерия Способы получения Физические свойства Химические
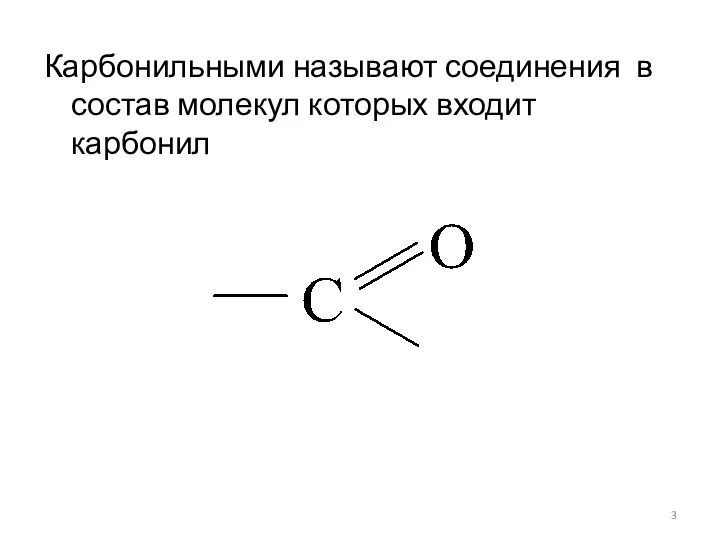
- 3. Карбонильными называют соединения в состав молекул которых входит карбонил
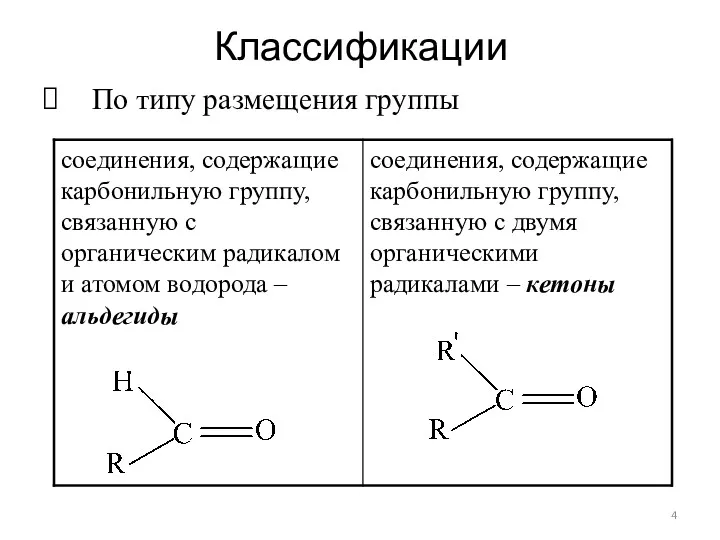
- 4. Классификации По типу размещения группы
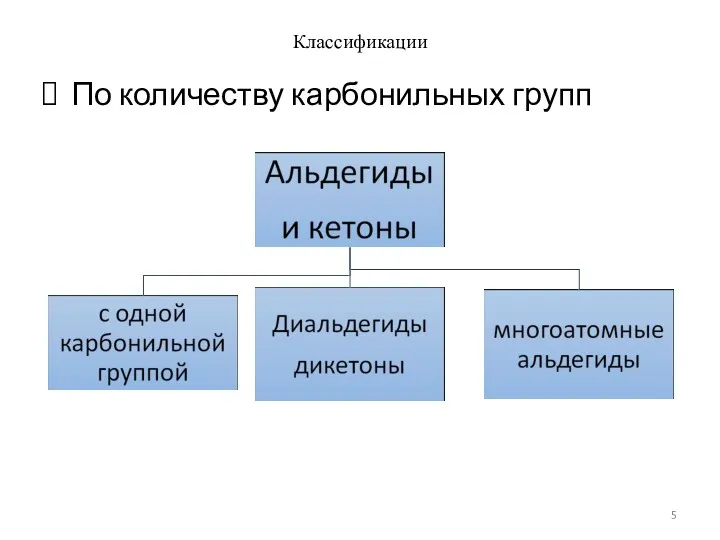
- 5. Классификации По количеству карбонильных групп
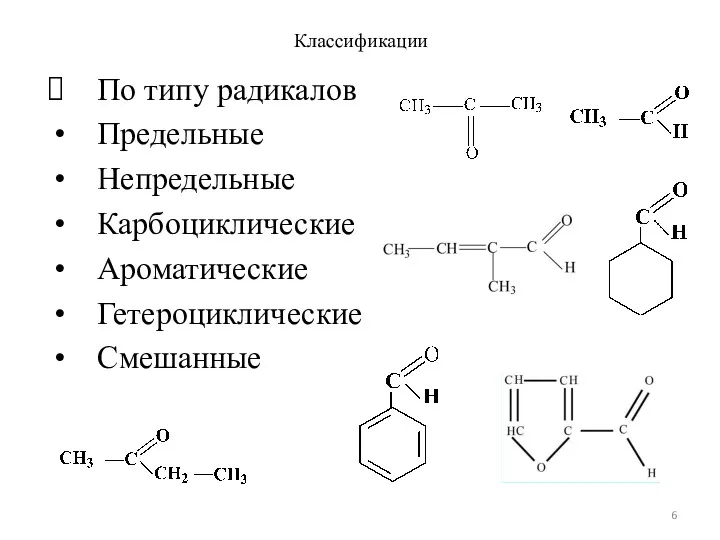
- 6. Классификации По типу радикалов Предельные Непредельные Карбоциклические Ароматические Гетероциклические Смешанные
- 7. Номенклатура Альдегидную группу по систематической номенклатуре обозначают суффиксами –аль и –карбальдегид или приставками оксо- и формил-.
- 8. Номенклатура. Типичные представители
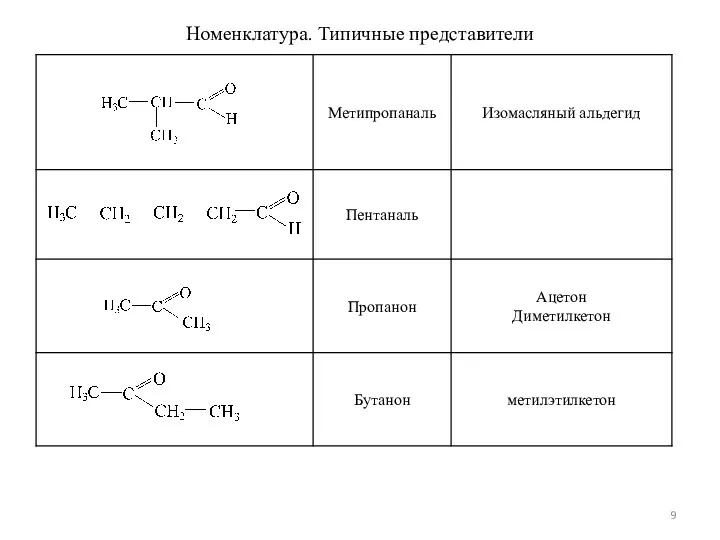
- 9. Номенклатура. Типичные представители
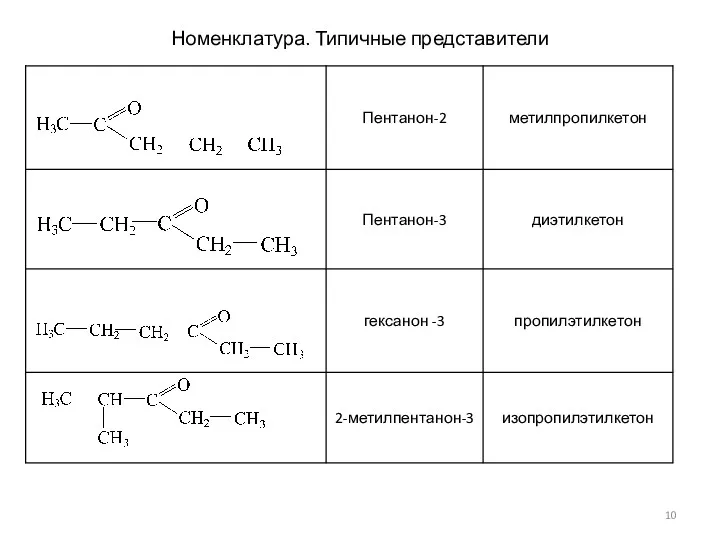
- 10. Номенклатура. Типичные представители
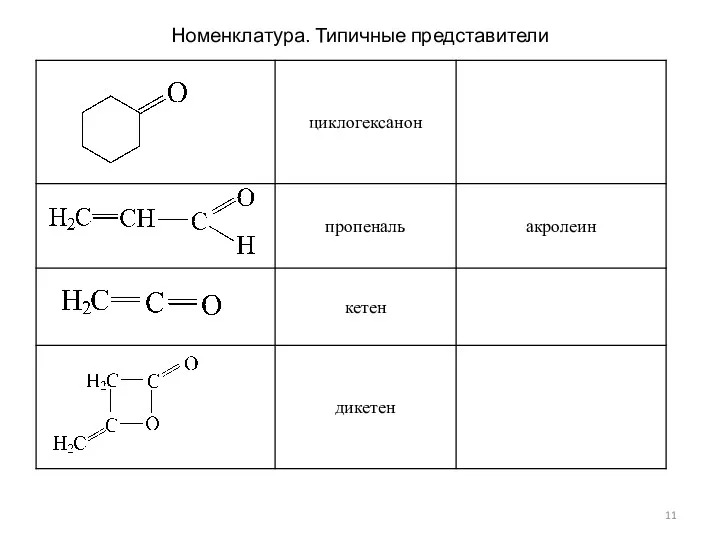
- 11. Номенклатура. Типичные представители
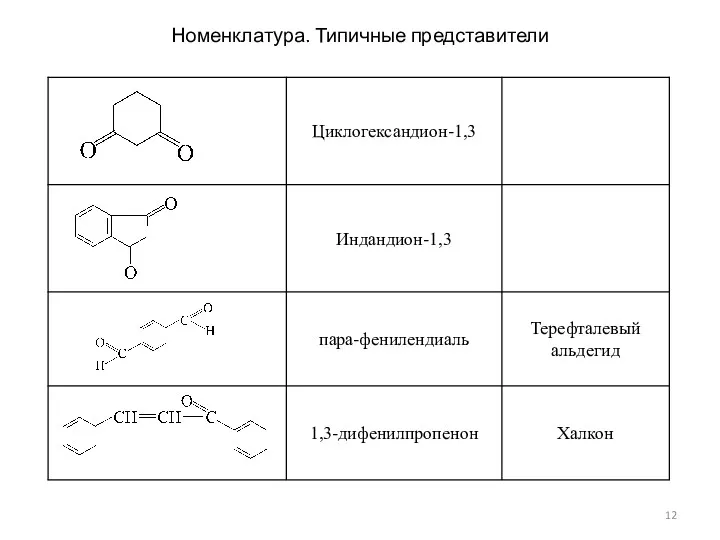
- 12. Номенклатура. Типичные представители
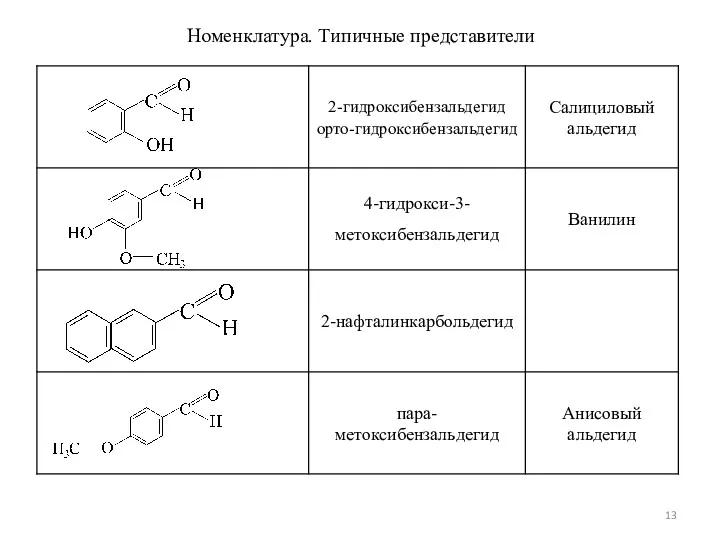
- 13. Номенклатура. Типичные представители
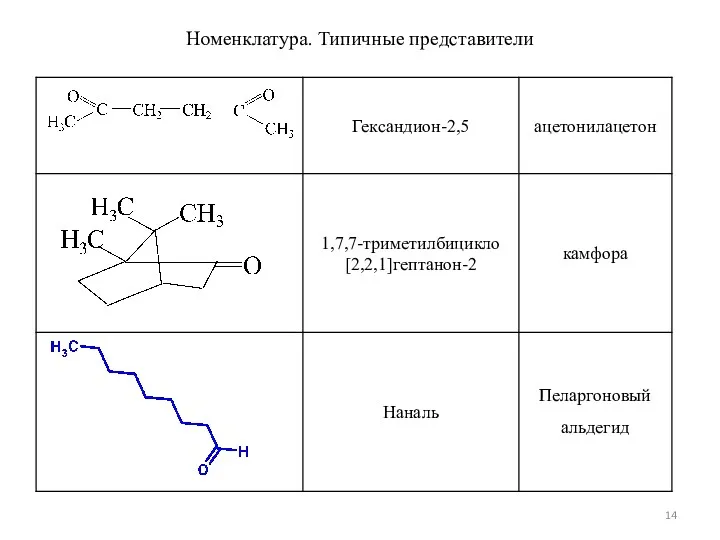
- 14. Номенклатура. Типичные представители
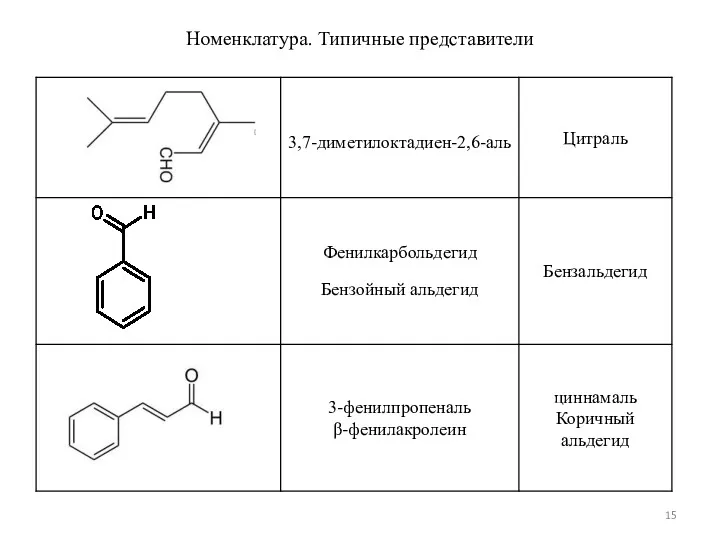
- 15. Номенклатура. Типичные представители
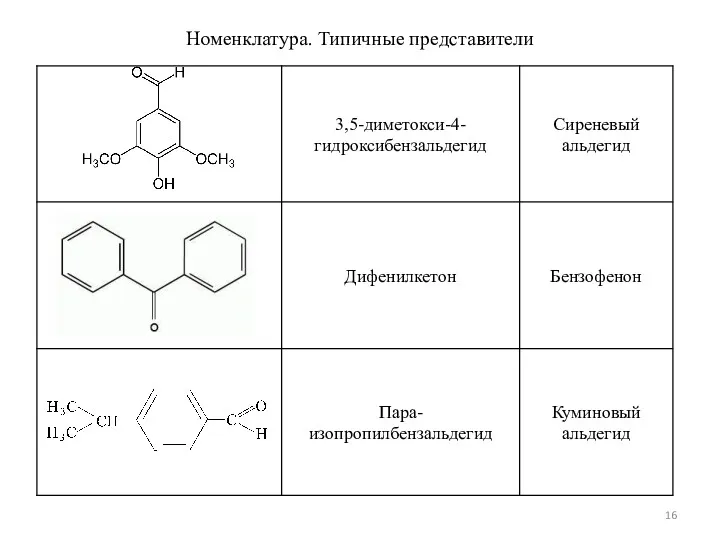
- 16. Номенклатура. Типичные представители
- 17. Нахождение в природе
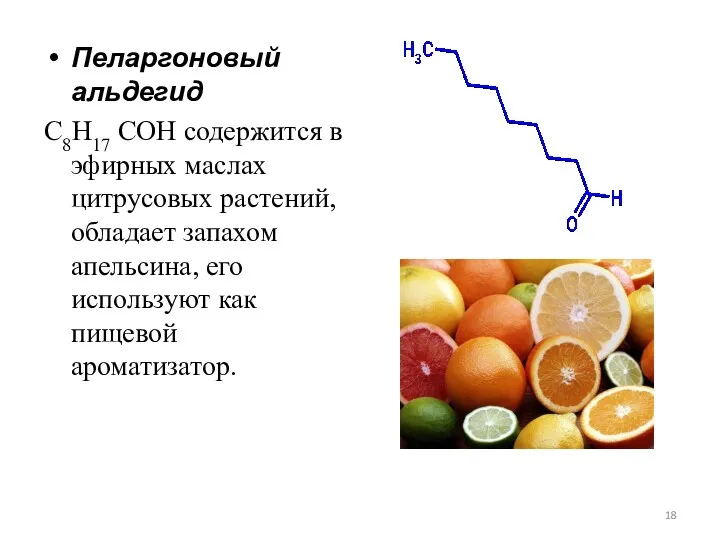
- 18. Пеларгоновый альдегид С8H17 COH содержится в эфирных маслах цитрусовых растений, обладает запахом апельсина, его используют как
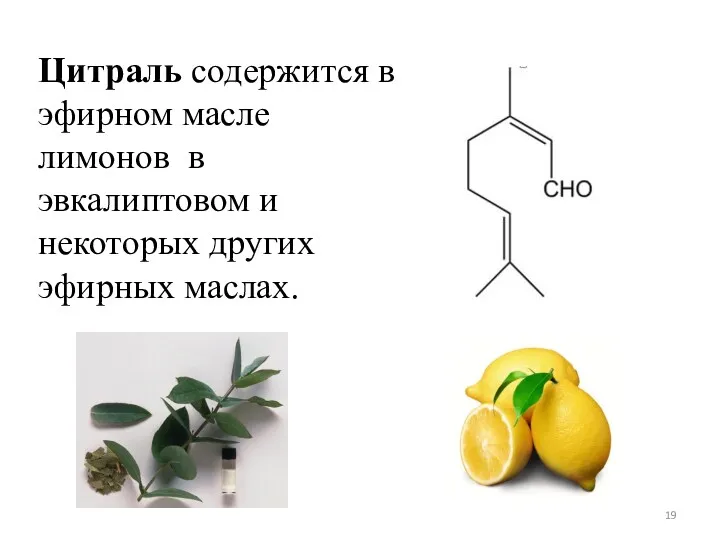
- 19. Цитраль содержится в эфирном масле лимонов в эвкалиптовом и некоторых других эфирных маслах.
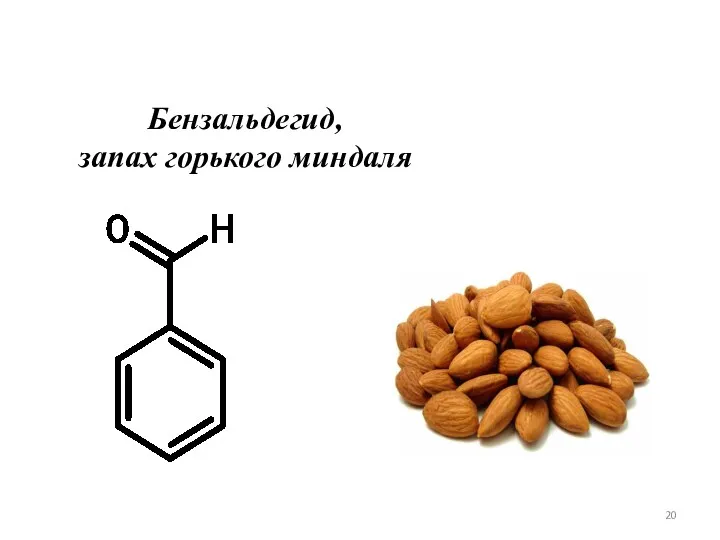
- 20. Бензальдегид, запах горького миндаля
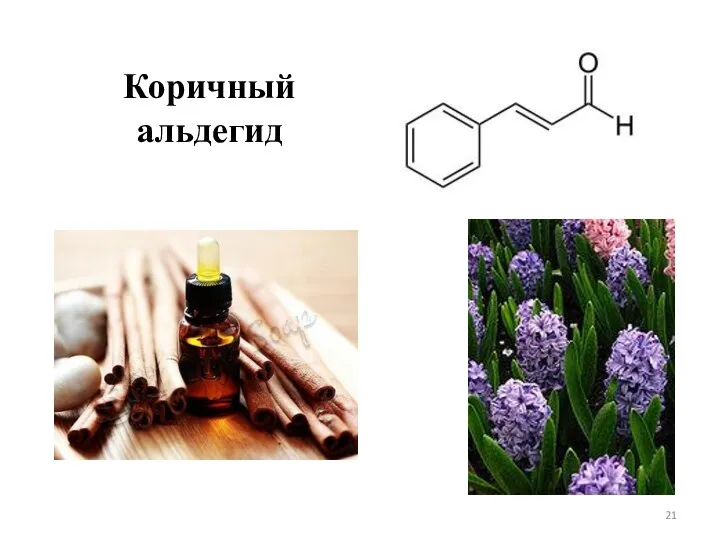
- 21. Коричный альдегид
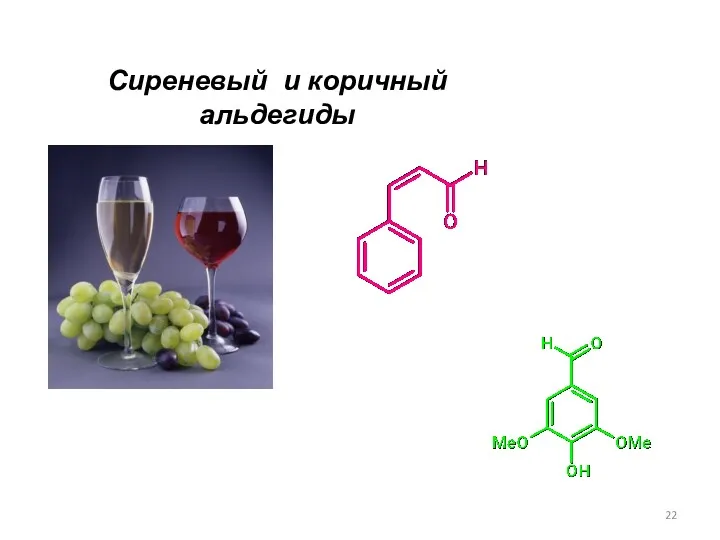
- 22. Сиреневый и коричный альдегиды
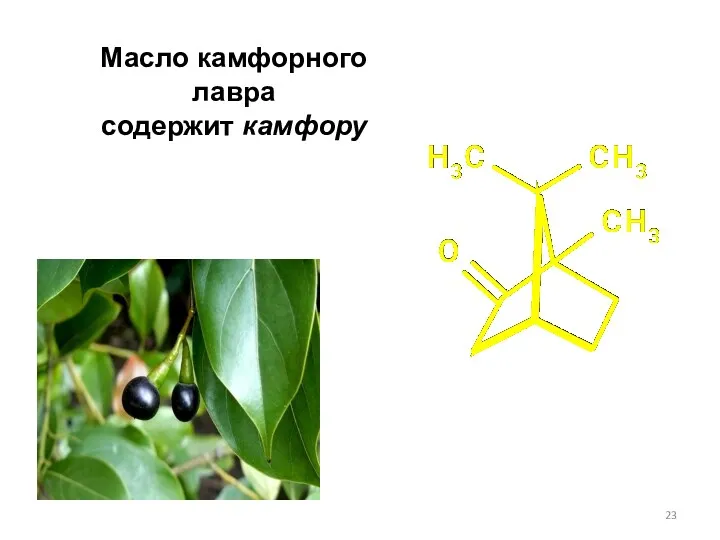
- 23. Масло камфорного лавра содержит камфору
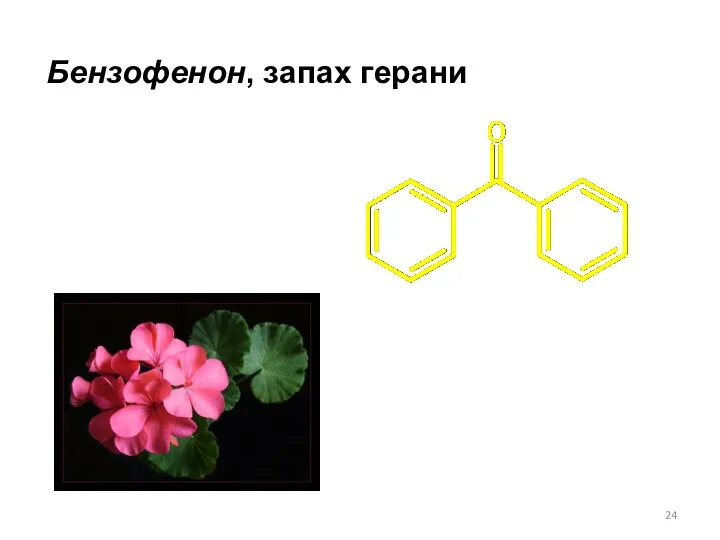
- 24. Бензофенон, запах герани
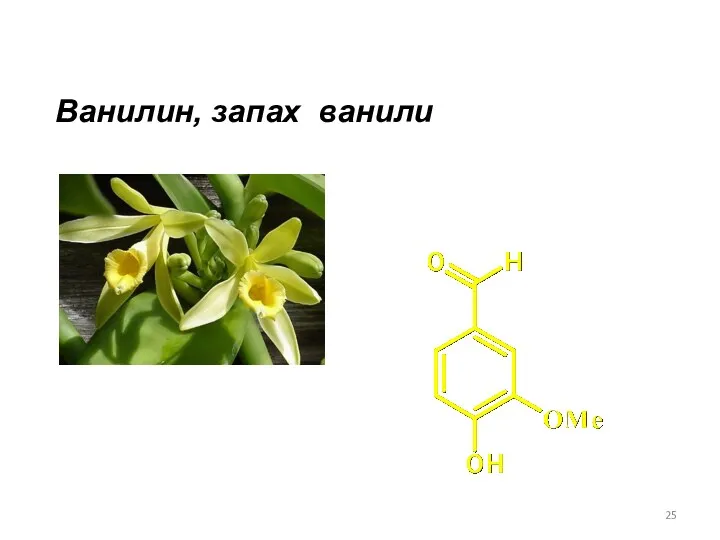
- 25. Ванилин, запах ванили
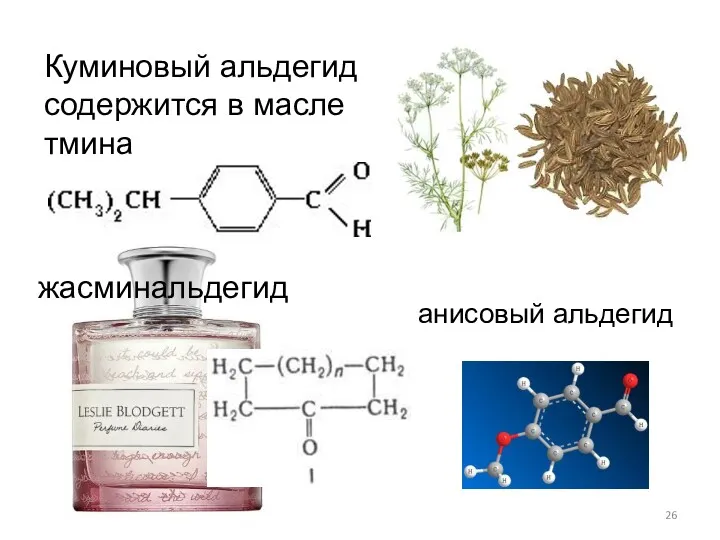
- 26. Куминовый альдегид содержится в масле тмина анисовый альдегид жасминальдегид
- 27. Многие насекомые при нападении врагов используют средства химической защиты Цитраль, содержится в организме муравьев Долиходиал, содержится
- 28. Насыщенные монокарбонильные соединения
- 29. Физические свойства Низшие представители гомологического ряда предельных альдегидов и кетонов – легкие жидкости, растворимы в воде,
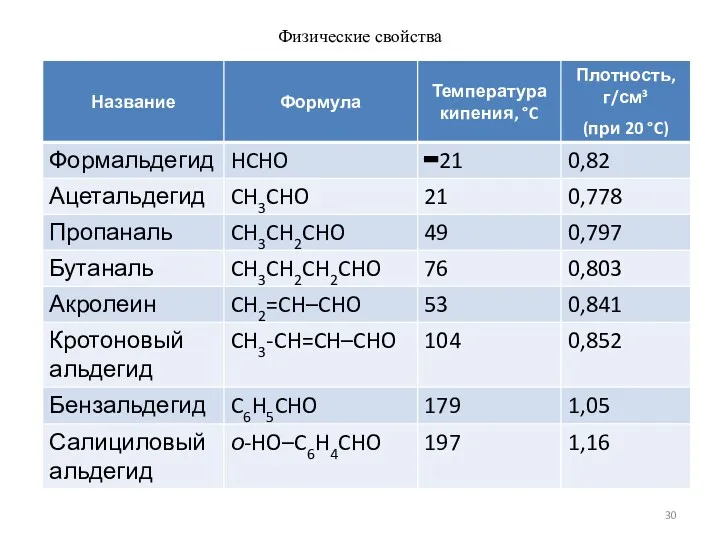
- 30. Физические свойства
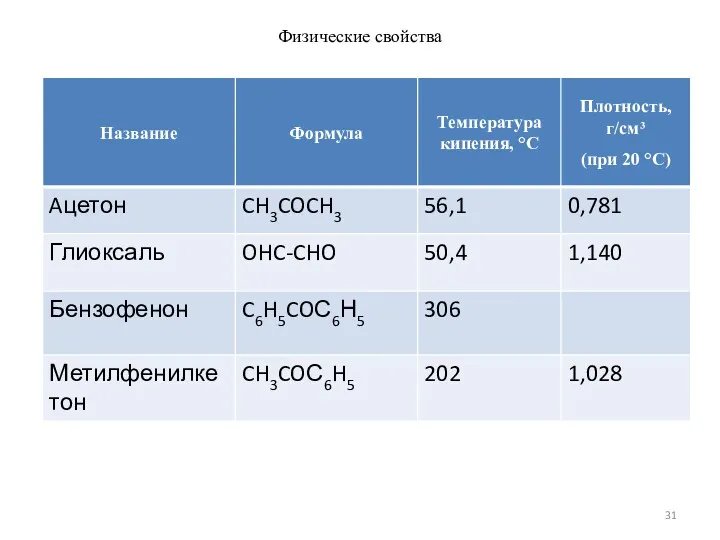
- 31. Физические свойства
- 32. Изомерия Структурная изомерия углеводородных радикалов характерная для всех карбонильных соединений Изомерия положения функциональной группы характерна для
- 33. Способы получения Окисление и дегидрирование спиртов (см. химические свойства спиртов) Окисление алкенов (см. химические свойства алкенов)
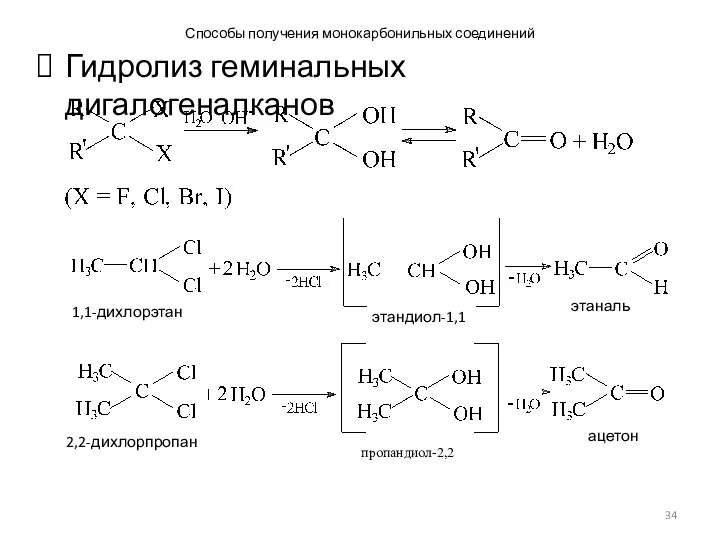
- 34. Способы получения монокарбонильных соединений Гидролиз геминальных дигалогеналканов
- 35. Химические свойства Альдегиды и кетоны принадлежат к наиболее реакционным органическим соединениям, причём альдегиды химически активнее кетонов.
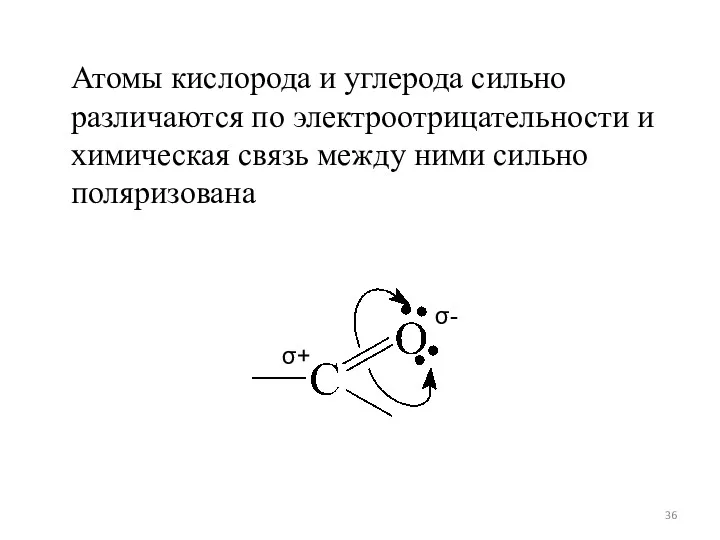
- 36. Атомы кислорода и углерода сильно различаются по электроотрицательности и химическая связь между ними сильно поляризована
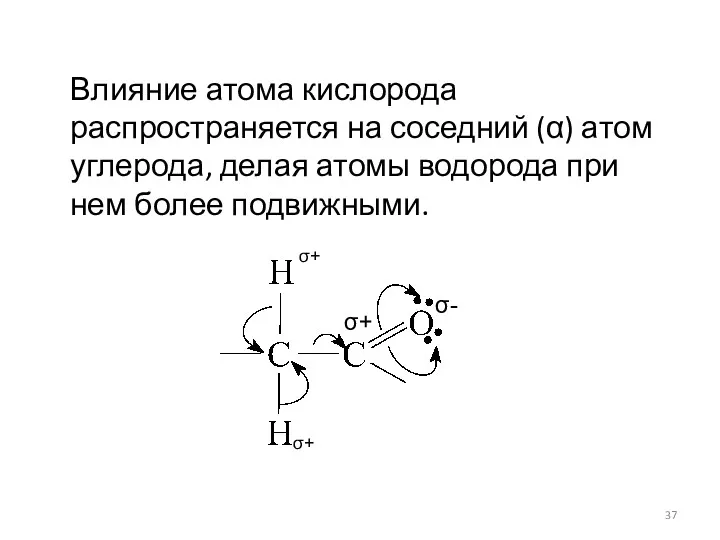
- 37. Влияние атома кислорода распространяется на соседний (α) атом углерода, делая атомы водорода при нем более подвижными.
- 38. Химические свойства монокарбонильных соединений Все химические свойства карбонильных соединений можно разделить на следующие группы: Присоединение по
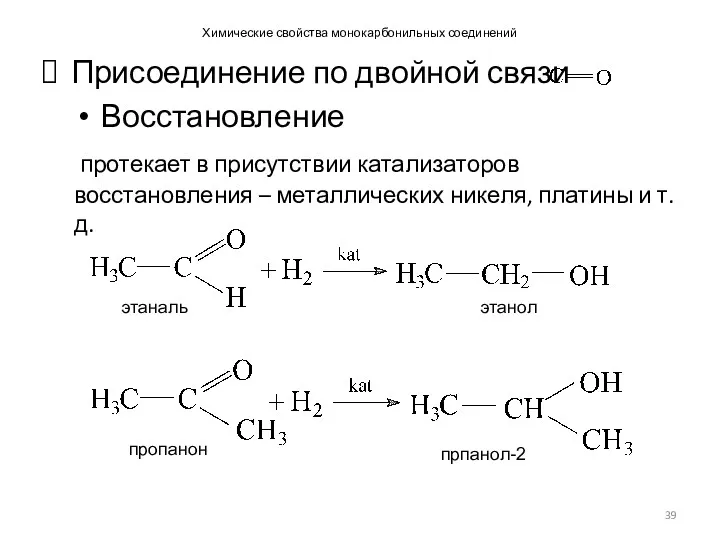
- 39. Химические свойства монокарбонильных соединений Присоединение по двойной связи Восстановление протекает в присутствии катализаторов восстановления – металлических
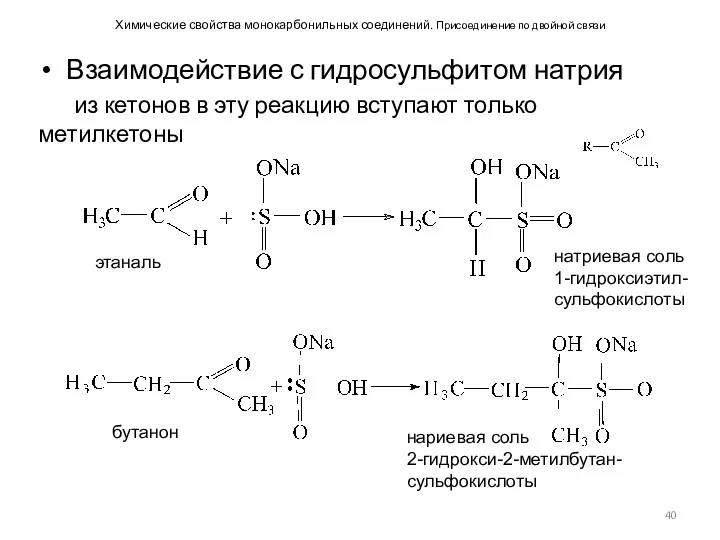
- 40. Химические свойства монокарбонильных соединений. Присоединение по двойной связи Взаимодействие с гидросульфитом натрия из кетонов в эту
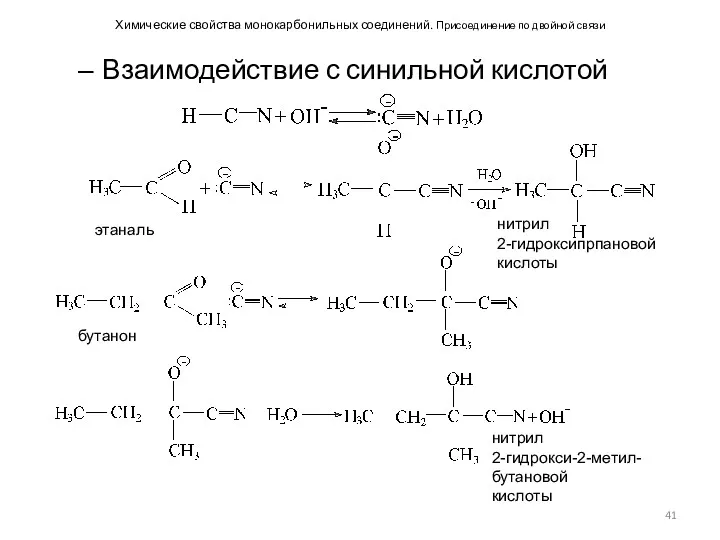
- 41. Химические свойства монокарбонильных соединений. Присоединение по двойной связи Взаимодействие с синильной кислотой
- 42. Химические свойства монокарбонильных соединений. Присоединение по двойной связи Взаимодействие со спиртами Реакция идет только с очень
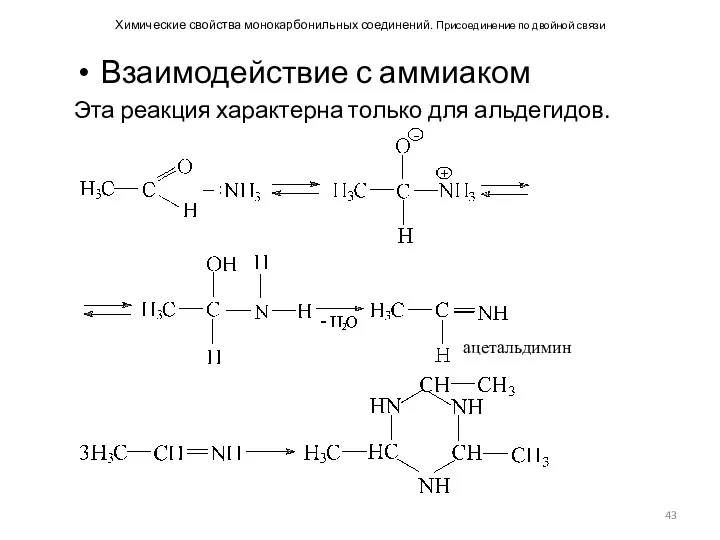
- 43. Химические свойства монокарбонильных соединений. Присоединение по двойной связи Взаимодействие с аммиаком Эта реакция характерна только для
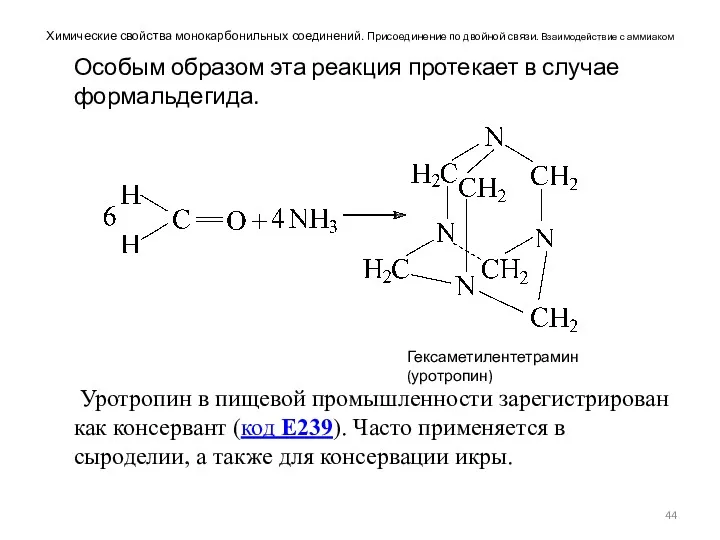
- 44. Химические свойства монокарбонильных соединений. Присоединение по двойной связи. Взаимодействие с аммиаком Особым образом эта реакция протекает
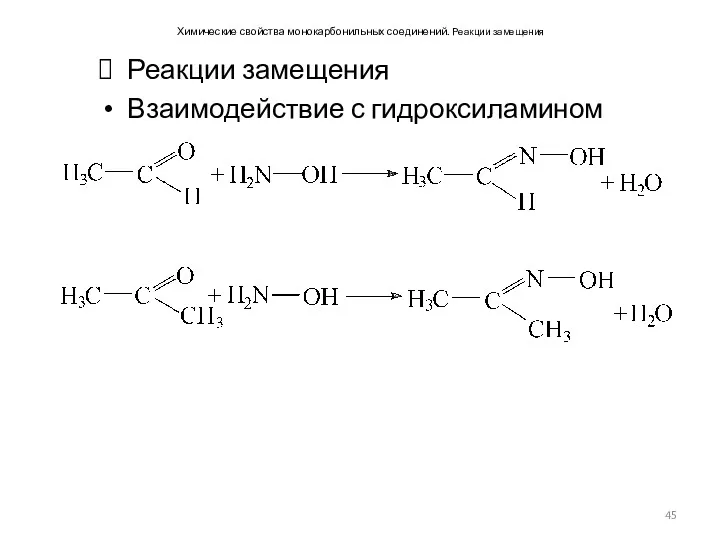
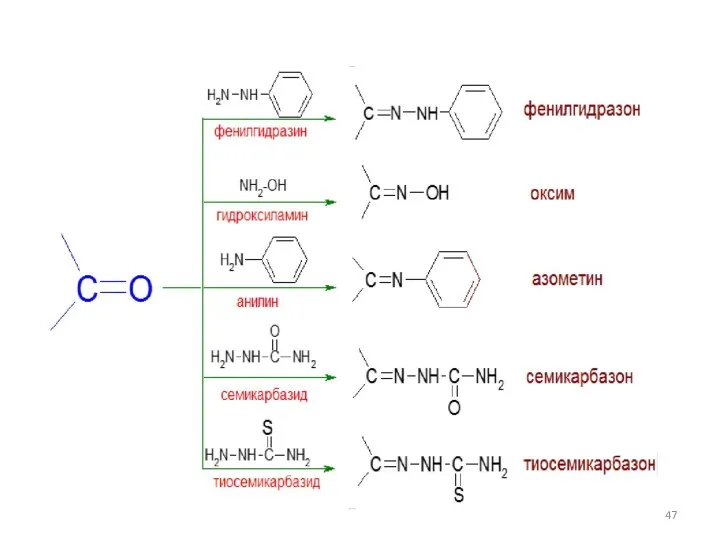
- 45. Химические свойства монокарбонильных соединений. Реакции замещения Реакции замещения Взаимодействие с гидроксиламином
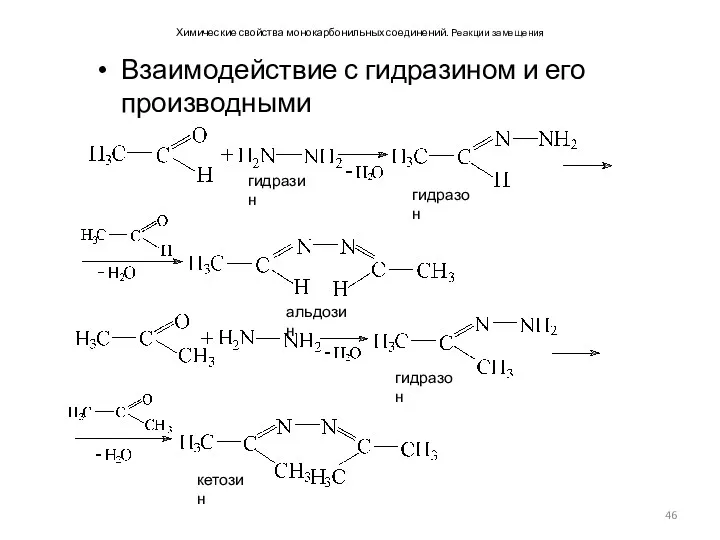
- 46. Химические свойства монокарбонильных соединений. Реакции замещения Взаимодействие с гидразином и его производными
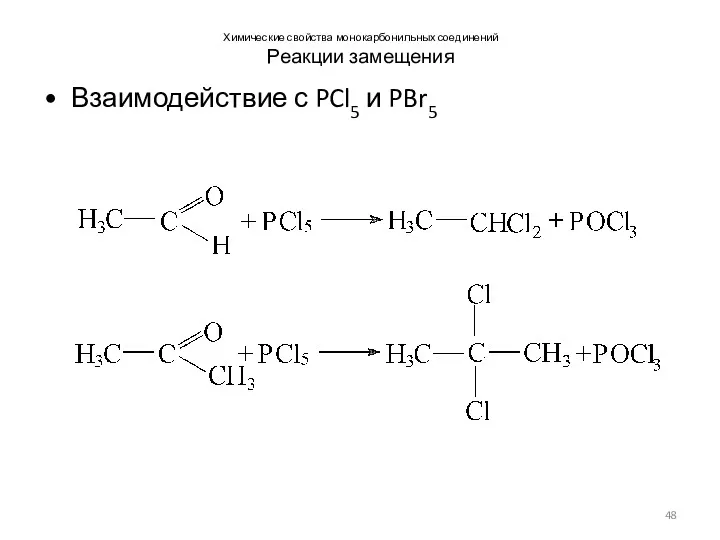
- 48. Химические свойства монокарбонильных соединений Реакции замещения Взаимодействие с PCl5 и PBr5
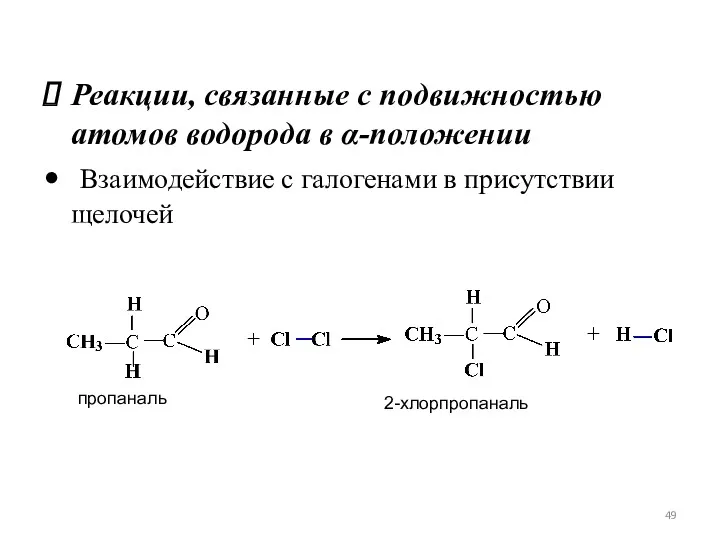
- 49. Реакции, связанные с подвижностью атомов водорода в α-положении Взаимодействие с галогенами в присутствии щелочей
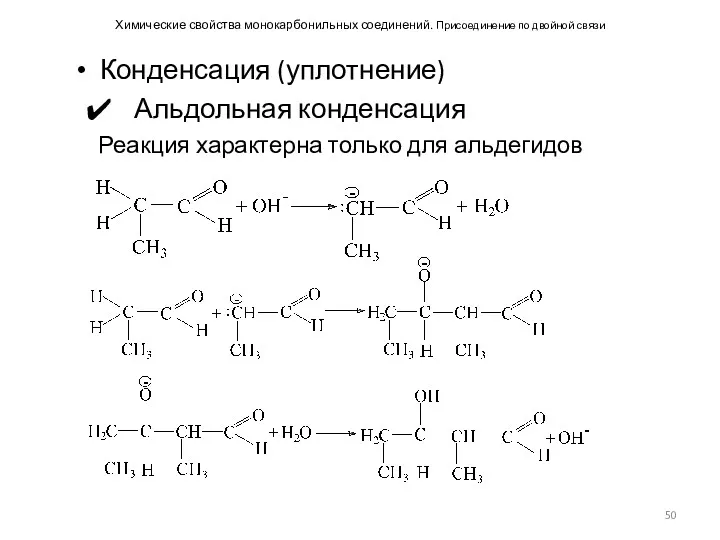
- 50. Химические свойства монокарбонильных соединений. Присоединение по двойной связи Конденсация (уплотнение) Альдольная конденсация Реакция характерна только для
- 51. Химические свойства монокарбонильных соединений. Присоединение по двойной связи. Конденсация (уплотнение) Кротоновая конденсация Продукты альдольного присоединения в
- 52. Химические свойства монокарбонильных соединений. Присоединение по двойной связи. Конденсация (уплотнение) Кротоновая конденсация Своё название эта реакция
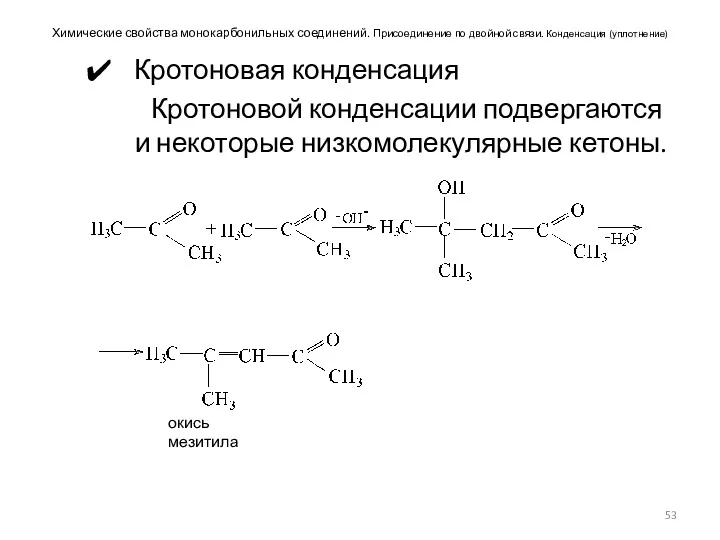
- 53. Химические свойства монокарбонильных соединений. Присоединение по двойной связи. Конденсация (уплотнение) Кротоновая конденсация Кротоновой конденсации подвергаются и
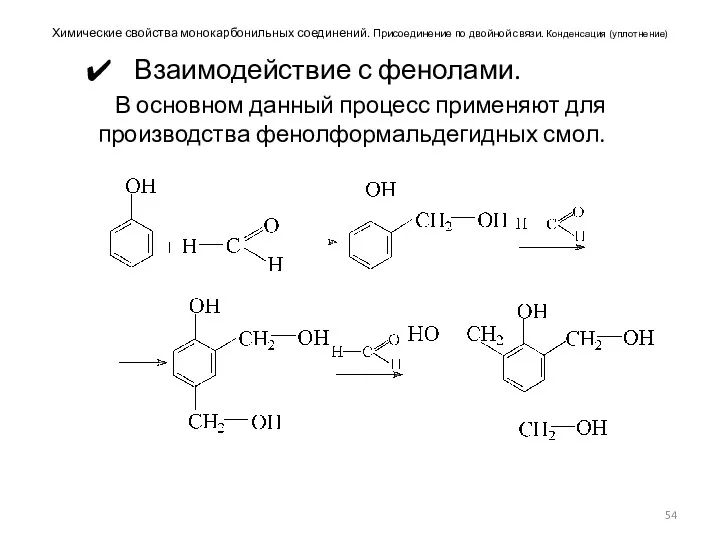
- 54. Химические свойства монокарбонильных соединений. Присоединение по двойной связи. Конденсация (уплотнение) Взаимодействие с фенолами. В основном данный
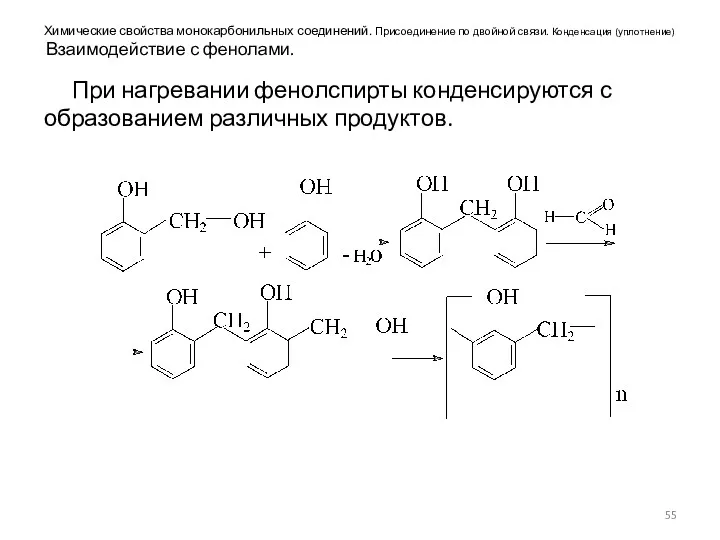
- 55. Химические свойства монокарбонильных соединений. Присоединение по двойной связи. Конденсация (уплотнение) Взаимодействие с фенолами. При нагревании фенолспирты
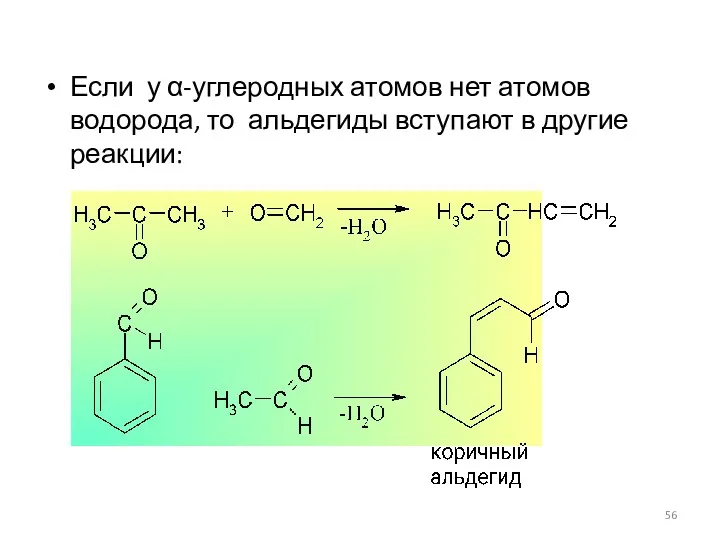
- 56. Если у α-углеродных атомов нет атомов водорода, то альдегиды вступают в другие реакции:
- 57. Химические свойства монокарбонильных соединений Окисление Реакция Канницаро В щелочных растворах при нагревании альдегиды диспропорционируют
- 58. Химические свойства монокарбонильных соединений. Окисление Реакция Тищенко В присутствии алкоголятов алюминия альдегиды диспропорционируют
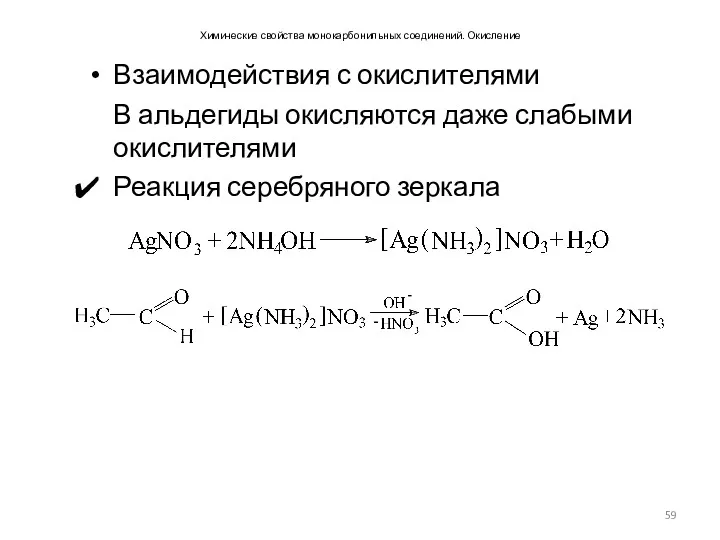
- 59. Химические свойства монокарбонильных соединений. Окисление Взаимодействия с окислителями В альдегиды окисляются даже слабыми окислителями Реакция серебряного
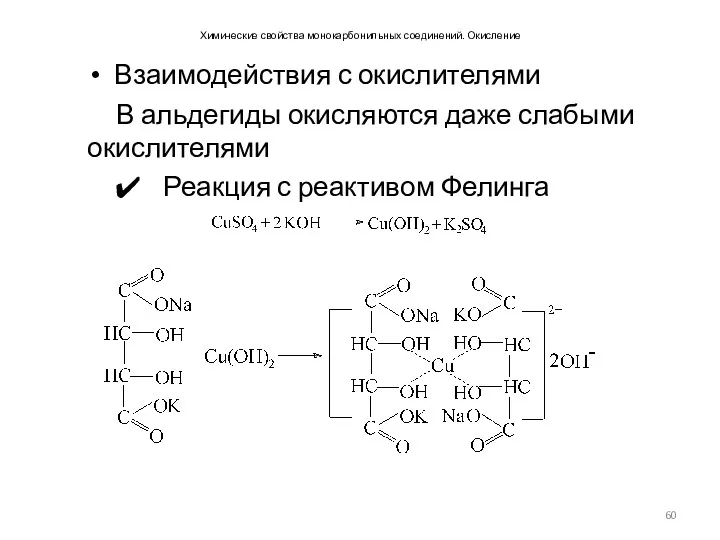
- 60. Химические свойства монокарбонильных соединений. Окисление Взаимодействия с окислителями В альдегиды окисляются даже слабыми окислителями Реакция с
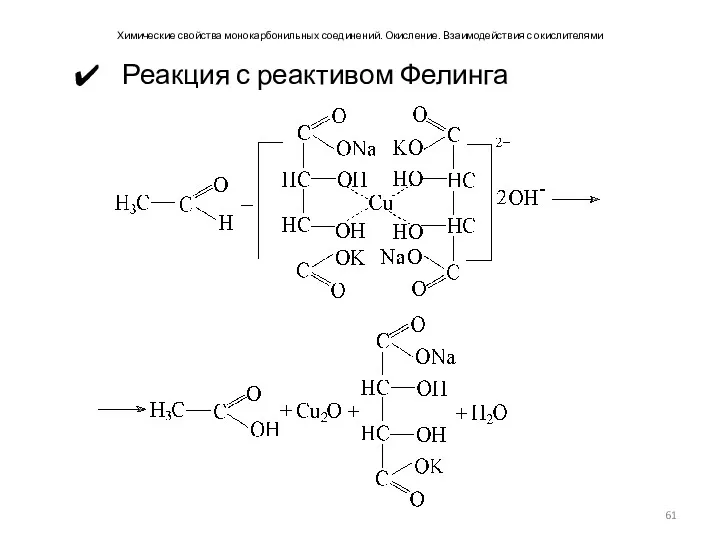
- 61. Химические свойства монокарбонильных соединений. Окисление. Взаимодействия с окислителями Реакция с реактивом Фелинга
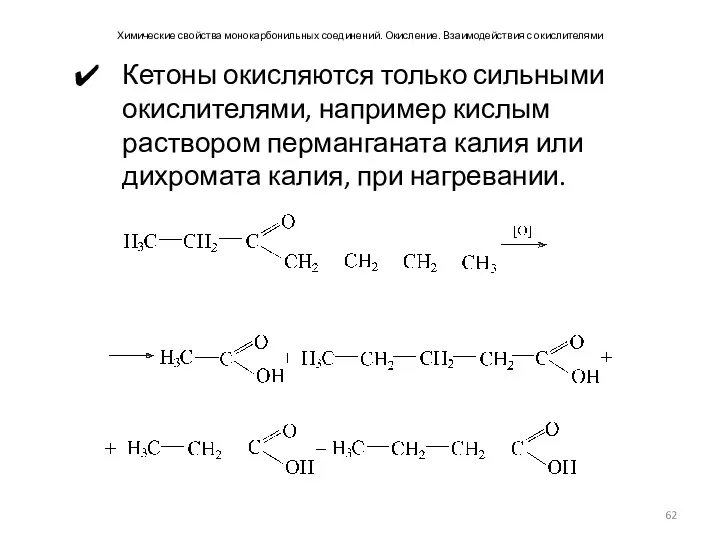
- 62. Химические свойства монокарбонильных соединений. Окисление. Взаимодействия с окислителями Кетоны окисляются только сильными окислителями, например кислым раствором
- 63. Отдельные представители
- 64. Формальдегид. Метаналь. ( formīca «муравей») — бесцветный газ с резким запахом, хорошо растворимый в воде, спиртах
- 65. Метаналь применяют для производства фенолоформальдегидных пластмасс и многих лекарственных препаратов, например уротропина. Иногда спрессованный в виде
- 66. Раствор формальдегида в воде называют формалином, его используют для хранения биопрепаратов, протравливания семян перед посевом, дубления
- 67. Уксусный альдегид (этаналь, ацетальдегид) Бесцветная жидкость с резким запахом, хорошо растворяется в воде, спирте, эфире. Из-за
- 68. Акролеин Вследствие своей высокой реакционной способности акролеин является токсичным, сильно раздражающим слизистые оболочки глаз и дыхательных
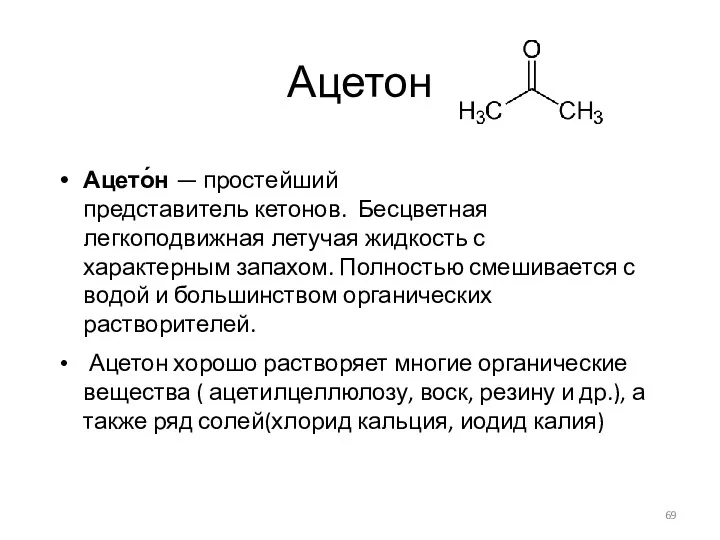
- 69. Ацетон Ацето́н — простейший представитель кетонов. Бесцветная легкоподвижная летучая жидкость с характерным запахом. Полностью смешивается с
- 70. В качестве растворителя ацетон используется в производстве красок, лаков и олифы, резины, пластмасс, красителей, взрывчатых веществ,
- 71. Опасность для здоровья!!! Кетоны - легковоспламеняющиеся вещества, а наиболее летучие представители этого класса химических соединений способны
- 72. Применение. Основное количество получаемого в промышленности ацетальдегида используют для производства уксусной кислоты, а также различных пластмасс
- 73. Ненасыщенные карбонильные соединения
- 74. Карбонильные соединения аренов
- 76. Скачать презентацию


























 Строение атома. Периодический закон
Строение атома. Периодический закон Кислород и его свойства
Кислород и его свойства Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Chemistry th 11 grade The end of second Term
Chemistry th 11 grade The end of second Term Фосфор. Открытие фосфора
Фосфор. Открытие фосфора Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі
Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Щелочные металлы. Положение в ПСХЭ
Щелочные металлы. Положение в ПСХЭ Химический состав клетки. Неорганические вещества клетки. 10 класс
Химический состав клетки. Неорганические вещества клетки. 10 класс Химические реакции
Химические реакции Анализ лекарственных форм
Анализ лекарственных форм Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Спекание. Основные типы спекания
Спекание. Основные типы спекания Химическая промышленность России входит в авангардную тройку
Химическая промышленность России входит в авангардную тройку Кристаллическое строение и свойства металлов
Кристаллическое строение и свойства металлов Основы химического равновесия
Основы химического равновесия Гравиметрический метод анализа
Гравиметрический метод анализа Фосфор и его соединения
Фосфор и его соединения Окислительно-восстановительные электроды
Окислительно-восстановительные электроды Коррозия металлов
Коррозия металлов Використання хімічних явищ у художній творчості й народних ремеслах
Використання хімічних явищ у художній творчості й народних ремеслах Геохимия, как наука
Геохимия, как наука Реакции ионного обмена. Теория химического строения органических соединений. 9 класс
Реакции ионного обмена. Теория химического строения органических соединений. 9 класс Курс лекций: Методы диагностики и анализа микро- и наносистем
Курс лекций: Методы диагностики и анализа микро- и наносистем Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли Analytical methods in modern research. Chromatography
Analytical methods in modern research. Chromatography Жесткость воды и способы её устранения
Жесткость воды и способы её устранения Хозяйственные товары из пластических масс
Хозяйственные товары из пластических масс