Содержание
- 2. 1789г. Роберт Бойль 1673г. 1748г. М. В. Ломоносов Антуан Лавуазье
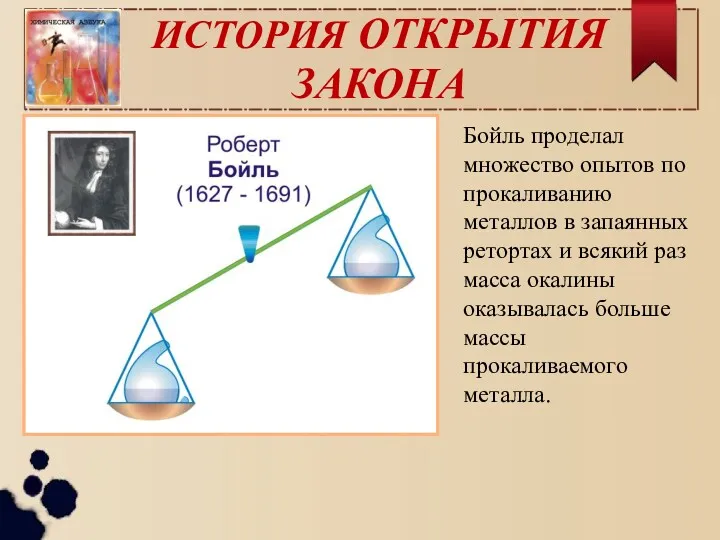
- 3. ИСТОРИЯ ОТКРЫТИЯ ЗАКОНА Бойль проделал множество опытов по прокаливанию металлов в запаянных ретортах и всякий раз
- 4. ИСТОРИЯ ОТКРЫТИЯ ЗАКОНА Русский учёный М.В. Ломоносов предположил, что чувственный опыт обманывает нас. 5 июля 1748
- 5. М.В Ломоносов сформулировал закон сохранения массы в 1748 г., а экспериментально подтвердил в 1756 г. Закон
- 6. История открытия закона Значительно позже этот закон, независимо от М.В. Ломоносова, был открыт французским ученым А.Лавуазье.
- 7. Химические уравнения Химическое уравнение – условная запись химической реакции с помощью химических формул и коэффициентов С
- 8. Алгоритм составления уравнений 1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию).
- 9. Алгоритм составления уравнений 3. Согласно закону сохранения массы веществ число атомов до и после реакции должно
- 10. Закрепление 1. Cu + O2 → CuO 2. HCl → H2 +Cl2 3. Ag2O + C
- 12. Скачать презентацию








 Теория электролитической диссоциации
Теория электролитической диссоциации Granite
Granite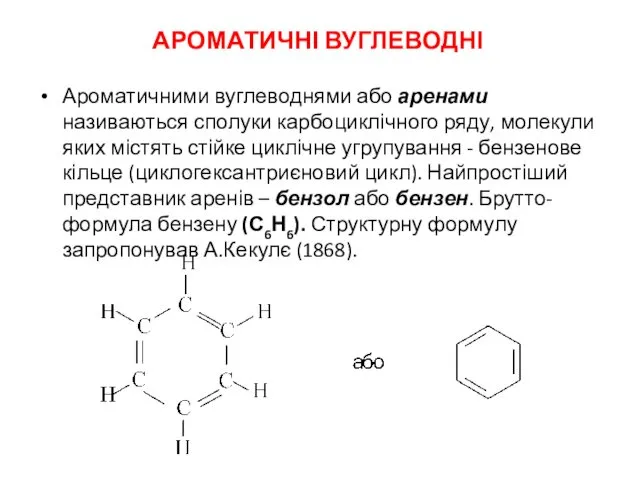 Ароматичні вуглеводні
Ароматичні вуглеводні Органическая химия: Жиры
Органическая химия: Жиры Гидроочистка дизельного топлива
Гидроочистка дизельного топлива Биохимия эритроцита
Биохимия эритроцита Химические свойства металлов
Химические свойства металлов Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения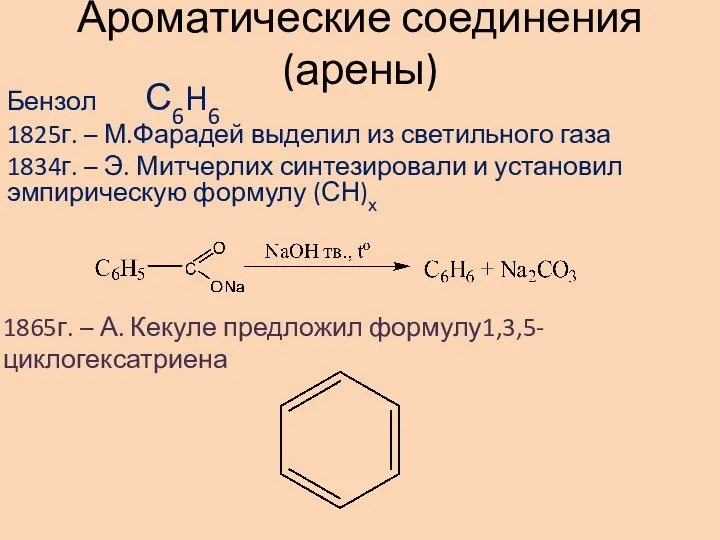 Ароматические соединения (арены)
Ароматические соединения (арены) Аммиак. 9 класс
Аммиак. 9 класс Иондық байланыс
Иондық байланыс Химические свойства солей
Химические свойства солей Строение атома углерода. Валентные состояния атома углерода
Строение атома углерода. Валентные состояния атома углерода Циклоалканы. Предельные углеводороды
Циклоалканы. Предельные углеводороды Основания
Основания Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Классификация химических реакций
Классификация химических реакций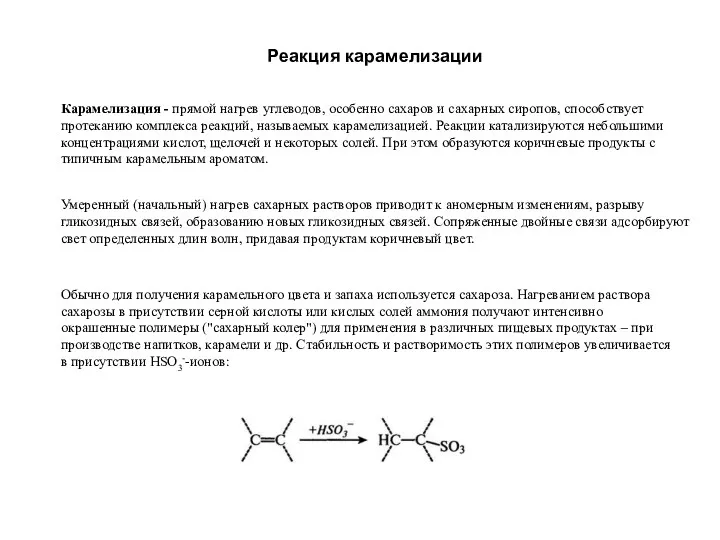 Реакция карамелизации
Реакция карамелизации Золото. Что о нём мы можем рассказать?
Золото. Что о нём мы можем рассказать? Пластмаси. Пластичні маси
Пластмаси. Пластичні маси Общая и неорганическая химия
Общая и неорганическая химия Строение и свойства циклоалканов
Строение и свойства циклоалканов Фосфор и его соединения
Фосфор и его соединения Органическая химия
Органическая химия Соединения галогенов
Соединения галогенов Каучук. Открытие каучука
Каучук. Открытие каучука Окисно-відновні реакції та їхнє значення
Окисно-відновні реакції та їхнє значення Цеолиты. Свойства и область применения
Цеолиты. Свойства и область применения