Содержание
- 2. * Водолазская О.А. * Водолазская О.А. Тема урока: Соединения галогенов. Получение и применение. Цель урока: 1.Рассмотреть
- 3. * Водолазская О.А. * Водолазская О.А. Галогены Галогеноводороды HF HCl HBr HI Общая формула - H+1Г
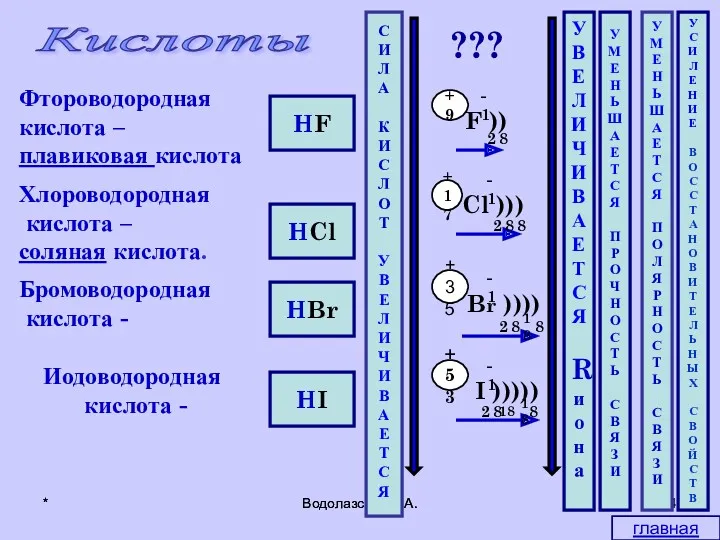
- 4. * Водолазская О.А. * Водолазская О.А. HF HCl HBr HI Кислоты Фтороводородная кислота – плавиковая кислота
- 5. * Водолазская О.А. * Водолазская О.А. Свойства 1.Изменяет цвет индикаторов 2.Ме(до Н2) 5.Соли (более слабых кислот)
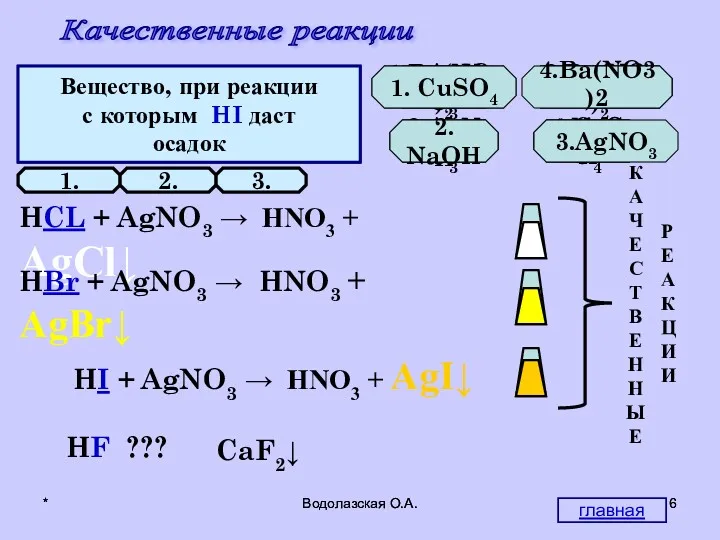
- 6. * Водолазская О.А. * Водолазская О.А. Качественные реакции Вещество, при реакции с которым HCl даст осадок
- 7. * Водолазская О.А. * Водолазская О.А. Получение H2↑ + Cl2 ↑→2 HCl↑ Лабораторный способ: NaCl +
- 8. * Водолазская О.А. * Водолазская О.А. Получение солей При паянии Производство красок Производство пластмасс, синтетических материалов
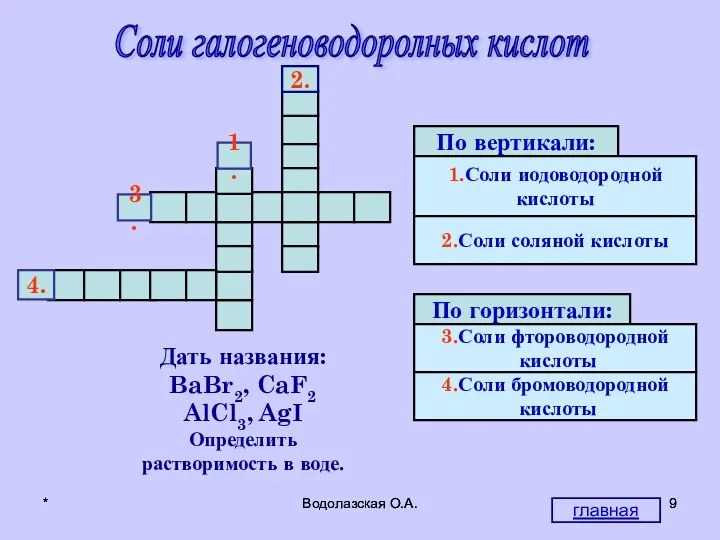
- 9. * Водолазская О.А. * Водолазская О.А. Соли галогеноводоролных кислот М И И Р О Ф Т
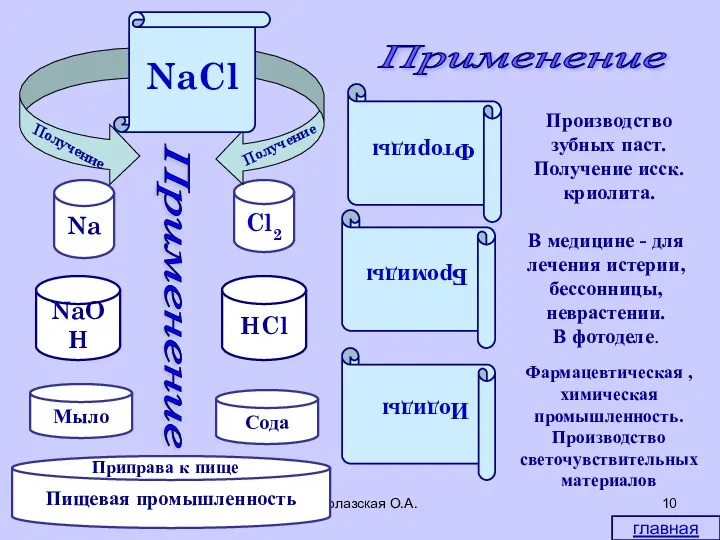
- 10. * Водолазская О.А. Применение главная
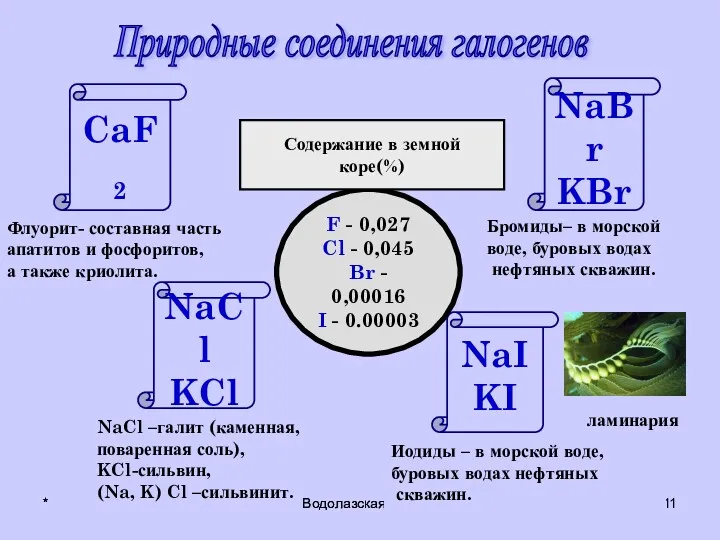
- 11. * Водолазская О.А. * Водолазская О.А. Природные соединения галогенов главная NaCl KCl CaF2 NaBr KBr NaI
- 12. * Водолазская О.А. * Водолазская О.А. Домашнее задание: Составить уравнения реакций, подтверждающие химические свойства соляной кислоты.
- 14. Скачать презентацию






 Ртуть и цинк
Ртуть и цинк Драгоценные камни
Драгоценные камни Соли, их классификация и свойства
Соли, их классификация и свойства Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях Теория электролитической диссоциации
Теория электролитической диссоциации Химия и биологическая роль элементов VIIА-группы
Химия и биологическая роль элементов VIIА-группы Студенттің өзіндік жұмысы
Студенттің өзіндік жұмысы Составление уравнений химических реакций. Закон сохранения массы веществ
Составление уравнений химических реакций. Закон сохранения массы веществ Водород
Водород Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Алкени (етиленові вуглеводні, олефіни)
Алкени (етиленові вуглеводні, олефіни) Коррозия металлов
Коррозия металлов Строение, свойства и применение алкенов
Строение, свойства и применение алкенов Дистилляция в химической промышленности
Дистилляция в химической промышленности Хлорид натрия (NaCI)
Хлорид натрия (NaCI) Кислород. Озон. Получение кислорода
Кислород. Озон. Получение кислорода Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар
Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар 20230802_stroenie_atoma_avtosohranennyy_2
20230802_stroenie_atoma_avtosohranennyy_2 Хімічні властивості алкенів
Хімічні властивості алкенів Биоразлагаемые ПАВ. Лекция 2
Биоразлагаемые ПАВ. Лекция 2 Принципы наноармирования волокнистых композитов
Принципы наноармирования волокнистых композитов Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Альдегиды и кетоны
Альдегиды и кетоны Искусственная и синтетическая резина
Искусственная и синтетическая резина Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Задачи на избыток-недостаток
Задачи на избыток-недостаток Синтетический каучук и его применение
Синтетический каучук и его применение