Содержание
- 2. Фарадей Майкл 22. IX.1791 – 25.VIII. 1867 Английский физик и химик. В первой половине 19 в.
- 3. Теория электролитической диссоциации (ТЭД) В 1887 году шведский учёный С. Аррениус для объяснения особенностей водных растворов
- 4. 1 положение Все вещества по их способности проводить электрический ток в растворах делятся на электролиты и
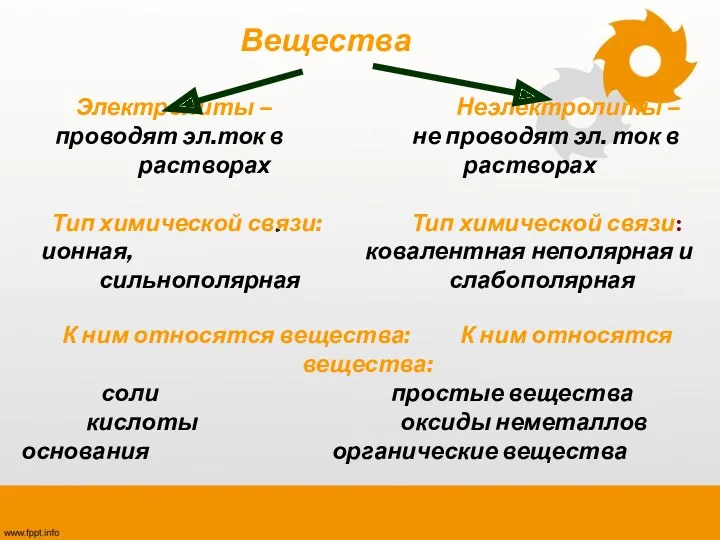
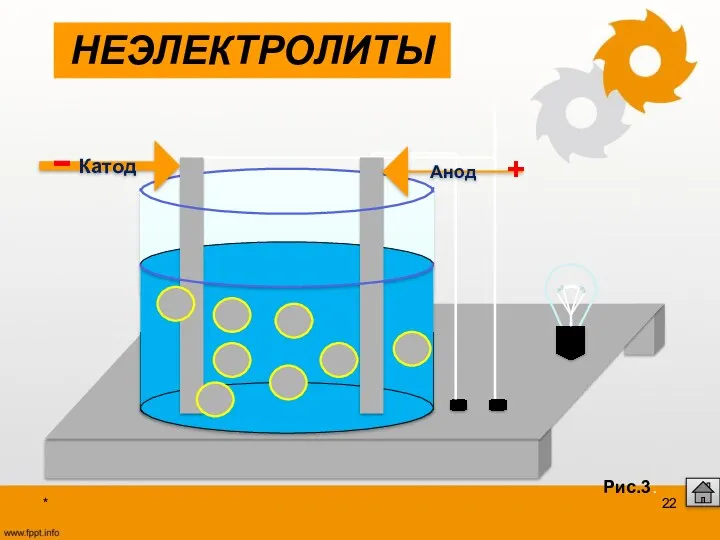
- 5. Вещества Электролиты – Неэлектролиты – проводят эл.ток в не проводят эл. ток в растворах растворах Тип
- 6. Процесс распада электролита в на ионы называется электролитической диссоциацией. СЛОВАРЬ
- 7. 2 положение При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы Ионы –
- 8. ИОНЫ - это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
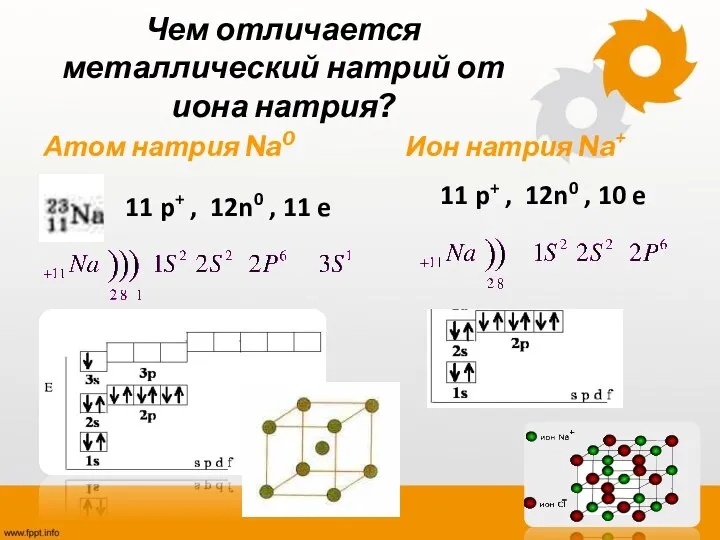
- 9. Чем отличается металлический натрий от иона натрия? Атом натрия Na0 Ион натрия Na+ 11 p+ ,
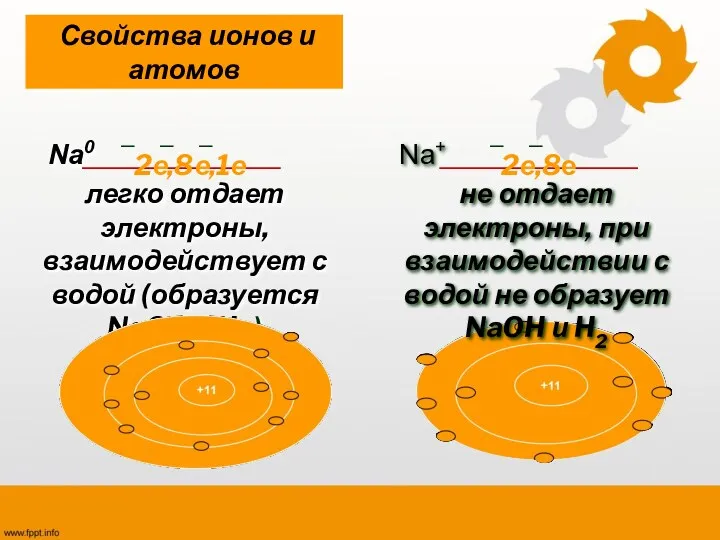
- 10. Na0 легко отдает электроны, взаимодействует с водой (образуется NaOH и H2 ) Свойства ионов и атомов
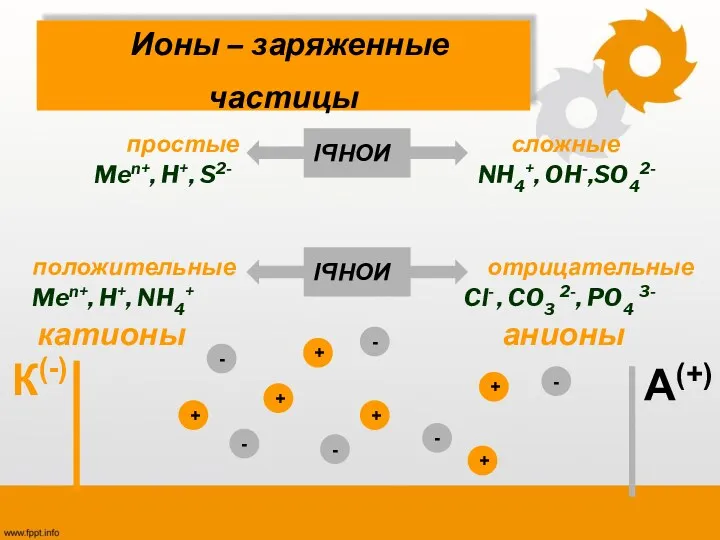
- 11. Ионы – заряженные частицы простые сложные Men+, H+, S2- NH4+, OH-,SO42- положительные отрицательные Men+, H+, NH4+
- 12. 3 положение Причиной диссоциации электролита является его взаимодействие с молекулами воды и разрыв химической связи в
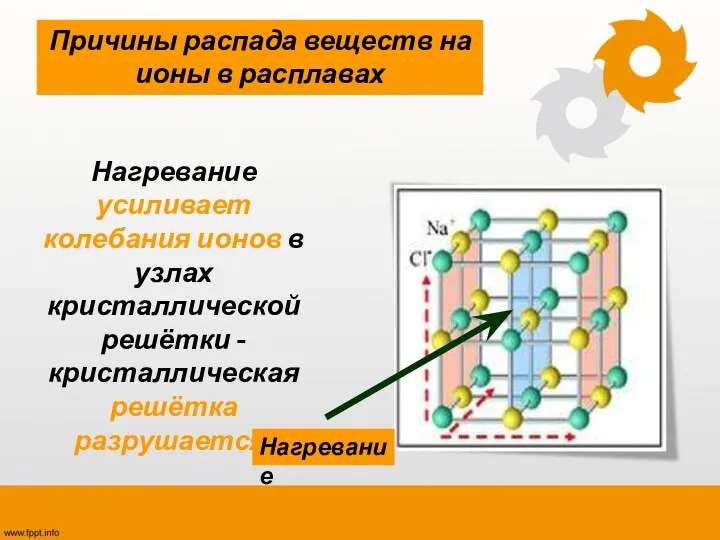
- 13. Нагревание усиливает колебания ионов в узлах кристаллической решётки -кристаллическая решётка разрушается. Причины распада веществ на ионы
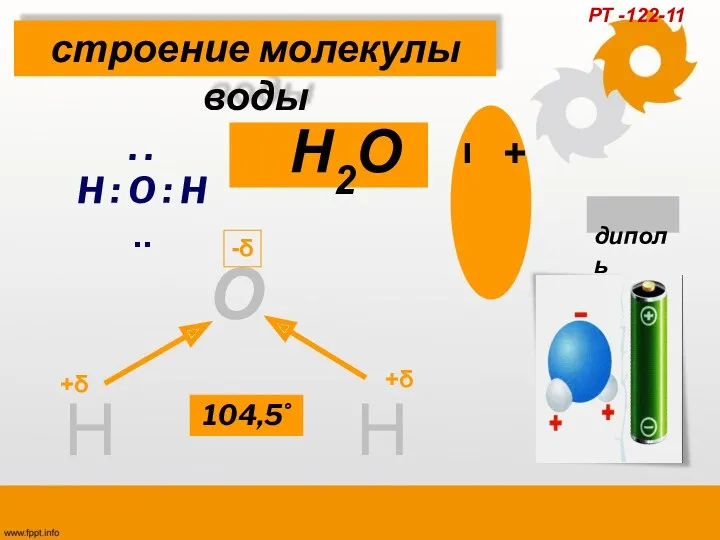
- 14. Н Н О 104,5˚ строение молекулы воды . . H : O : H .. диполь
- 15. 1. Вода является полярной молекулой 2. Вода ослабляет взаимодействие между ионами в 81 раз. 3.диполи воды
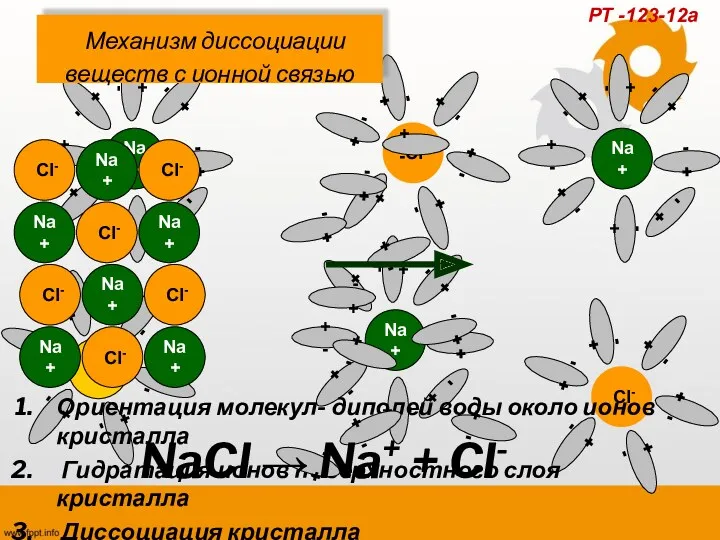
- 16. Механизм электролитической диссоциации веществ с ионным типом связи ориентация молекул – диполей воды около ионов кристалла
- 17. Механизм диссоциации веществ с ионной связью Ориентация молекул- диполей воды около ионов кристалла Гидратация ионов поверхностного
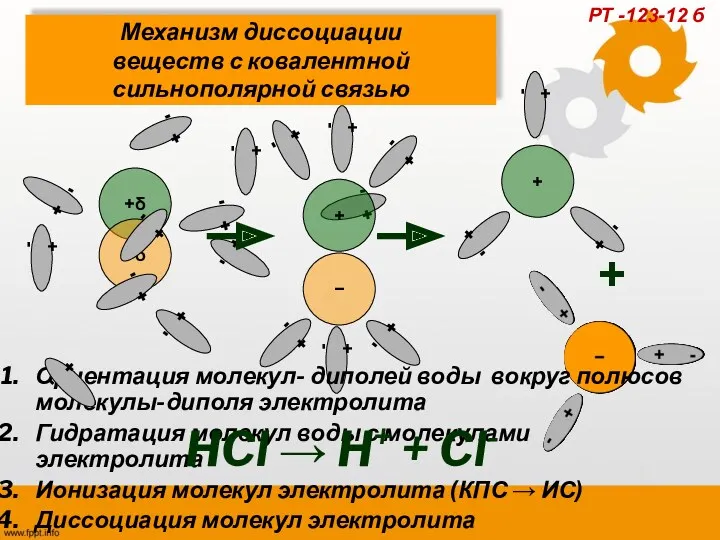
- 18. Сущность процесса электролитической диссоциации веществ с ковалентной полярной связью ориентация молекул воды вокруг полюсов молекулы электролита
- 19. + - + - + - + - Механизм диссоциации веществ с ковалентной сильнополярной связью Ориентация
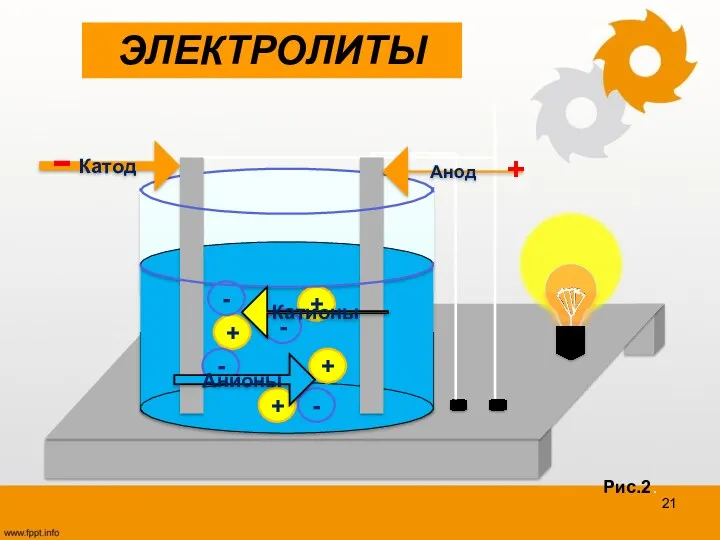
- 20. 4 положение Под действием электрического тока положительные ионы движутся к катоду и называются катионами, а отрицательные
- 21. + + + + - - - - Анионы Катионы Анод Катод - + ЭЛЕКТРОЛИТЫ Рис.2.
- 22. Анод Катод - + * Рис.3. НЕЭЛЕКТРОЛИТЫ
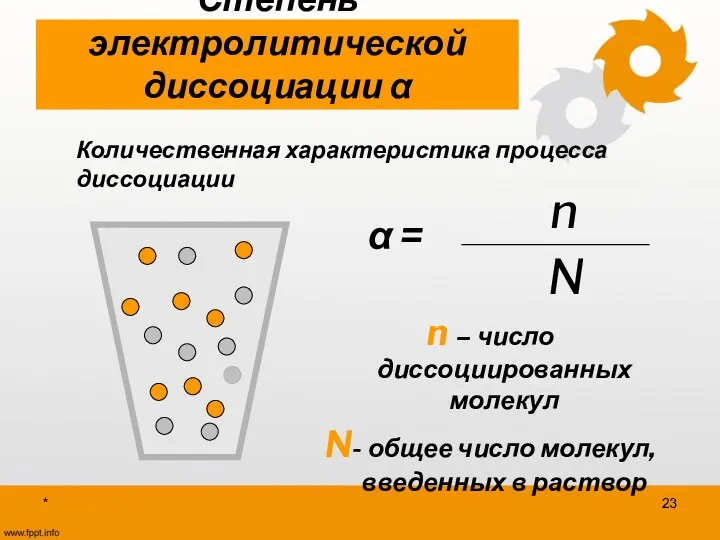
- 23. * Степень электролитической диссоциации α Количественная характеристика процесса диссоциации n – число диссоциированных молекул N- общее
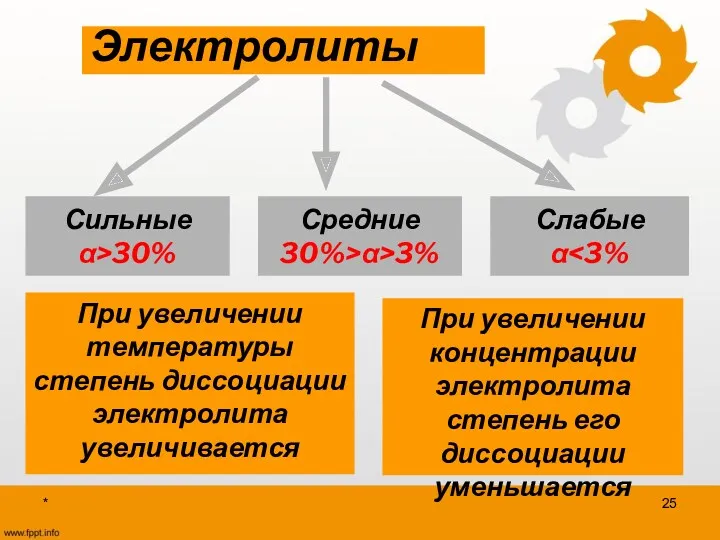
- 24. 5 положение Разные электролиты по-разному диссоциируют на ионы и поэтому делятся на: А) сильные (соли, щелочи,
- 25. * Электролиты Сильные α>30% Средние 30%>α>3% Слабые α При увеличении температуры степень диссоциации электролита увеличивается При
- 26. 6 положение Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации
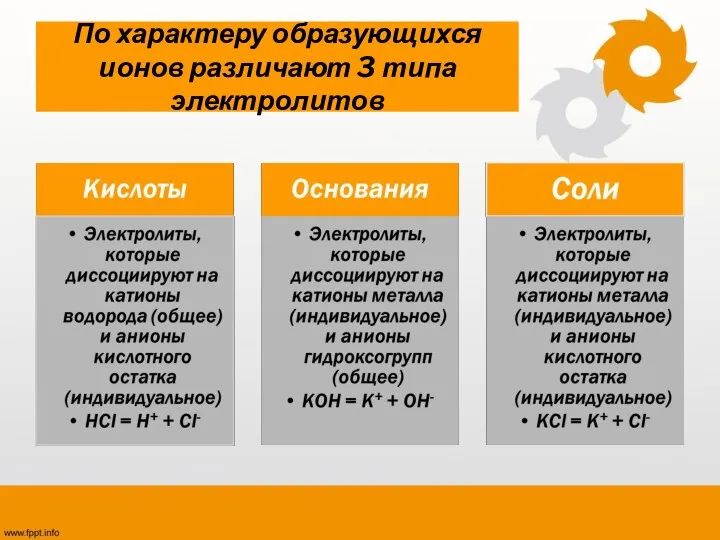
- 27. По характеру образующихся ионов различают 3 типа электролитов
- 28. Многоосновные кислоты диссоциируют ступенчато Н3РО4 Н+ + Н2РО42-(первая ступень) дигидрофосфат-ион Н2РО42- Н+ + НРО42- (вторая ступень)
- 29. Многокислотные основания диссоциируют ступенчато Ca(ОН)2 Са(ОН)+ + OH- (первая ступень) Ca(OH)+ Ca2+ + OH- (вторая ступень)
- 31. Скачать презентацию















 Углерод. Элемент IV группы
Углерод. Элемент IV группы Электронный помощник по химии 8 класс
Электронный помощник по химии 8 класс Химия переходных элементов IV – V группы
Химия переходных элементов IV – V группы Общая характеристика неметаллов
Общая характеристика неметаллов Ископаемые углеводороды
Ископаемые углеводороды Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Гидролиз солей
Гидролиз солей Неорганическая химия
Неорганическая химия Химический анализ веществ
Химический анализ веществ Альдегиды и кетоны
Альдегиды и кетоны Углеводы. 10 класс
Углеводы. 10 класс Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Состав, строение и свойства натурального каучука
Состав, строение и свойства натурального каучука Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары
Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Кислые породы умеренно-щелочного ряда
Кислые породы умеренно-щелочного ряда Классификация химических реакций
Классификация химических реакций Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Первые шаги в минералогию: от новичка до знатока
Первые шаги в минералогию: от новичка до знатока Инертные газы
Инертные газы Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги
Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги Диссоциация кислот, оснований, солей
Диссоциация кислот, оснований, солей 20231110_zakon_avogadro
20231110_zakon_avogadro Спирттер мен фенолдар
Спирттер мен фенолдар Аминокислоты и белки
Аминокислоты и белки Карбон
Карбон Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем
Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем Азотная кислота
Азотная кислота