Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды презентация
Содержание
- 2. Цели: Сформировать понятие об амфотерности. Повторить и развить знания о классификации и свойствах гидроксидов. Научить ребят
- 3. Задачи: Образовательные Актуализировать и обобщить ранее полученные учащимися знания об основных классах неорганических соединений. Закрепить умения
- 4. Какие элементы периодической системы образуют амфотерные соединения?
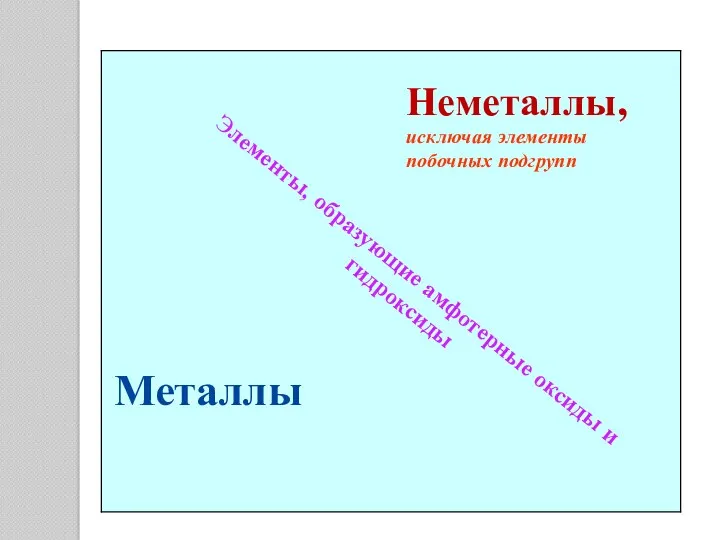
- 5. Металлы Неметаллы, исключая элементы побочных подгрупп Элементы, образующие амфотерные оксиды и гидроксиды
- 6. АМФОТЕРНОСТЬ (от греческого amphoteros-и тот и другой), способность химических соединений проявлять кислотные или основные свойства в
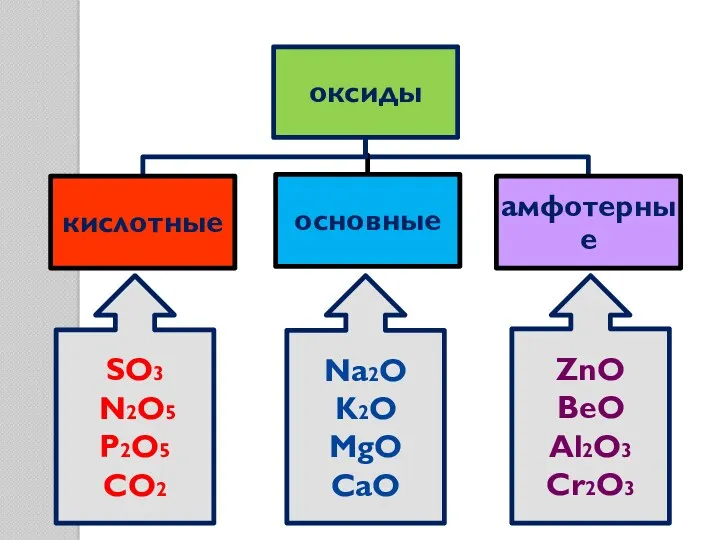
- 7. SO3 N2O5 P2O5 CO2 Na2O K2O MgO CaO ZnO BeO Al2O3 Cr2O3
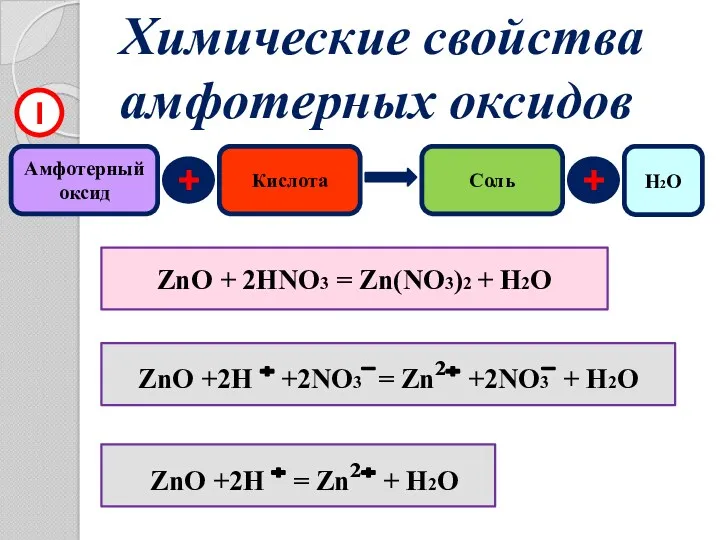
- 8. Химические свойства амфотерных оксидов Амфотерный оксид + Кислота Соль 1 ZnO + 2HNO3 = Zn(NO3)2 +
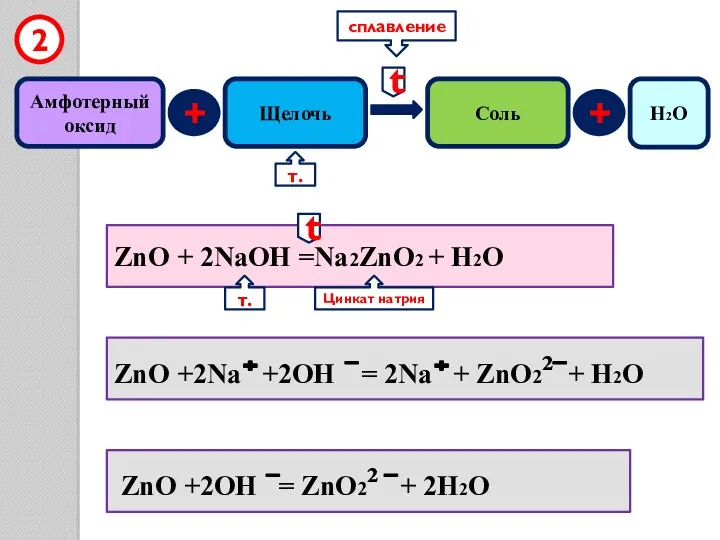
- 9. Амфотерный оксид + Щелочь Соль 2 ZnO + 2NaOH =Na2ZnO2 + H2O ZnO +2Na +2OH =
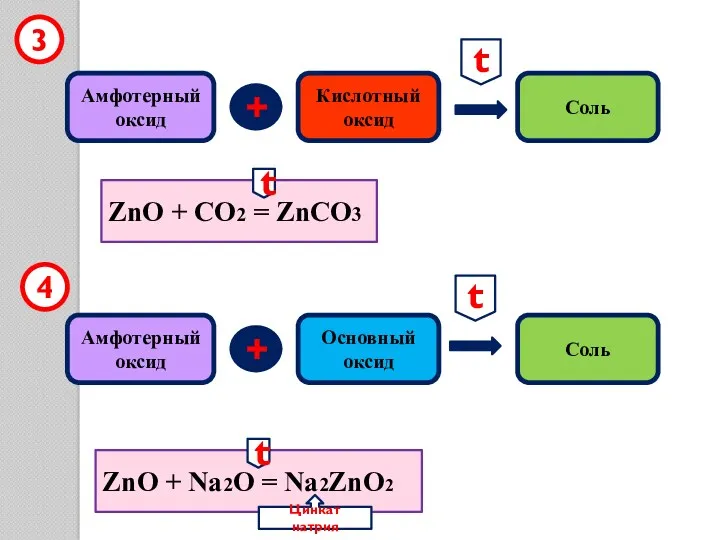
- 10. Амфотерный оксид + Кислотный оксид Соль 3 ZnO + CO2 = ZnCO3 ZnO + Na2O =
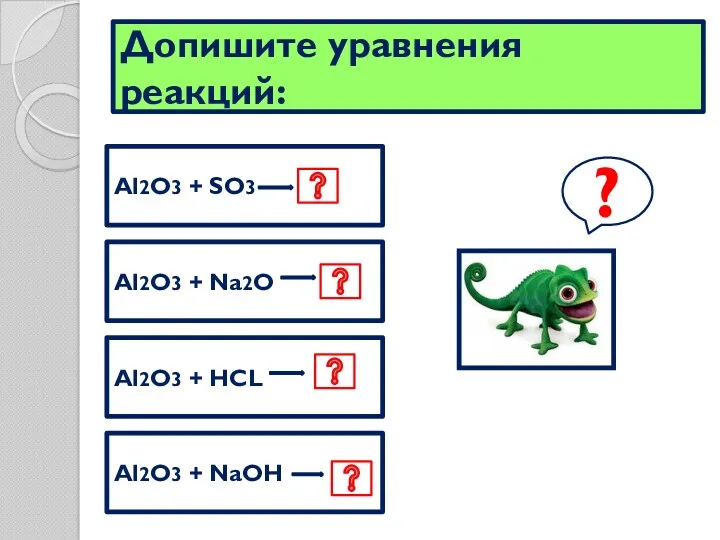
- 11. Допишите уравнения реакций: Al2O3 + SO3 Al2O3 + Na2O Al2O3 + HCL Al2O3 + NaOH ?
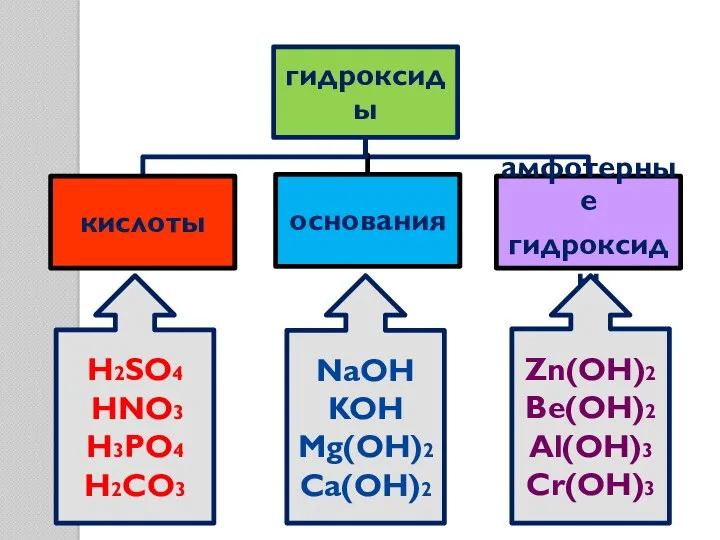
- 12. H2SO4 HNO3 H3PO4 H2CO3 NaOH KOH Mg(OH)2 Ca(OH)2 Zn(OH)2 Be(OH)2 Al(OH)3 Cr(OH)3
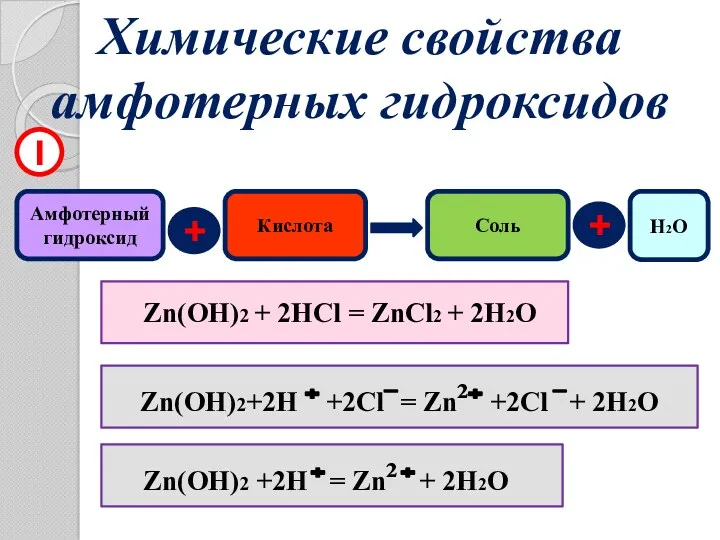
- 13. Химические свойства амфотерных гидроксидов Амфотерный гидроксид + Кислота Соль 1 Zn(OH)2 + 2HCl = ZnCl2 +
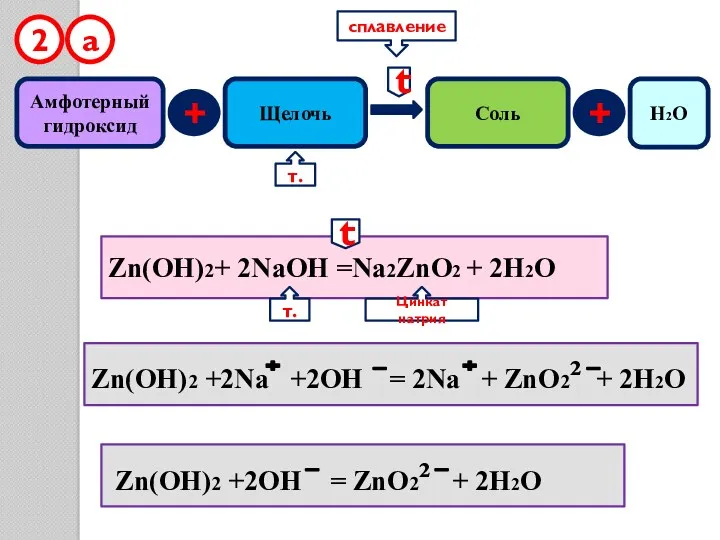
- 14. Амфотерный гидроксид + Щелочь Соль 2 Zn(OH)2+ 2NaOH =Na2ZnO2 + 2H2O Zn(OH)2 +2Na +2OH = 2Na
- 15. Амфотерный гидроксид + Щелочь Соль 2 Zn(O H)2+ 2NaOH =Na2[Zn(OH)4] Zn(OH)2 +2Na +2OH = 2Na +[Zn(OH)4]²
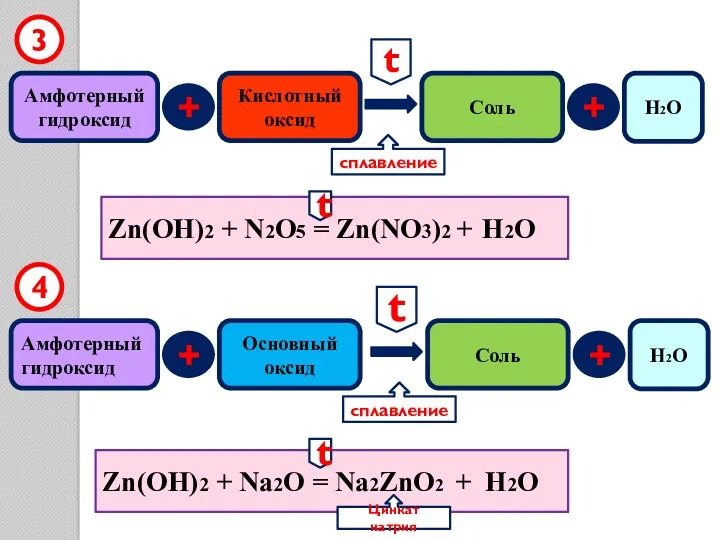
- 16. Амфотерный гидроксид + Кислотный оксид Соль Zn(OH)2 + N2O5 = Zn(NO3)2 + H2O Zn(OH)2 + Na2O
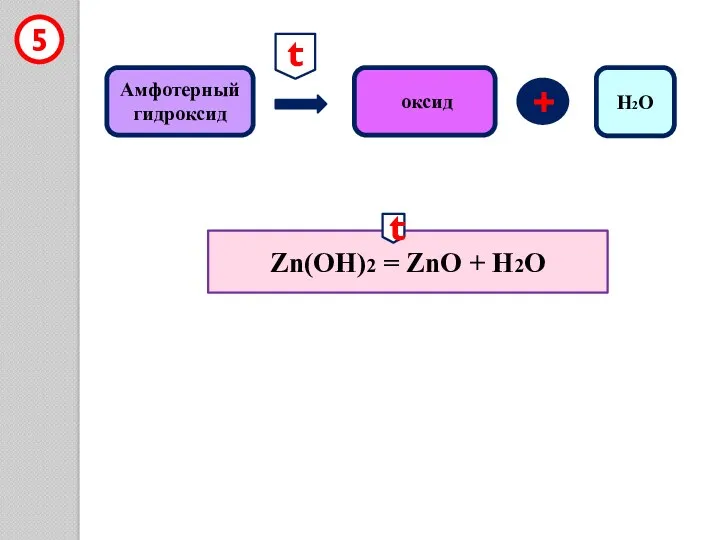
- 17. Амфотерный гидроксид + оксид 5 Zn(OH)2 = ZnO + H2O t t H2O
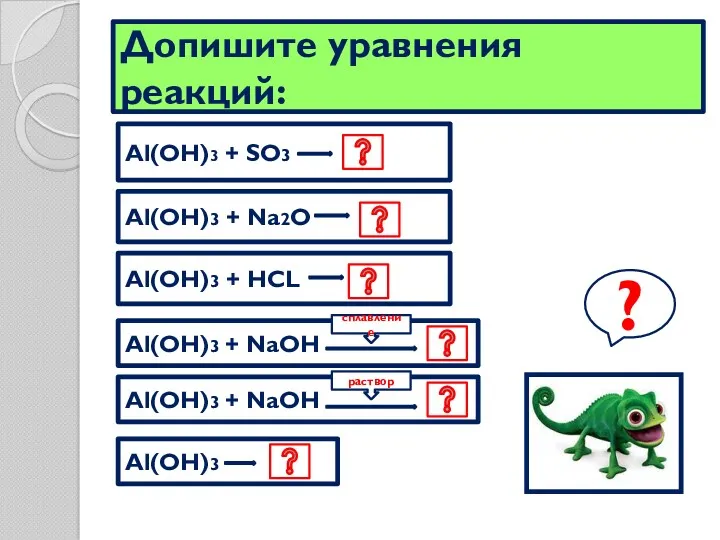
- 18. Допишите уравнения реакций: Al(OH)3 + SO3 Al(OH)3 + Na2O Al(OH)3 + HCL Al(OH)3 + NaOH ?
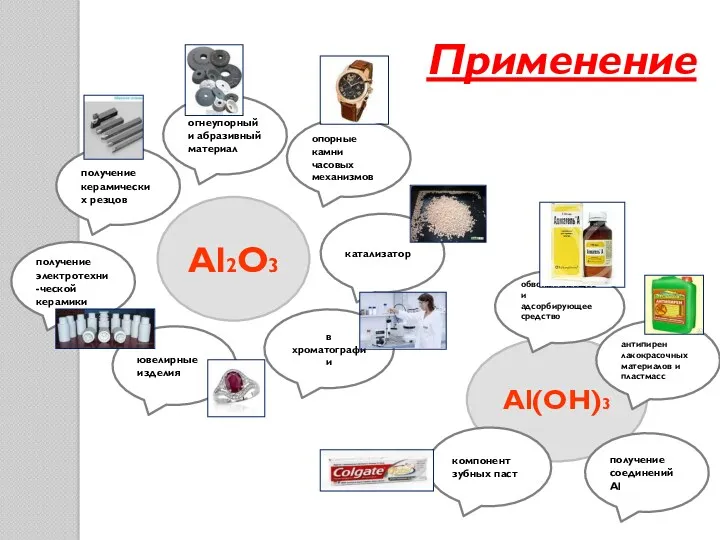
- 19. Применение Al2O3 Al(OH)3 антипирен лакокрасочных материалов и пластмасс компонент зубных паст получение соединений Аl обволакивающее и
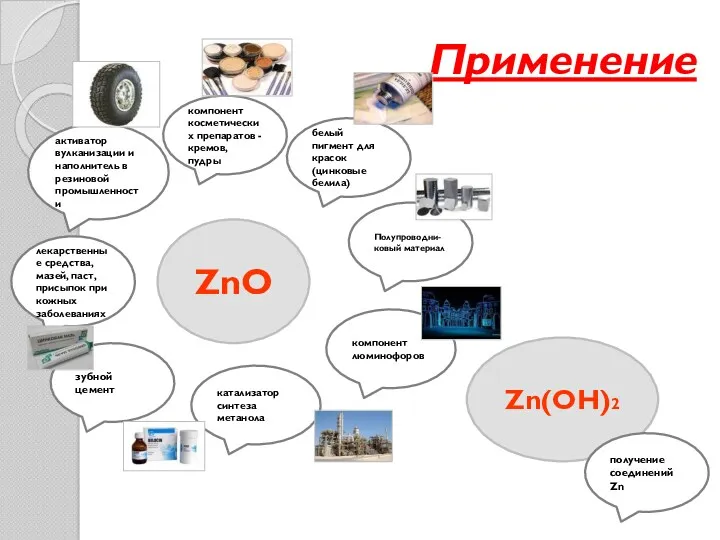
- 20. Применение ZnO Zn(OH)2 получение соединений Zn белый пигмент для красок (цинковые белила) компонент косметических препаратов -
- 21. Занимательный опыт!!!
- 22. Лабораторная работа «Получение гидроксида цинка и изучение его свойств»
- 23. Алгоритм выполнения работы
- 25. Скачать презентацию




![Амфотерный гидроксид + Щелочь Соль 2 Zn(O H)2+ 2NaOH =Na2[Zn(OH)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/604711/slide-14.jpg)


 Простые вещества металлы
Простые вещества металлы Биотыңайтқыштар
Биотыңайтқыштар Цинк
Цинк Тканые армирующие наполнители
Тканые армирующие наполнители Углеводы. Урок по химии для 9 класса
Углеводы. Урок по химии для 9 класса Оксиди нітрогену
Оксиди нітрогену Классы неорганических веществ (лекция № 4/5)
Классы неорганических веществ (лекция № 4/5) Роль хімії у розв`язанні екологічної проблеми
Роль хімії у розв`язанні екологічної проблеми Молекулярна маса речовини
Молекулярна маса речовини Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Запалювання нагрітим тілом та електричним розрядом
Запалювання нагрітим тілом та електричним розрядом Интересные факты о химических веществах
Интересные факты о химических веществах Аналитическая химия. Предмет и задачи
Аналитическая химия. Предмет и задачи General, specific properties are common to all matters
General, specific properties are common to all matters Биологически важные 5-ти и 6-ти членные гетероциклические соединения. (Лекция 25)
Биологически важные 5-ти и 6-ти членные гетероциклические соединения. (Лекция 25) Фосфор и его соединения. Урок по химии для 9 класса
Фосфор и его соединения. Урок по химии для 9 класса Химические реакторы
Химические реакторы Физические методы стабилизации масел
Физические методы стабилизации масел Экспериментальным исследованием установить тип данной химической реакции
Экспериментальным исследованием установить тип данной химической реакции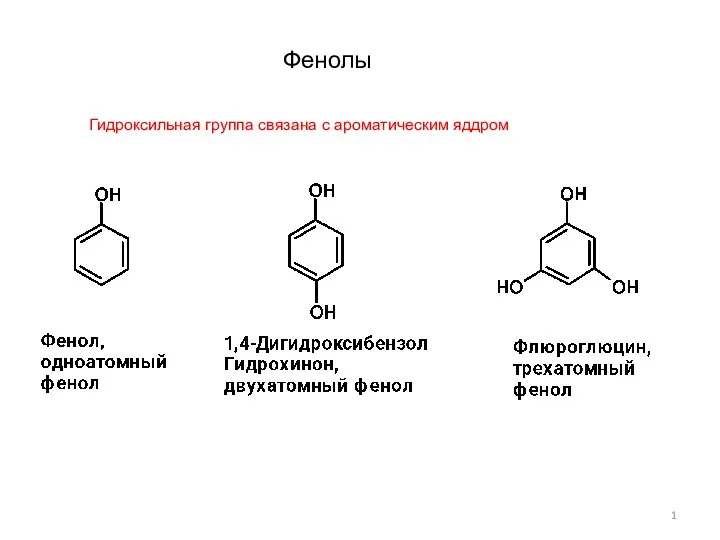 Фенолы-1
Фенолы-1 Химический факультет
Химический факультет Непредельные углеводороды. Алкины
Непредельные углеводороды. Алкины Катиониты. Классификация катионитов
Катиониты. Классификация катионитов Азотная кислота
Азотная кислота Классификация химических реакций
Классификация химических реакций Озон. Применение
Озон. Применение Дисперсные системы
Дисперсные системы