Содержание
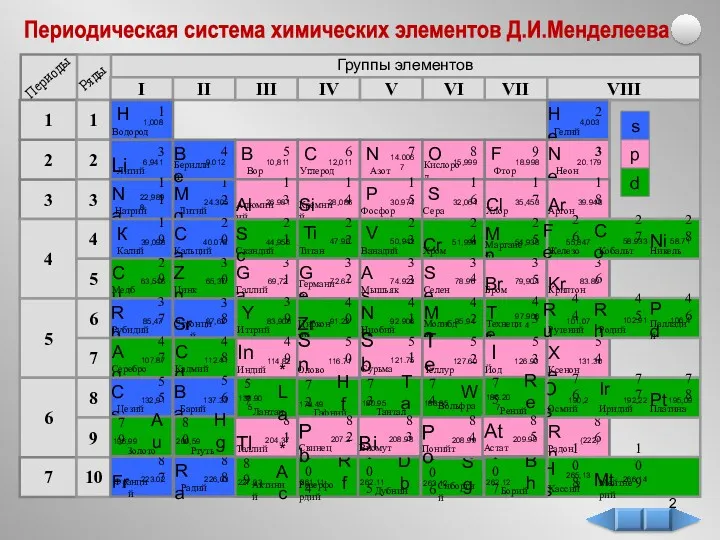
- 2. Периодическая система химических элементов Д.И.Менделеева Группы элементов
- 3. Периодическая система химических элементов Д.И.Менделеева Характеристика
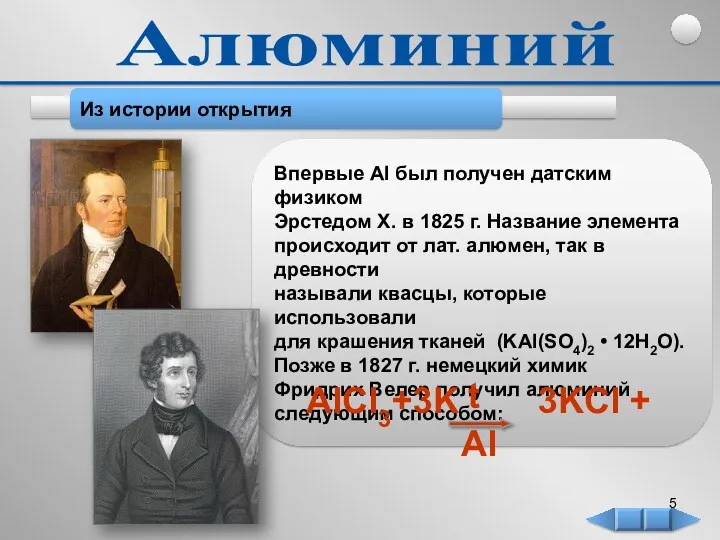
- 4. Алюминий
- 5. Из истории открытия Впервые Al был получен датским физиком Эрстедом Х. в 1825 г. Название элемента
- 6. В период открытия алюминия - металл был дороже золота. Англичане хотели почтить богатым подарком великого русского
- 7. Алюминий - элемент III группы, главной подгруппы. Заряд ядра атома алюминия равен +13. В ядре атома
- 8. Электронное строение 27 Аl +13 0 2e 8e 3e 1s2 2s2 2p6 3s2 3p1 Краткая электронная
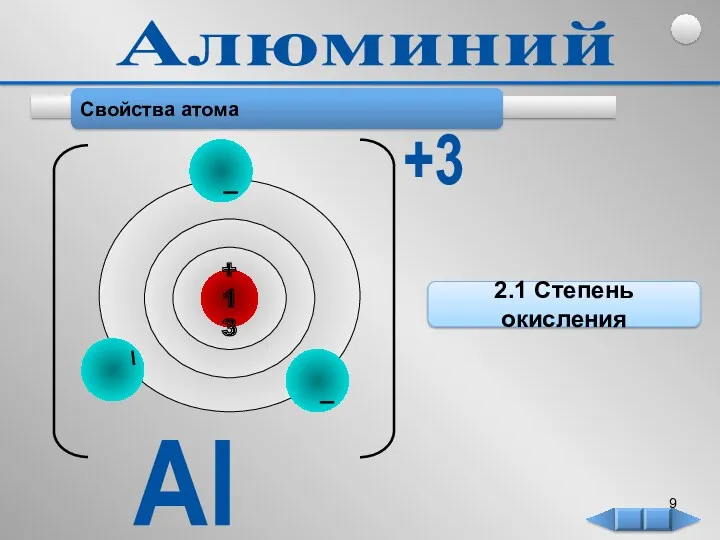
- 9. Свойства атома 2.1 Степень окисления Al +3 Алюминий
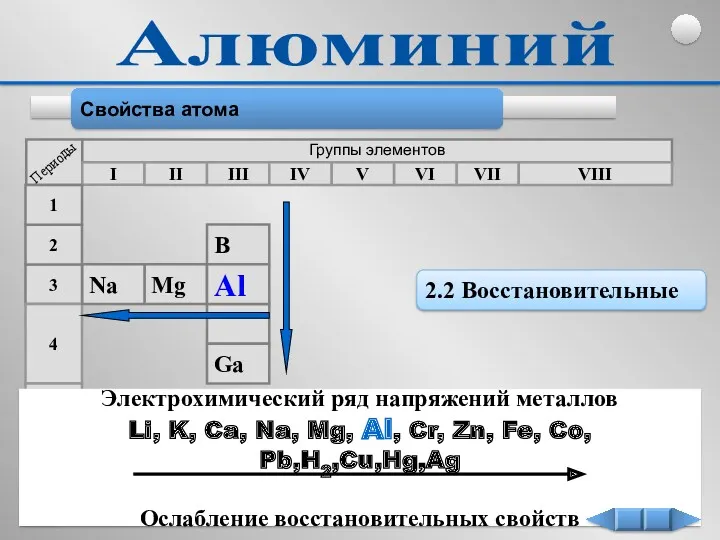
- 10. Свойства атома 2.2 Восстановительные Электрохимический ряд напряжений металлов Li, K, Ca, Na, Mg, Al, Cr, Zn,
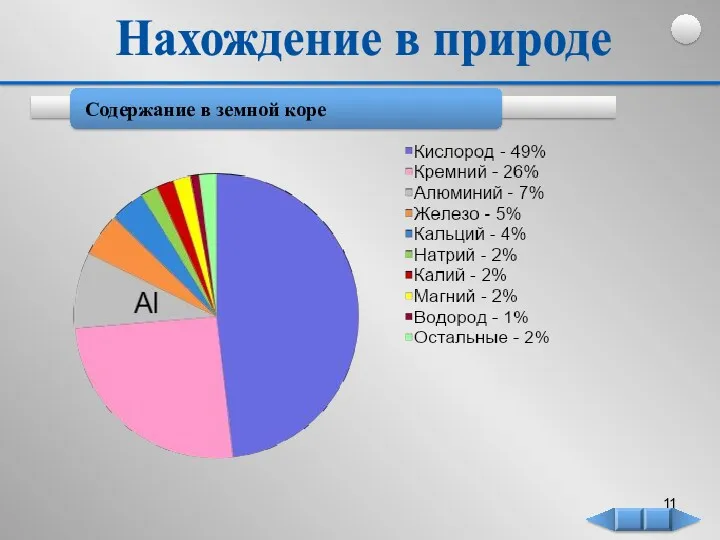
- 11. Содержание в земной коре Нахождение в природе
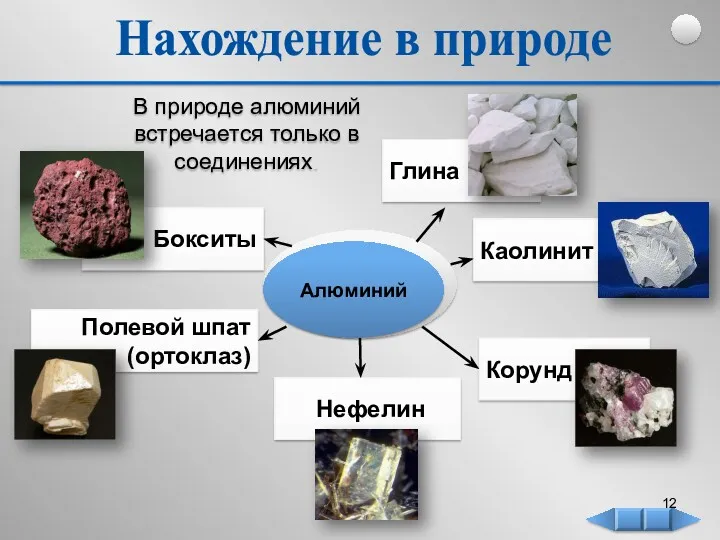
- 12. Нахождение в природе В природе алюминий встречается только в соединениях.
- 13. Бокситы Бокситы (от названия местности Ле-Бо, Lex Baux, на юге Франции, где впервые обнаружены их залежи)
- 14. Глина Известно более 250 минералов, в состав которых входит алюминий, большинство из них алюмосиликаты, из которых
- 15. Каолинит Каолинит Al2O3•2SiO2•2H2O – минерал подкласса слоистых силикатов, главная составная часть белой, огнеупорной и фарфоровой глины.
- 16. Корунд Изредка встречается твердый (уступает лишь алмазу) минерал корунд – кристаллический оксид Al2O3 , часто окрашенный
- 17. Нефелин Na2O • Al2O3 • 2SiO2 Минералы – серые, красноватые и другие кристаллы с характерным жирным
- 18. Полевой шпат (ортоклаз) К2O • Al2O3 • 6SiO2 Калиевый полевой шпат. Белый, серый, розовый и т.д.
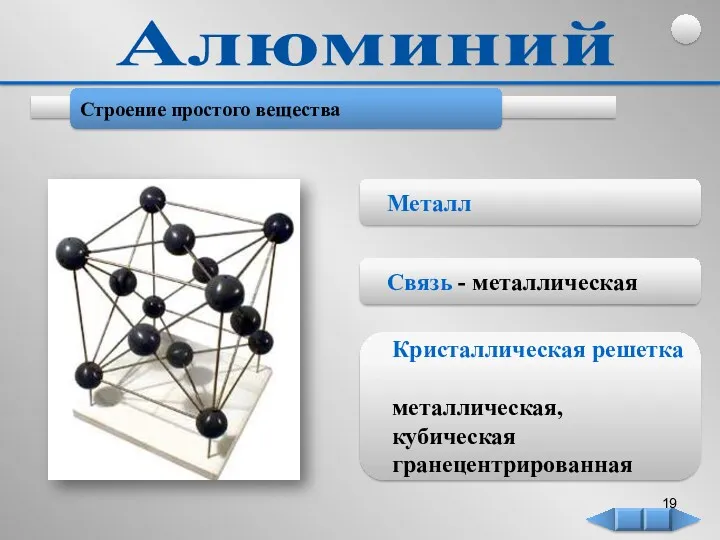
- 19. Строение простого вещества Металл Связь - металлическая Кристаллическая решетка - металлическая, кубическая гранецентрированная Алюминий
- 20. Физические свойства Цвет – серебристо-белый t пл. = 660°C t кип. ≈ 2450°C электропроводный, теплопроводный легкий,
- 21. Алюминий В обычных условиях поверхность алюминия покрыта очень тонкой (10-5мм), но очень прочной оксидной пленкой, которая
- 22. Взаимодействие с неметаллами Химические свойства 4Аl +3O2→2Al2O3 Аl + O2 → Из неметаллов алюминий легче всего
- 23. Взаимодействие с неметаллами Химические свойства C галогенами бромом и йодом реагирует в присутствии небольшого количества воды
- 24. Взаимодействие с водой Химические свойства В особых условиях алюминий (очищенный от оксидной пленки в инертной атмосфере)
- 25. Взаимодействие с кислотами Химические свойства Алюминий достаточно легко реагирует с кислотами. Al + HCl → Al+H2SO4→
- 26. 2Al + Fe2(SO4)3 → Al2(SO4)3 + 2Fe 2Al + 3CuCl2 → 3Cu + 2AlCl3 Взаимодействие с
- 27. Взаимодействие с оксидами металлов Химические свойства Алюминий – сильный восстановитель. Его применяют для получения из оксидов
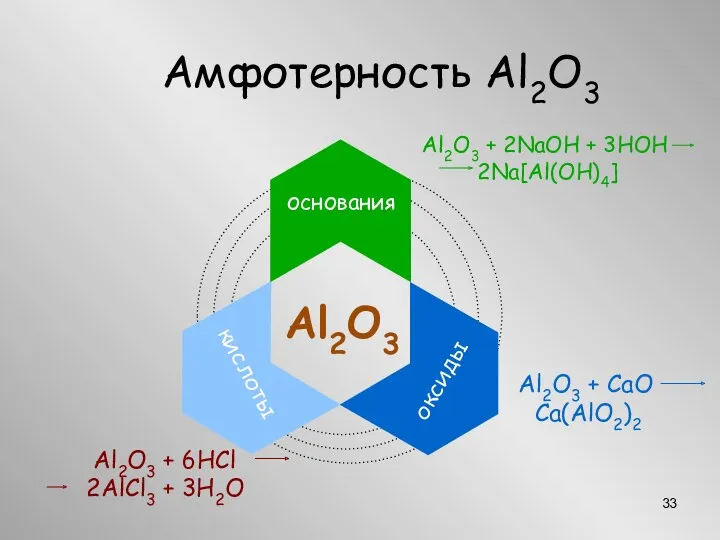
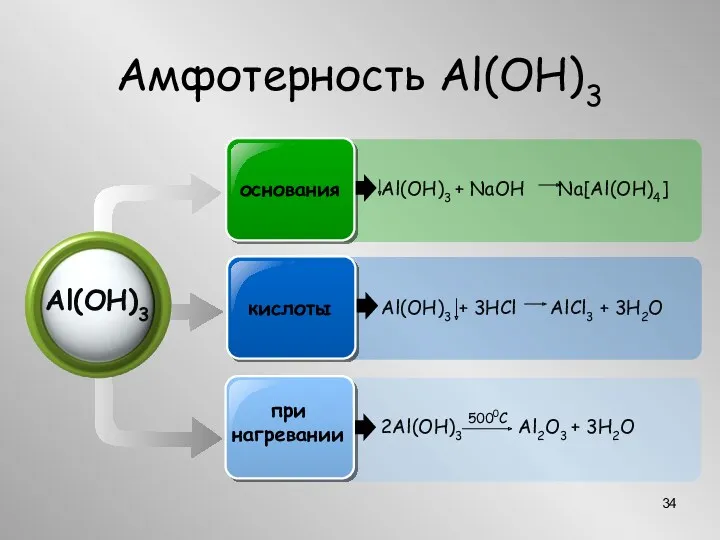
- 28. Амфотерность В расплаве щелочи 2Al + 2NaOH + 6HOН 2Na[Al(OН)4] + 3H2 В расплаве 2Al +
- 29. Взаимодействие со щелочами Химические свойства Алюминий активно взаимодействует со щелочами. Защитная пленка амфотерного оксида Al2O3 неустойчива
- 30. Получение алюминия При промышленном производстве бокситы сначала подвергают химической переработке, удаляя из них примеси оксидов кремния,
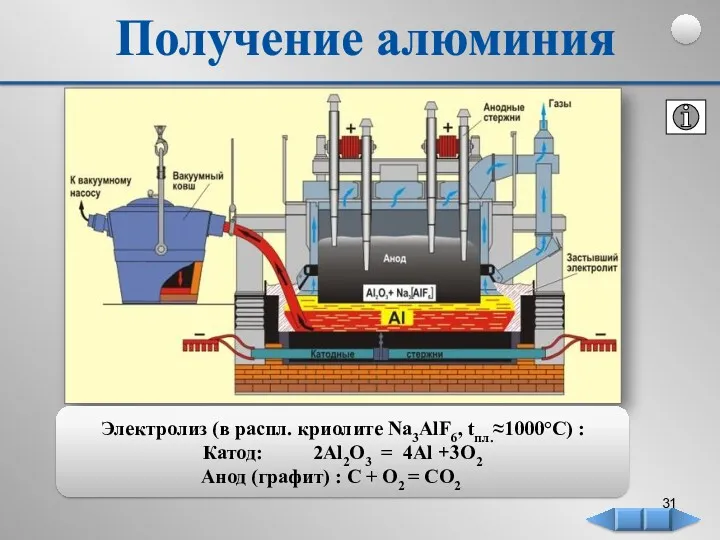
- 31. Получение алюминия Электролиз (в распл. криолите Na3AlF6, tпл.≈1000°С) : Катод: 2Al2O3 = 4Al +3O2 Анод (графит)
- 32. Применение алюминия
- 33. Амфотерность Al2O3 Al2O3 оксиды кислоты основания Al2O3 + CaO Ca(AlO2)2
- 34. Al(OH)3 основания кислоты при нагревании 2Al(OH)3 Al2O3 + 3H2O 5000C Амфотерность Al(OH)3
- 36. Скачать презентацию



















![Амфотерность В расплаве щелочи 2Al + 2NaOH + 6HOН 2Na[Al(OН)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/287181/slide-27.jpg)



 Сравнительная характеристика галогенов
Сравнительная характеристика галогенов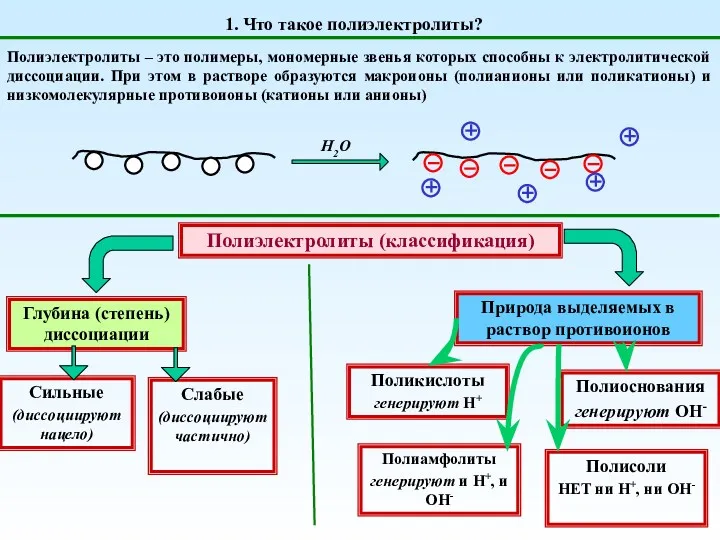 Полиэлектролиты. (Тема 3)
Полиэлектролиты. (Тема 3) Көмірсутектерді пиролиздеу арқылы қарапайым олефиндер алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндер алу Материаловедение. Физические и химические структуры материалов
Материаловедение. Физические и химические структуры материалов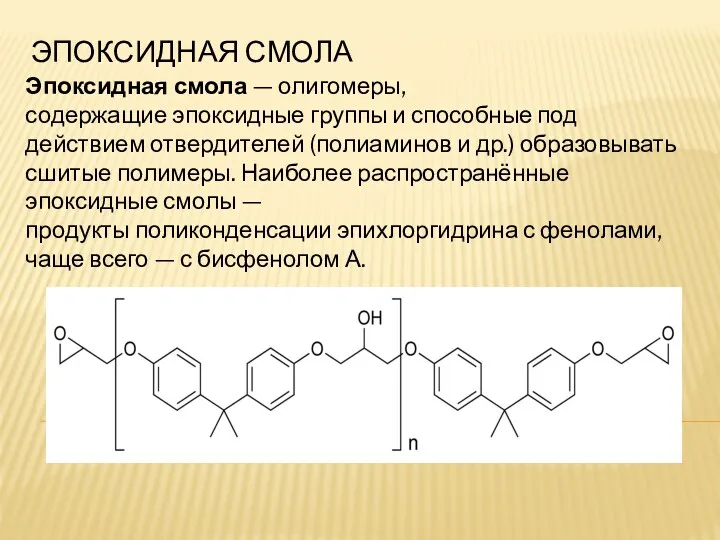 Эпоксидная смола
Эпоксидная смола Алканы. Предельные углеводороды. Насыщенные углеводороды. Парафины
Алканы. Предельные углеводороды. Насыщенные углеводороды. Парафины Щёлочноземельные металлы
Щёлочноземельные металлы Спирты. Определение. Классификация
Спирты. Определение. Классификация Кислотно-основное титрование
Кислотно-основное титрование Химический элемент и вещество
Химический элемент и вещество Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні
Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні Нуклеиновые кислоты, их структурные компоненты
Нуклеиновые кислоты, их структурные компоненты Презентации-задания к урокам химии по различным темам
Презентации-задания к урокам химии по различным темам Фосфор и его соединения
Фосфор и его соединения Алюминий на кухне - опасный враг или верный помощник?
Алюминий на кухне - опасный враг или верный помощник?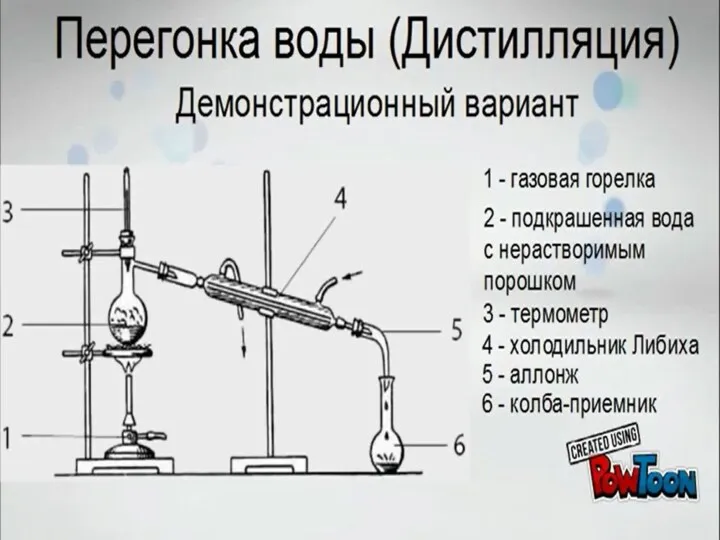 Перегонка воды (дистилляция). Демонстрационный вариант
Перегонка воды (дистилляция). Демонстрационный вариант Нано-порошки. Способы получения нано-порошков
Нано-порошки. Способы получения нано-порошков Атом - сложная частица
Атом - сложная частица Горные породы
Горные породы Алкины. Ацетилен.
Алкины. Ацетилен. Спектрофометрия
Спектрофометрия Воздух, которым мы дышим
Воздух, которым мы дышим Получение галогенов. Биологическое значение и применение галогенов
Получение галогенов. Биологическое значение и применение галогенов Фізичні властивості та хімічний склад природних вод
Фізичні властивості та хімічний склад природних вод Щелочные металлы
Щелочные металлы Качественные реакции
Качественные реакции Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ