Содержание
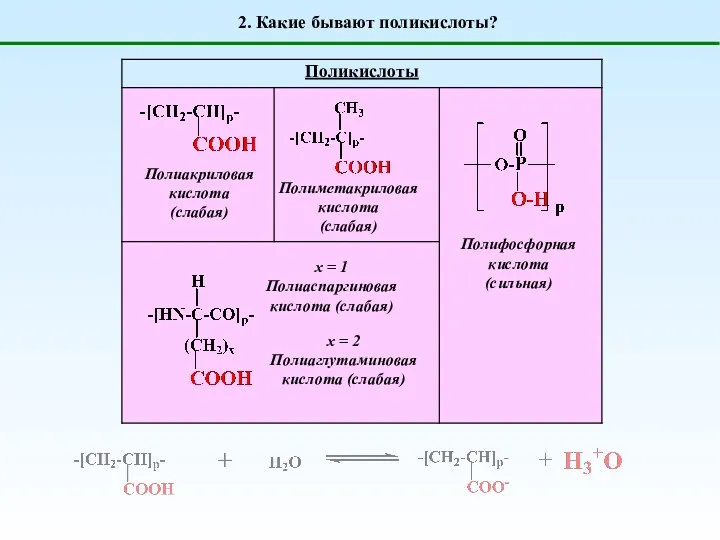
- 2. 2. Какие бывают поликислоты? Полиакриловая кислота (слабая) Полиметакриловая кислота (слабая) Полифосфорная кислота (сильная) х = 1
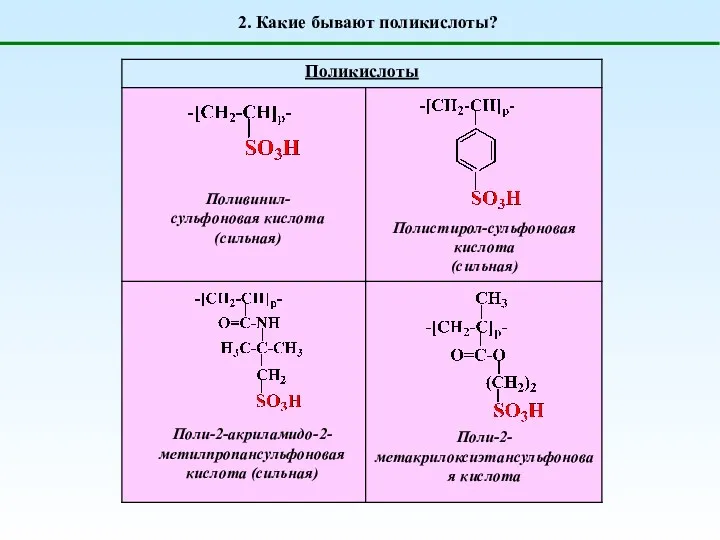
- 3. 2. Какие бывают поликислоты? Поливинил-сульфоновая кислота (сильная) Полистирол-сульфоновая кислота (сильная) Поли-2-акриламидо-2-метилпропансульфоновая кислота (сильная) Поли-2-метакрилоксиэтансульфоновая кислота
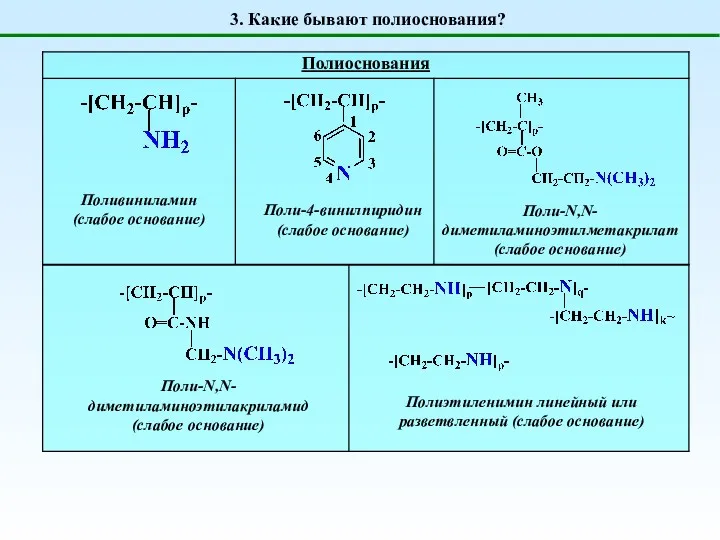
- 4. 3. Какие бывают полиоснования? Поливиниламин (слабое основание) Поли-4-винилпиридин (слабое основание) Поли-N,N-диметиламиноэтилметакрилат (слабое основание) Поли-N,N-диметиламиноэтилакриламид (слабое основание)
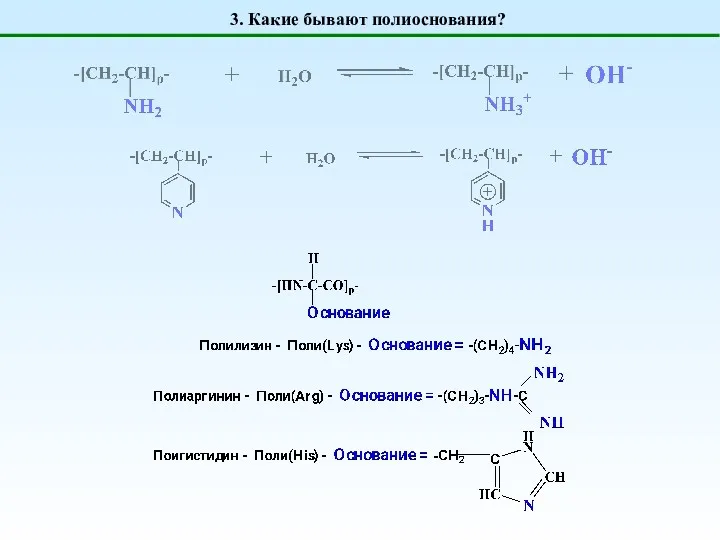
- 5. 3. Какие бывают полиоснования?
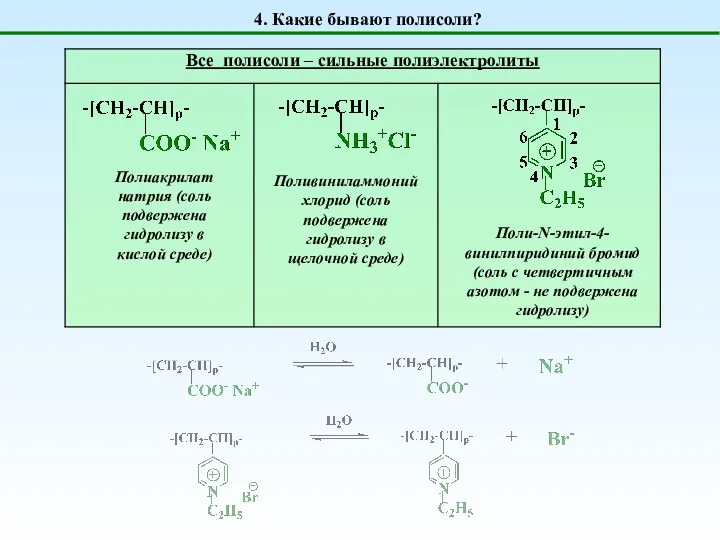
- 6. 4. Какие бывают полисоли? Полиакрилат натрия (соль подвержена гидролизу в кислой среде) Поливиниламмоний хлорид (соль подвержена
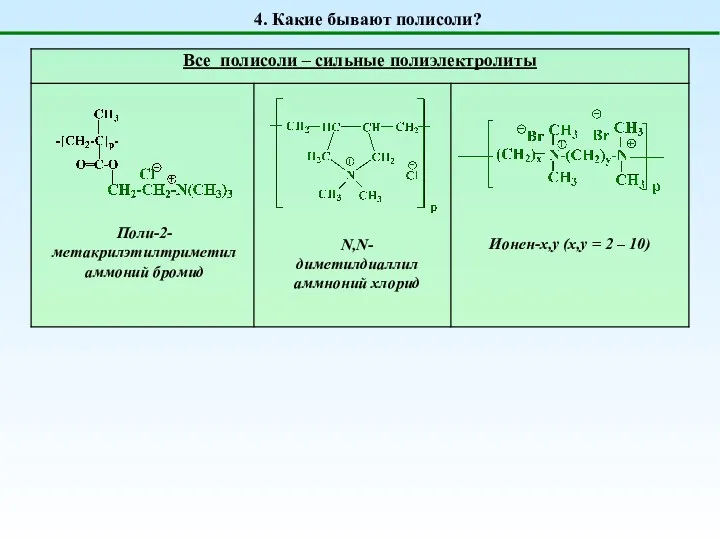
- 7. 4. Какие бывают полисоли? N,N-диметилдиаллиламмноний хлорид Ионен-x,y (x,y = 2 – 10) Поли-2-метакрилэтилтриметиламмоний бромид
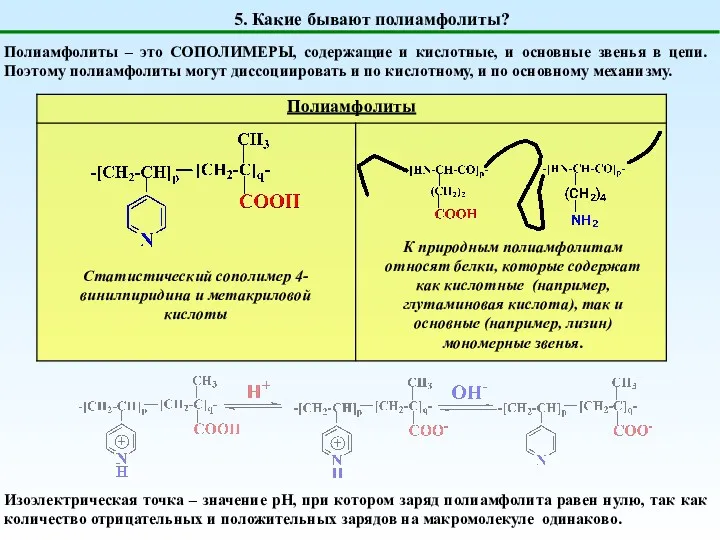
- 8. 5. Какие бывают полиамфолиты? Полиамфолиты – это СОПОЛИМЕРЫ, содержащие и кислотные, и основные звенья в цепи.
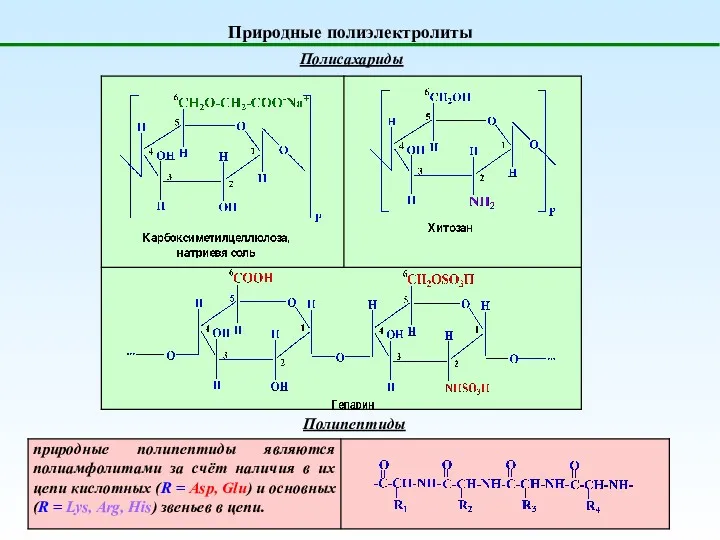
- 9. Природные полиэлектролиты Полисахариды Полипептиды
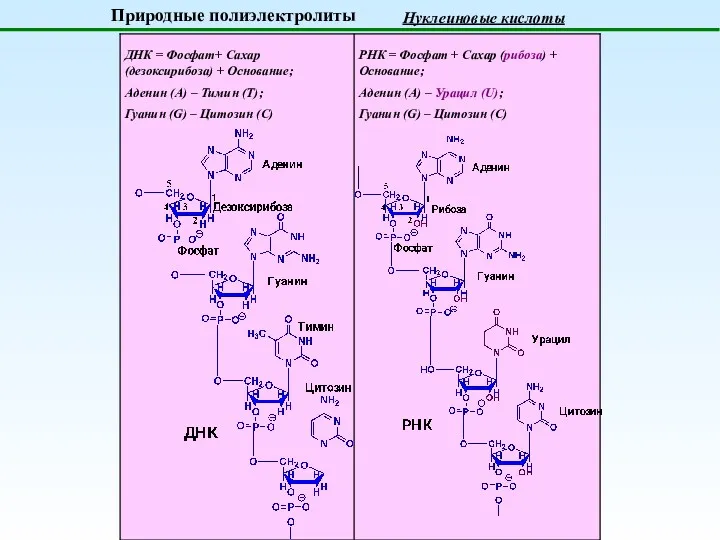
- 10. Природные полиэлектролиты Нуклеиновые кислоты
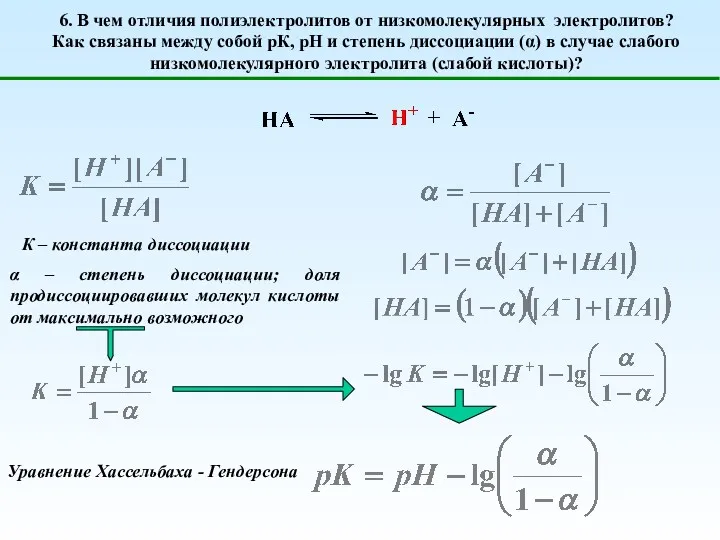
- 11. 6. В чем отличия полиэлектролитов от низкомолекулярных электролитов? Как связаны между собой рК, рН и степень
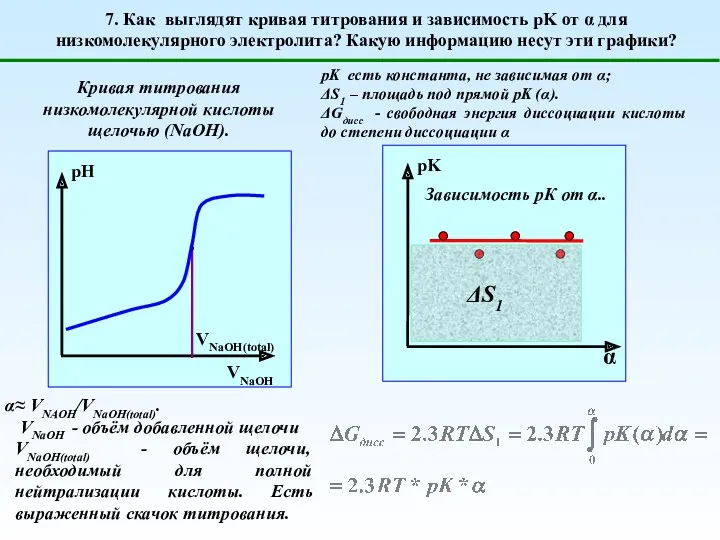
- 12. 7. Как выглядят кривая титрования и зависимость pK от α для низкомолекулярного электролита? Какую информацию несут
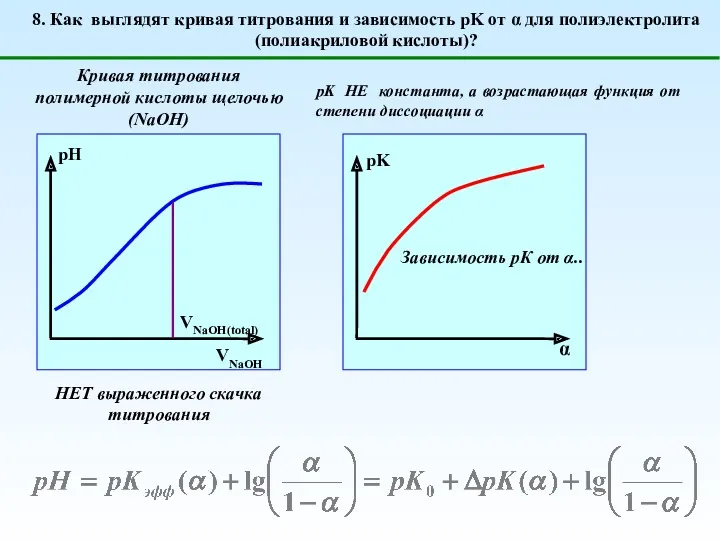
- 13. 8. Как выглядят кривая титрования и зависимость pK от α для полиэлектролита (полиакриловой кислоты)? Кривая титрования
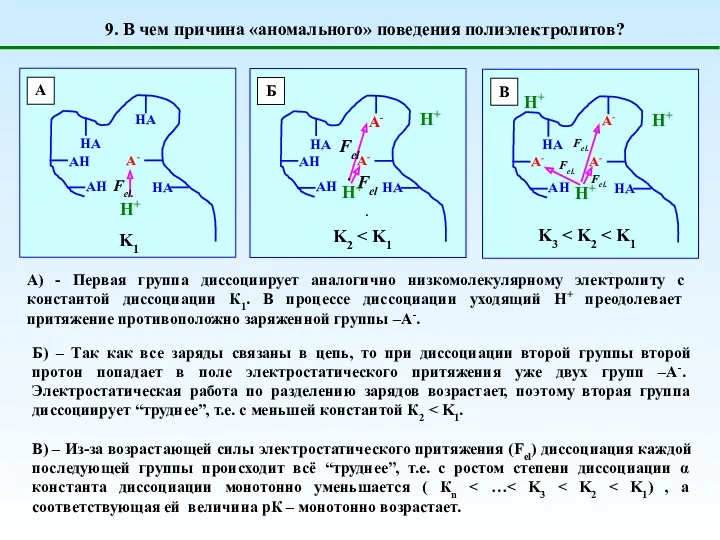
- 14. 9. В чем причина «аномального» поведения полиэлектролитов? А) - Первая группа диссоциирует аналогично низкомолекулярному электролиту с
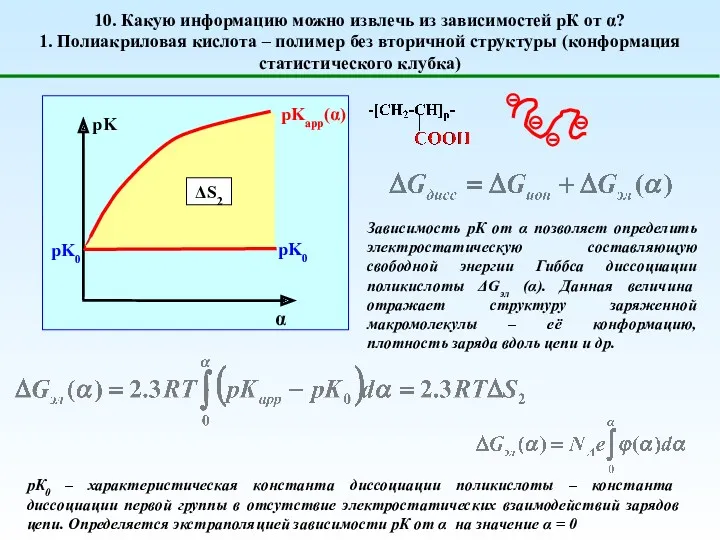
- 15. 10. Какую информацию можно извлечь из зависимостей рК от α? 1. Полиакриловая кислота – полимер без
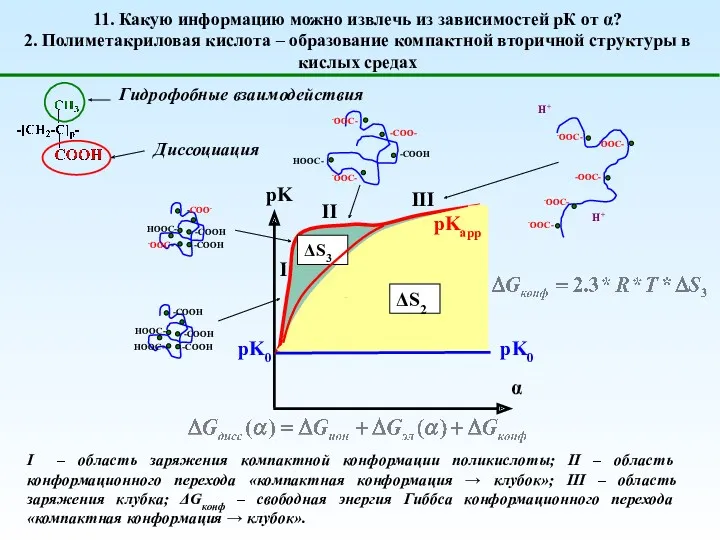
- 16. 11. Какую информацию можно извлечь из зависимостей рК от α? 2. Полиметакриловая кислота – образование компактной
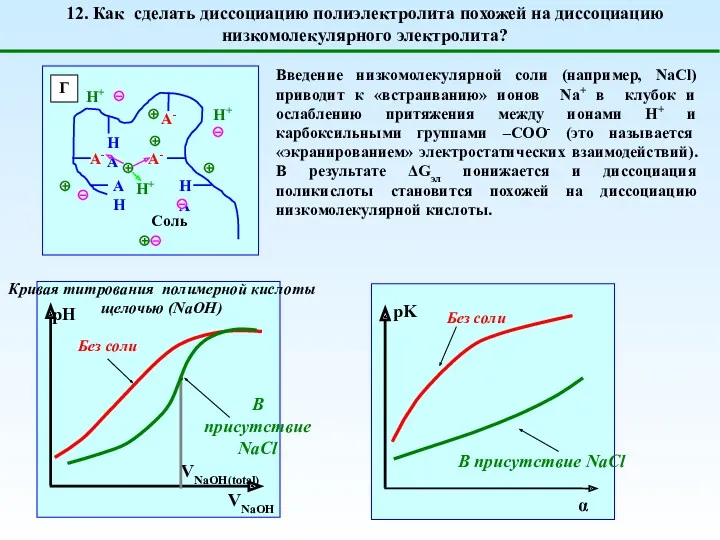
- 17. Введение низкомолекулярной соли (например, NaCl) приводит к «встраиванию» ионов Na+ в клубок и ослаблению притяжения между
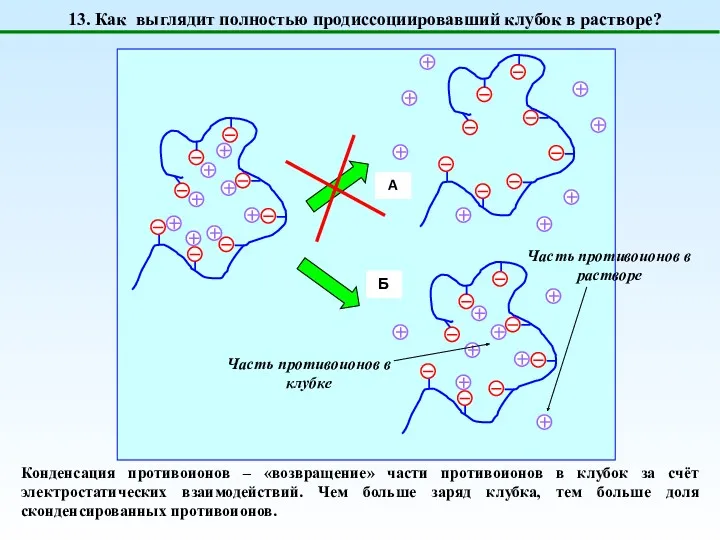
- 18. 13. Как выглядит полностью продиссоциировавший клубок в растворе? Конденсация противоионов – «возвращение» части противоионов в клубок
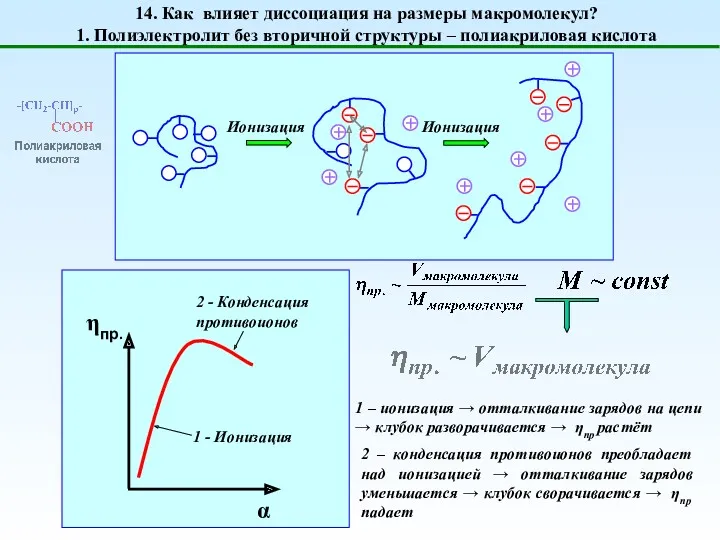
- 19. 14. Как влияет диссоциация на размеры макромолекул? 1. Полиэлектролит без вторичной структуры – полиакриловая кислота 1
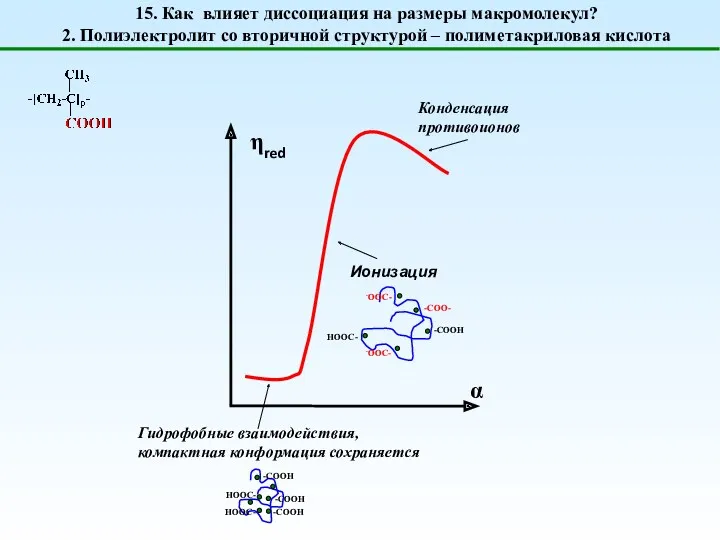
- 20. 15. Как влияет диссоциация на размеры макромолекул? 2. Полиэлектролит со вторичной структурой – полиметакриловая кислота Ионизация
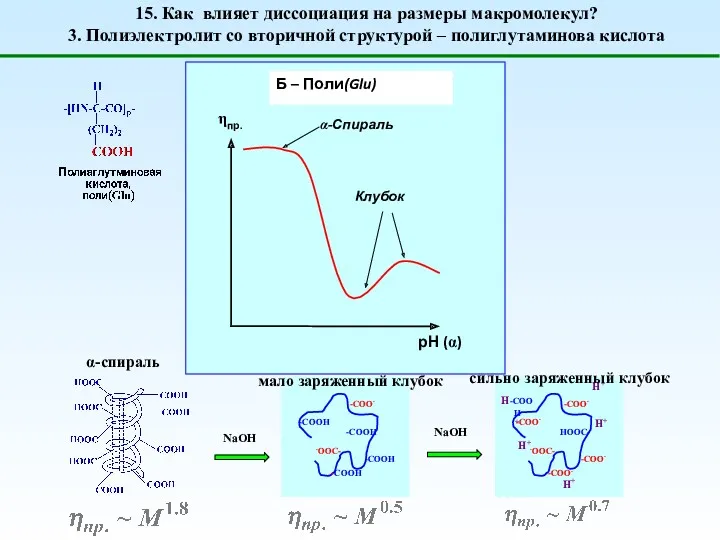
- 21. α-спираль мало заряженный клубок сильно заряженный клубок 15. Как влияет диссоциация на размеры макромолекул? 3. Полиэлектролит
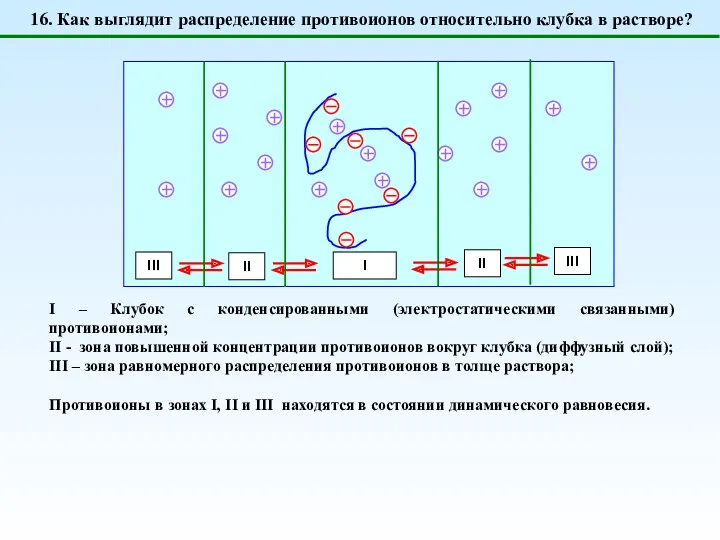
- 22. I – Клубок с конденсированными (электростатическими связанными) противоионами; II - зона повышенной концентрации противоионов вокруг клубка
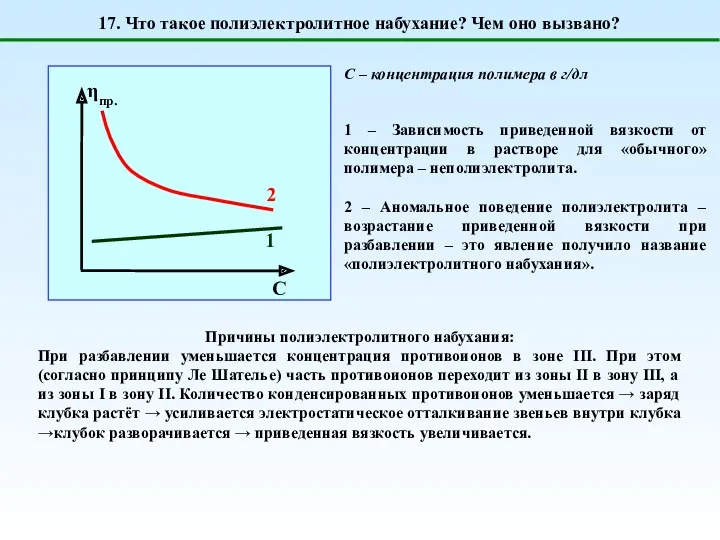
- 23. 1 – Зависимость приведенной вязкости от концентрации в растворе для «обычного» полимера – неполиэлектролита. 2 –
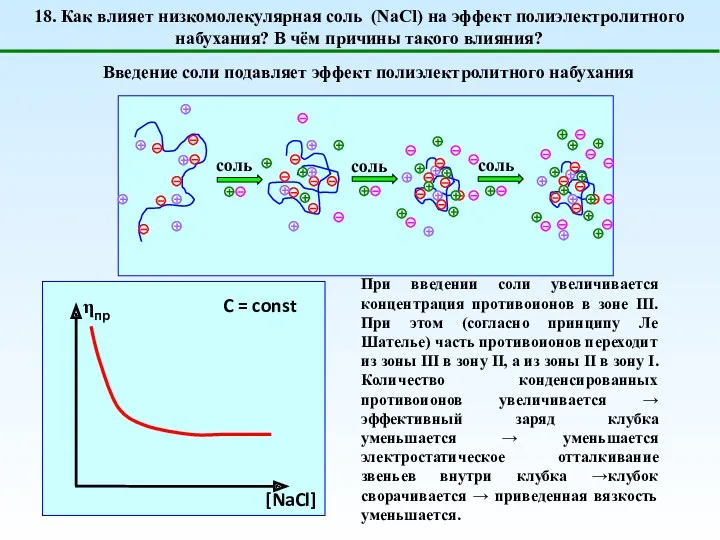
- 24. 18. Как влияет низкомолекулярная соль (NaCl) на эффект полиэлектролитного набухания? В чём причины такого влияния? C
- 25. 1 – [NaCl] = 0 (эффект полиэлектролитного набухания); 2 - [NaCl] 3 - [NaCl] = [Na+]полимер
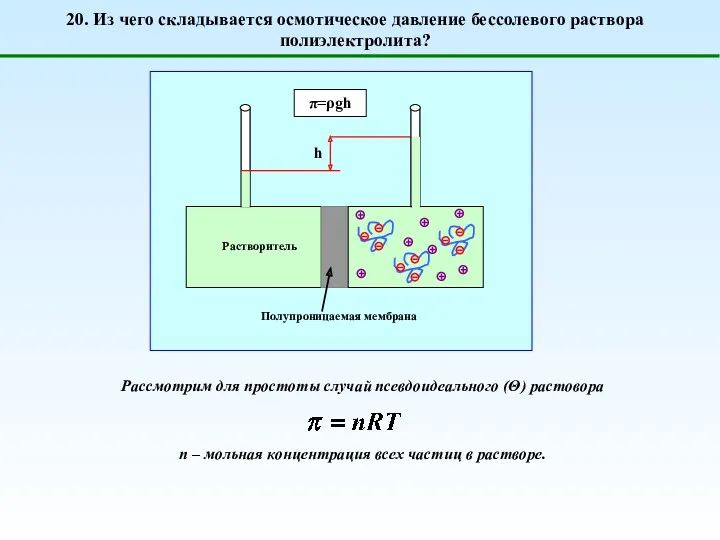
- 26. 20. Из чего складывается осмотическое давление бессолевого раствора полиэлектролита? Рассмотрим для простоты случай псевдоидеального (Θ) растовора
- 27. 20. Из чего складывается осмотическое давление бессолевого раствора полиэлектролита? np – мольная концентрация макромолекул; nm =P*
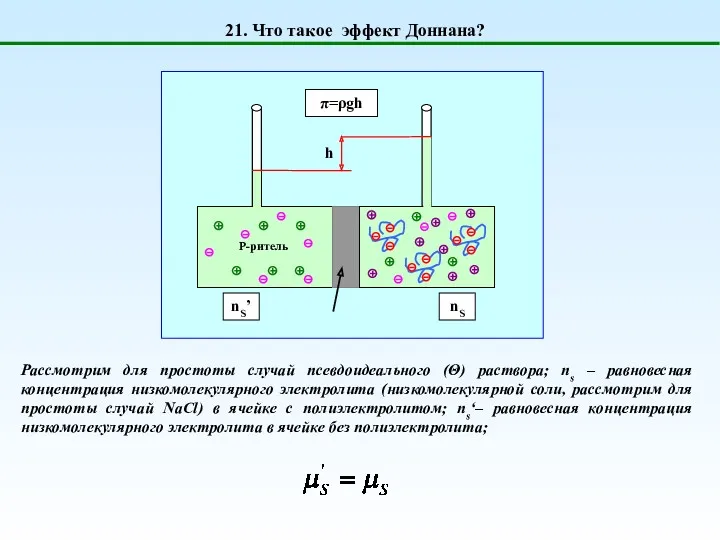
- 28. 21. Что такое эффект Доннана? Рассмотрим для простоты случай псевдоидеального (Θ) раствора; ns – равновесная концентрация
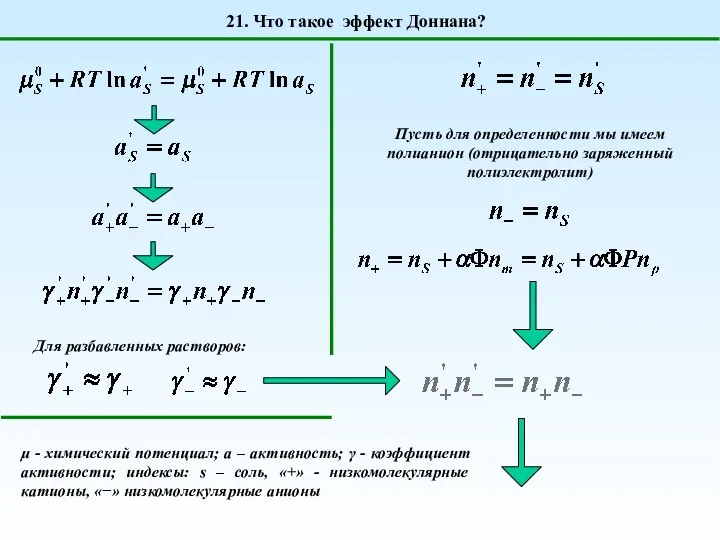
- 29. 21. Что такое эффект Доннана? Для разбавленных растворов: Пусть для определенности мы имеем полианион (отрицательно заряженный
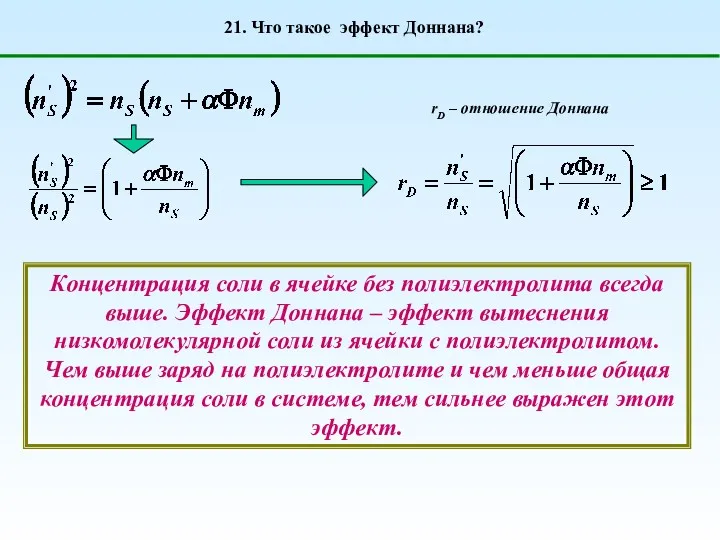
- 30. 21. Что такое эффект Доннана? rD – отношение Доннана Концентрация соли в ячейке без полиэлектролита всегда
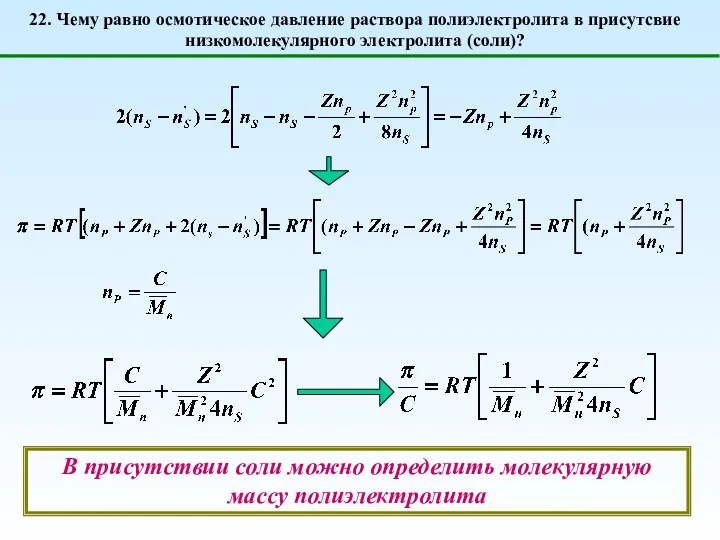
- 31. 22. Чему равно осмотическое давление раствора полиэлектролита в присутсвие низкомолекулярного электролита (соли)? Для простоты опять примем,
- 32. 22. Чему равно осмотическое давление раствора полиэлектролита в присутсвие низкомолекулярного электролита (соли)? В присутствии соли можно
- 33. 23. Чему равен второй вириальный коэффициент полиэлектролита? Для полиэлектролитов А2 > 0; Чем больше плотность заряда
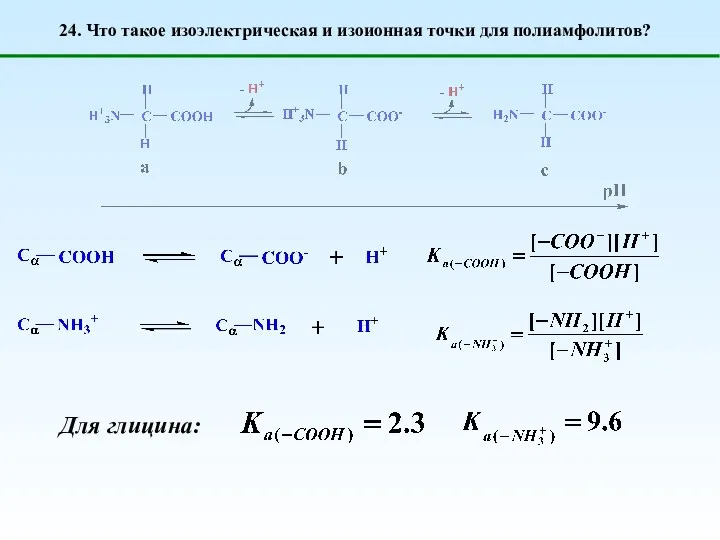
- 34. 24. Что такое изоэлектрическая и изоионная точки для полиамфолитов? Для глицина:
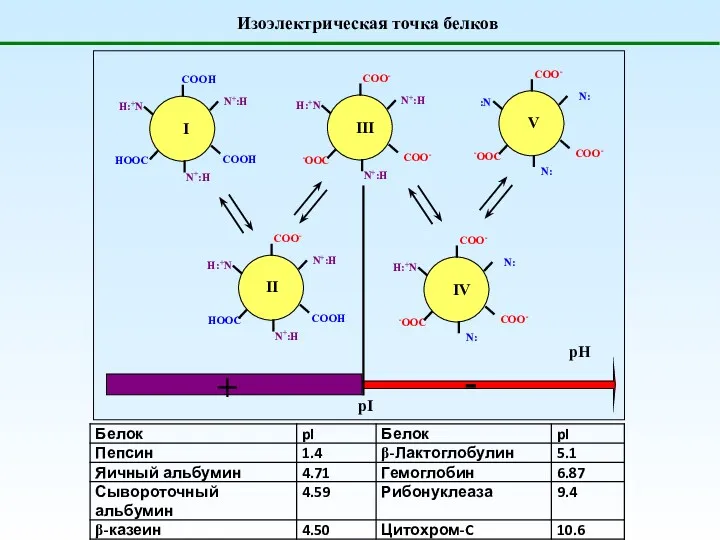
- 35. 24. Что такое изоэлектрическая и изоионная точки для полиамфолитов? Изоэлектрическая точка (pI, ИЭТ) – значение рН
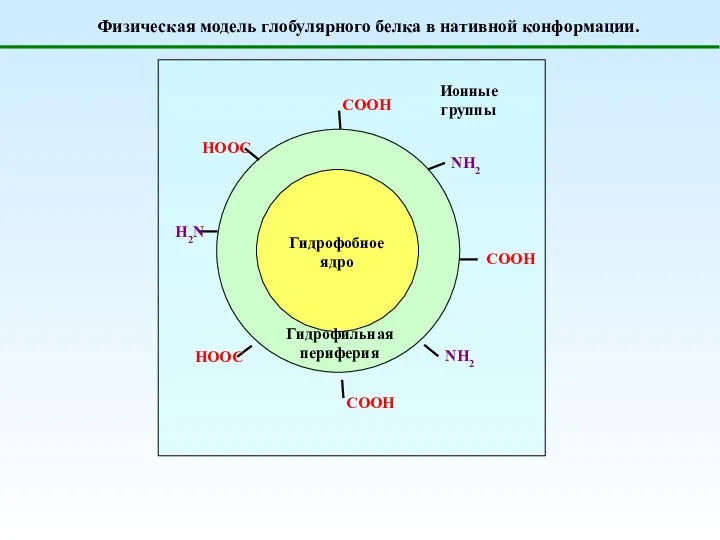
- 36. Физическая модель глобулярного белка в нативной конформации.
- 37. Изоэлектрическая точка белков
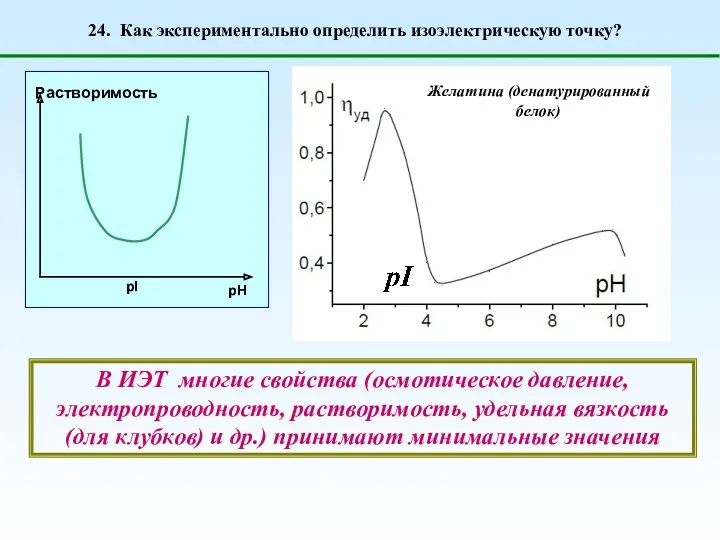
- 38. 24. Как экспериментально определить изоэлектрическую точку? Желатина (денатурированный белок) В ИЭТ многие свойства (осмотическое давление, электропроводность,
- 39. 24. Что такое изоионная точка? Как она связана с изоэлектрической точкой? Изоионная точка (pS, ИИТ) –
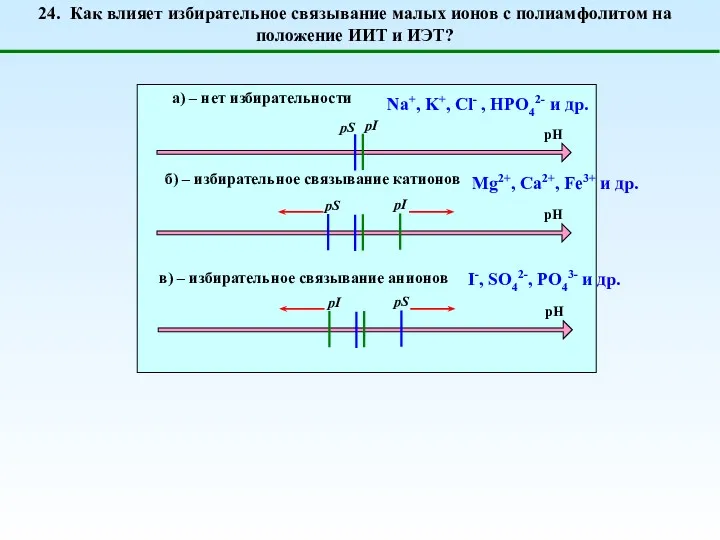
- 40. 24. Как влияет избирательное связывание малых ионов с полиамфолитом на положение ИИТ и ИЭТ? Mg2+, Ca2+,
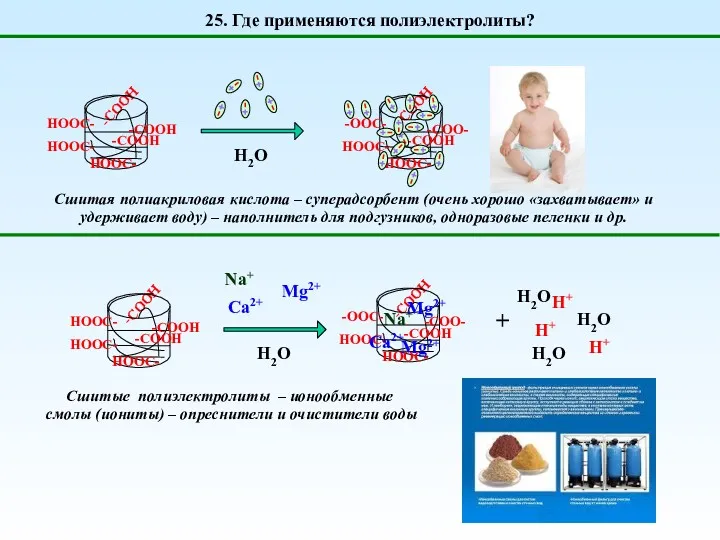
- 41. 25. Где применяются полиэлектролиты? Сшитая полиакриловая кислота – суперадсорбент (очень хорошо «захватывает» и удерживает воду) –
- 43. Скачать презентацию
![1 – [NaCl] = 0 (эффект полиэлектролитного набухания); 2 -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265842/slide-24.jpg)





 Удивительные свойства воды
Удивительные свойства воды Electronică aplicată. (Curs 2)
Electronică aplicată. (Curs 2) Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2) 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Железо и его соединения
Железо и его соединения Химические превращения веществ
Химические превращения веществ Белки. Функции белков
Белки. Функции белков Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Значення хімічних процесів у природі
Значення хімічних процесів у природі Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Реакции ионного обмена
Реакции ионного обмена Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Группа редкоземельных элементов
Группа редкоземельных элементов Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Железо
Железо Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)