Содержание
- 2. Кислотные и основные свойства являются важными аспектами реакционной способности органических соединений. Важную роль в химических процессах
- 3. Существует несколько концепций кислот и оснований: Теория Аррениуса. Кислоты – соединения, при диссоциации которых отщепляется протон
- 4. Для оценки кислотных и основных свойств органических соединений наибольшее значение имеют теории Бренстеда-Лоури и Льюиса.
- 5. Кислоты Бренстеда – это нейтральные молекулы и ионы, способные отщепить протон водорода (доноры протонов). Основания Бренстеда
- 6. A- H + B кислота основание A - + B+-H сопряженные основание кислота Взаимодействие кислоты и
- 7. H Cl + H2O кислота основание Cl - + H3O+ сопряженные основание кислота Кислотные и основные
- 8. Понятия «кислотность» и «основность» относительны: в зависимости от условий одно и то же соединение может проявлять
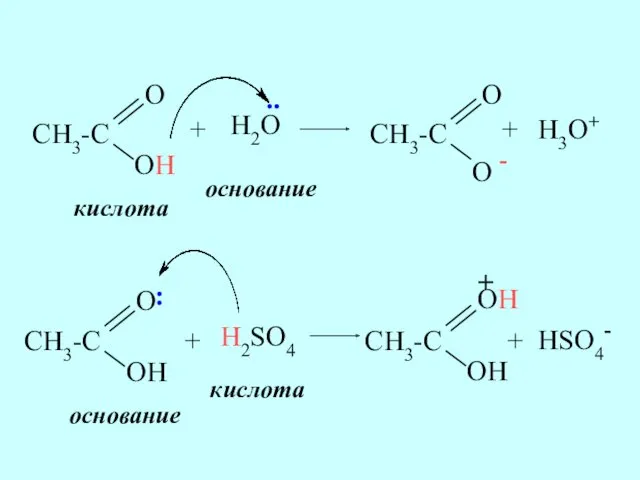
- 9. + H2O + H3O+ кислота основание + H2SO4 + HSO4- основание кислота .. :
- 10. Кислоты Бренстеда
- 11. Так как в биохимических процессах растворителем обычно является вода, то кислотные и основные свойства органических соединений
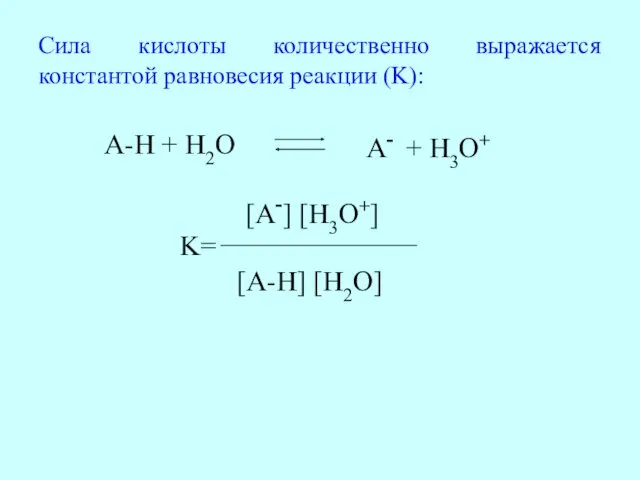
- 12. Сила кислоты количественно выражается константой равновесия реакции (K): A-H + H2O A- + H3O+ K= [A-]
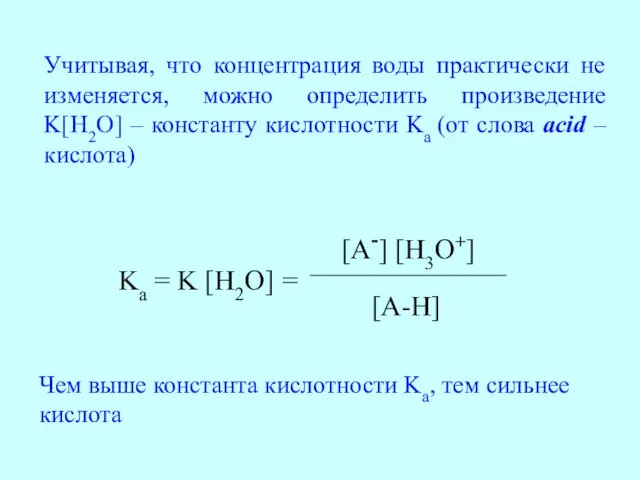
- 13. Учитывая, что концентрация воды практически не изменяется, можно определить произведение K[H2O] – константу кислотности Ka (от
- 14. Величины Ka органических соединений малы (например Ka уксусной кислоты равна 1,75·10-5), такими величинами неудобно пользоваться, поэтому
- 15. Примеры кислот Бренстеда Обратите внимание! Кислотами могут быть не только нейтральные молекулы, но и катионы. Нейтральные
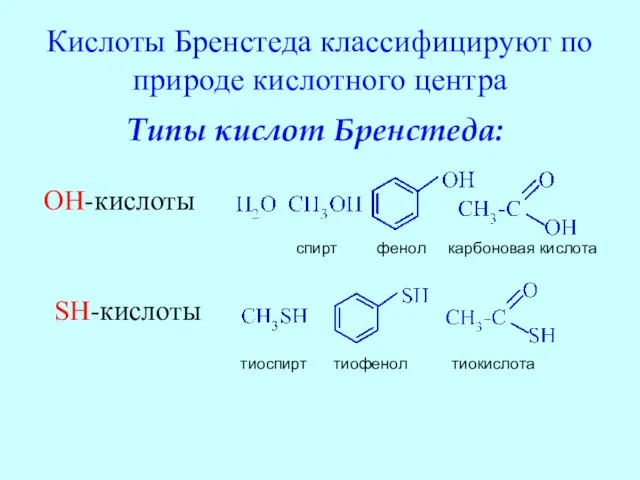
- 16. Кислоты Бренстеда классифицируют по природе кислотного центра Типы кислот Бренстеда: OH-кислоты спирт фенол карбоновая кислота SH-кислоты
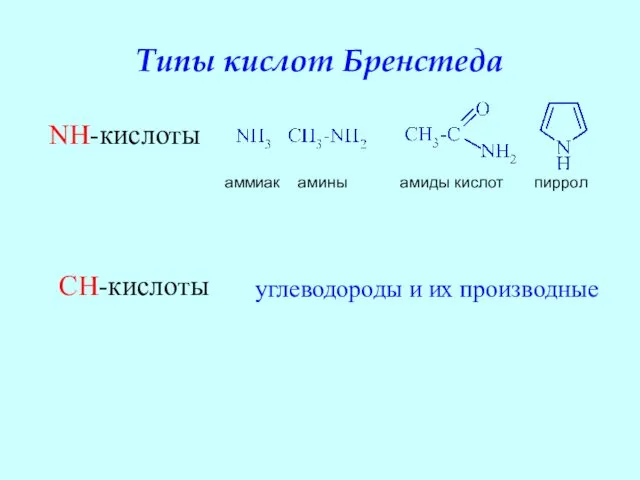
- 17. Типы кислот Бренстеда NH-кислоты аммиак амины амиды кислот пиррол CH-кислоты углеводороды и их производные
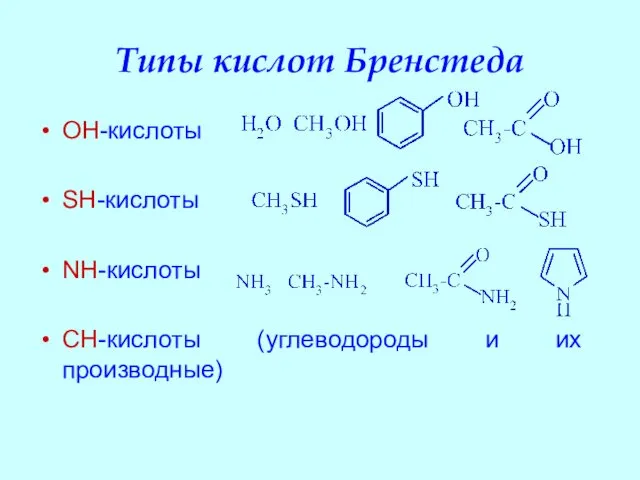
- 18. Типы кислот Бренстеда OH-кислоты SH-кислоты NH-кислоты CH-кислоты (углеводороды и их производные)
- 19. Образующийся в результате отщепления протона водорода анион может вновь присоединить протон, т.е. процесс кислотно-основного взаимодействия обратим.
- 20. Стабильность аниона определяется степенью делокализации заряда, которая зависит от следующих факторов: природа атома кислотного центра влияние
- 21. Природа атома кислотного центра Чем более электроотрицателен атом, тем сильнее он удерживает отрицательный заряд, тем труднее
- 22. Электроотрицательность атомов (способность удерживать электроны) можно сравнить, используя таблицу Менделеева: она увеличивается в периоде слева направо
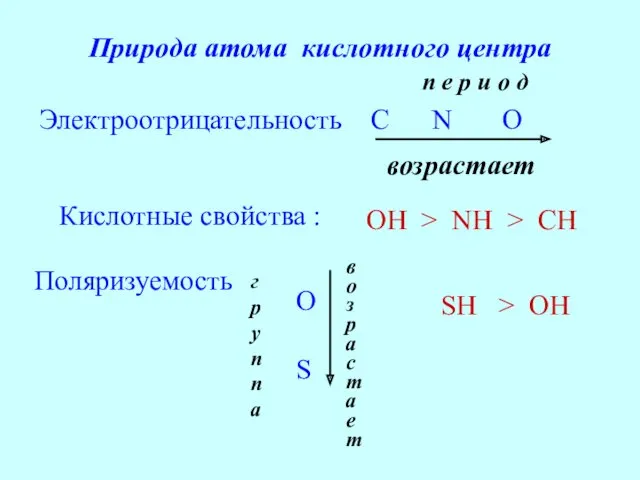
- 23. Природа атома кислотного центра Электроотрицательность C N O возрастает Кислотные свойства : OH > NH >
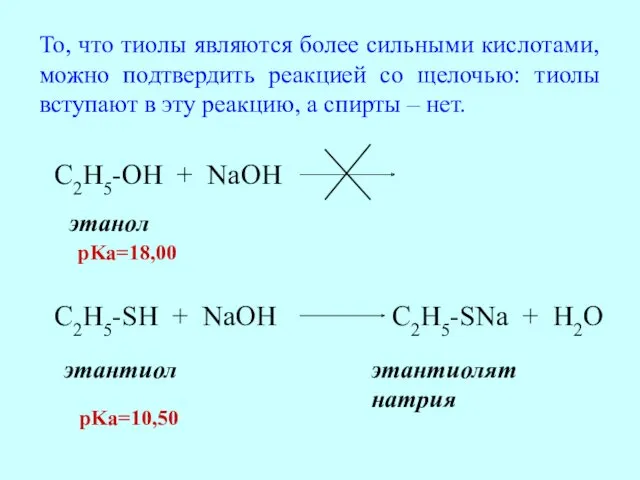
- 24. C2H5-OH + NaOH этанол C2H5-SH + NaOH C2H5-SNa + H2O этантиол этантиолят натрия pKa=18,00 pKa=10,50 То,
- 25. При сравнении кислотных свойств различных типов кислот Бренстеда необходимо рассматривать фактор влияния заместителя и особенно сопряженной
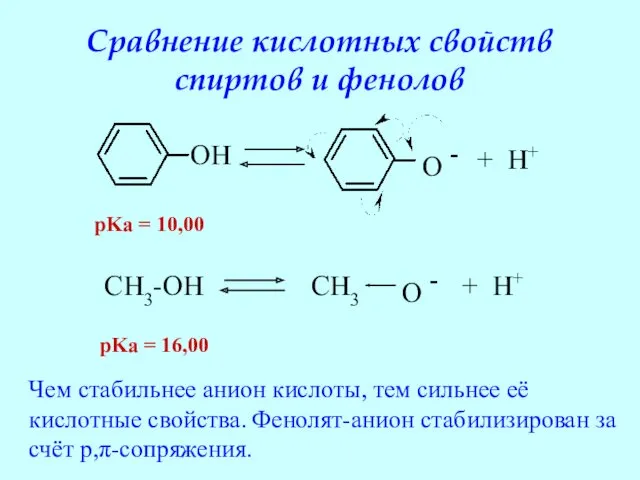
- 26. Сравнение кислотных свойств спиртов и фенолов OH O - + H+ CH3-OH CH3 O - +
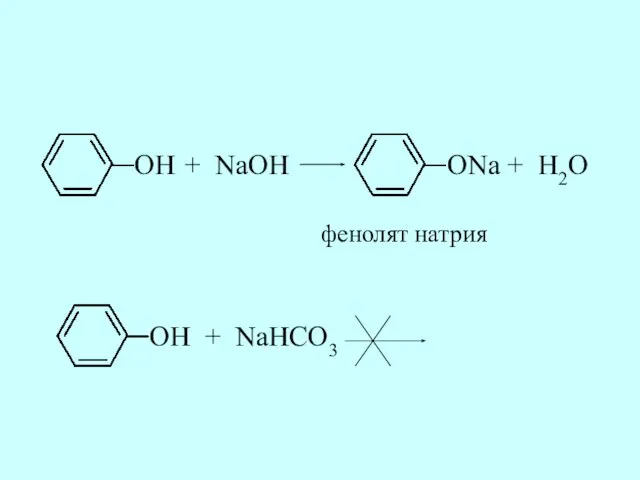
- 27. Фенол проявляет слабые кислотные свойства: он взаимодействует с сильным основанием (щелочью), но не может вытеснить угольную
- 28. OH + NaOH ONa + H2O фенолят натрия OH + NaHCO3
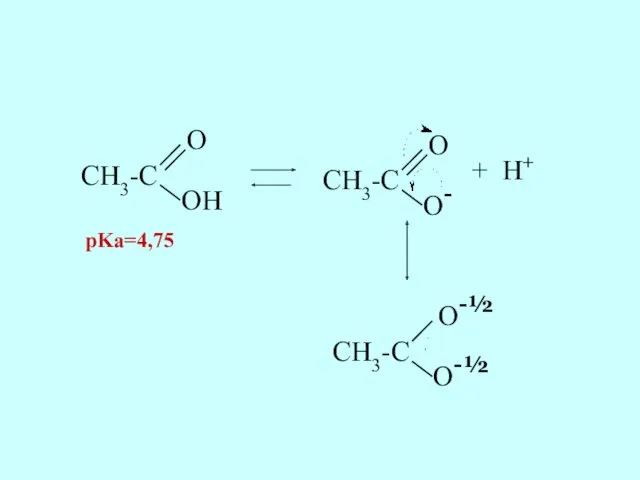
- 29. Карбоновые кислоты являются более сильными кислотами, чем фенолы. Это связано с повышенной стабильностью карбоксилат-иона: отрицательный заряд
- 30. CH3-C O OH CH3-C O O- + H+ CH3-C O-½ O-½ pKa=4,75
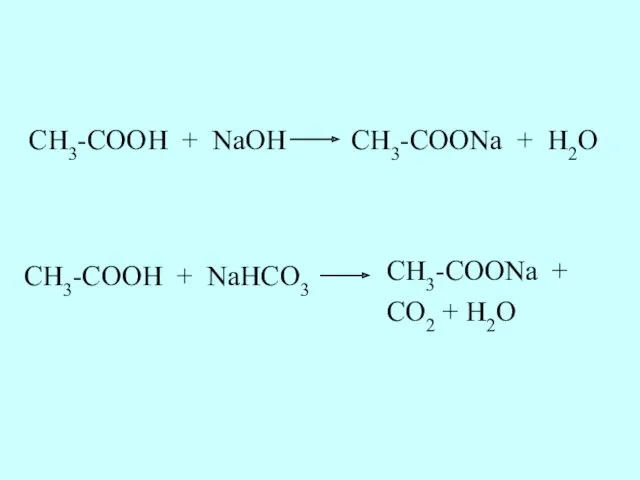
- 31. Карбоновые кислоты взаимодействуют со щелочами, а также с солями угольной кислоты. Это доказывает, что карбоновые кислоты
- 32. CH3-COOH + NaOH CH3-COONa + H2O CH3-COOH + NaHCO3 CH3-COONa + CO2 + H2O
- 33. Влияние заместителей в радикале на кислотные свойства Электроноакцепторные заместители способствуют делокализации заряда в анионе, следовательно, повышают
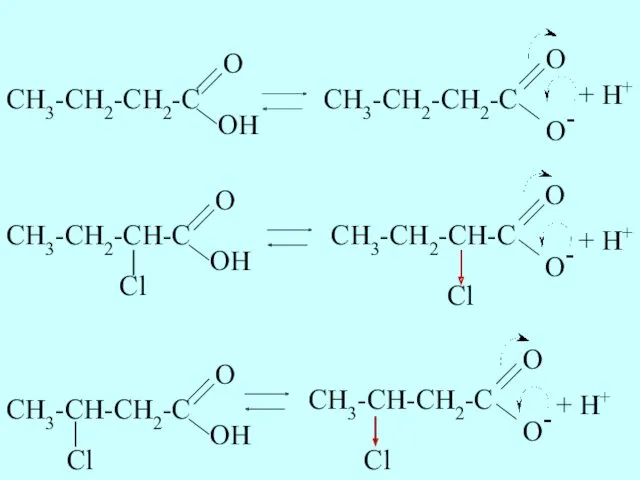
- 34. Сравним кислотные свойства масляной (бутановой), α-хлормасляной (2-хлорбутановой) и β-хлормасляной (3-хлорбутановой) кислот. Запишем формулы соединений, покажем отщепление
- 35. + H+ + H+ O- O CH3-CH2-CH-C Cl + H+ O- O CH3-CH-CH2-C Cl
- 36. Хлор из-за высокой электроотрицательности проявляет отрицательный индуктивный эффект, он смещает электронную плотность на себя и способствует
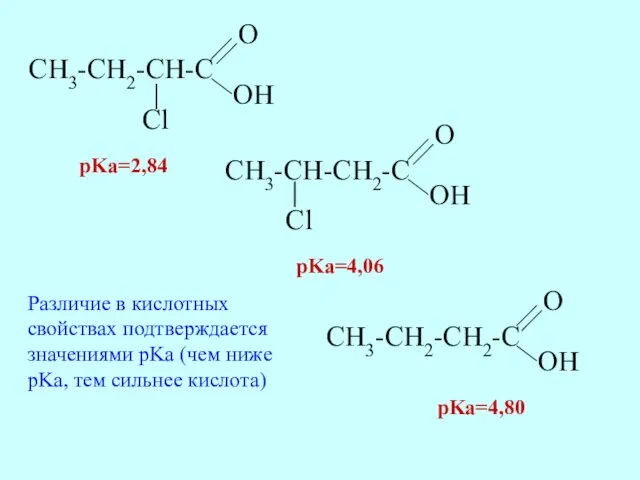
- 37. pKa=4,80 pKa=2,84 pKa=4,06 Различие в кислотных свойствах подтверждается значениями pKa (чем ниже pKa, тем сильнее кислота)
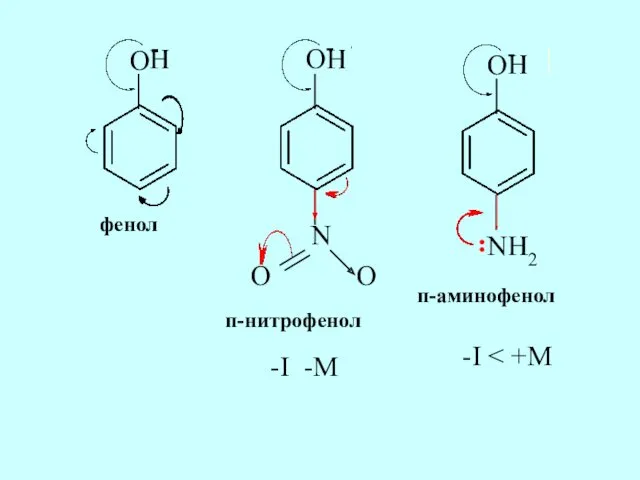
- 38. Сравним кислотные свойства фенола, п-нитрофенола и п-аминофенола. Запишем формулы соединений, покажем отщепление протона водорода, отметим электронные
- 39. O- H+ O- H+ N O O O- H+ NH2 фенол п-нитрофенол п-аминофенол : -I -M
- 40. Нитро-группа проявляет отрицательный индуктивный эффект и отрицательный мезомерный эффект, значит, является электроноакцепторным заместителем и способствует стабилизации
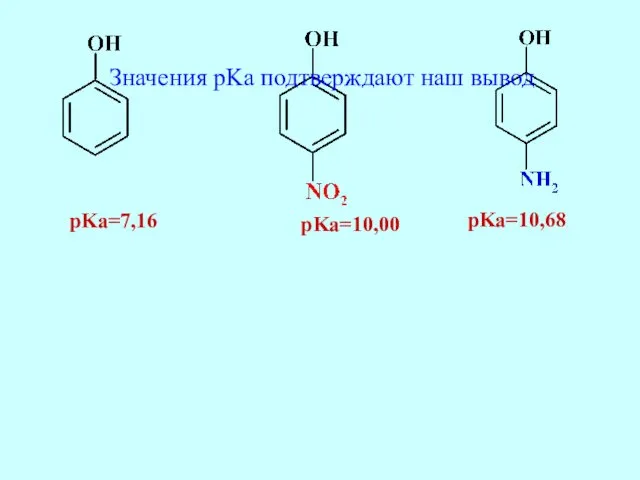
- 41. pKa=10,00 pKa=7,16 pKa=10,68 Значения pKa подтверждают наш вывод
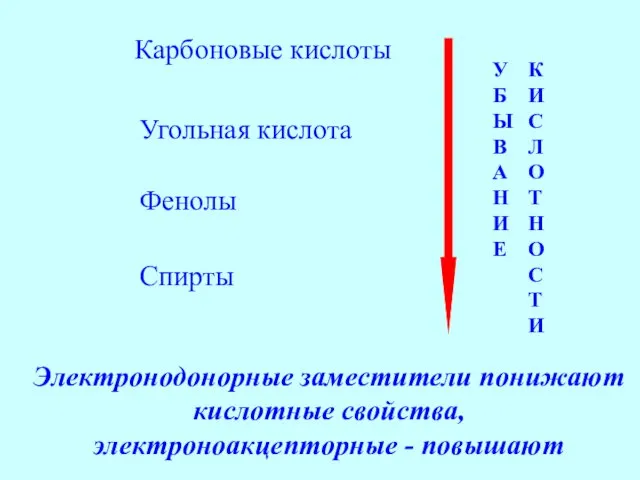
- 42. Итак, мы сравнили силу различных OH-кислот и пришли к следующему выводу:
- 43. Карбоновые кислоты Угольная кислота Фенолы Спирты У Б Ы В А Н И Е К И
- 44. Основания Бренстеда
- 45. Основания Бренстеда – это нейтральные молекулы и ионы, способные присоединить протон водорода (акцепторы протонов).
- 46. Нейтральные молекулы могут присоединять протон водорода за счет неподелённой электронной пары (n-электронов) или за счет пары
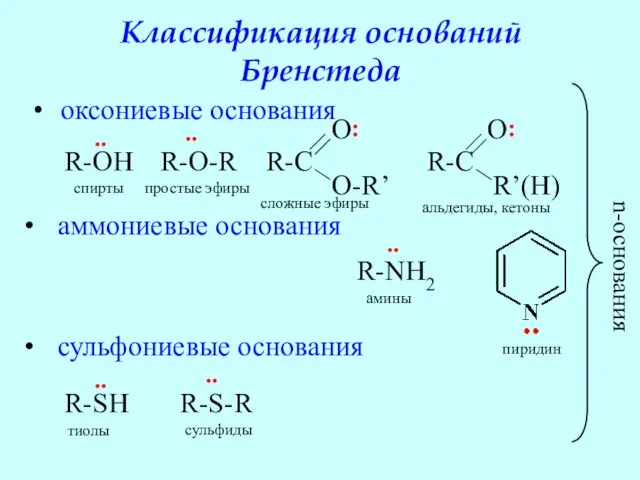
- 47. Классификация оснований Бренстеда оксониевые основания аммониевые основания сульфониевые основания n-основания спирты простые эфиры сложные эфиры альдегиды,
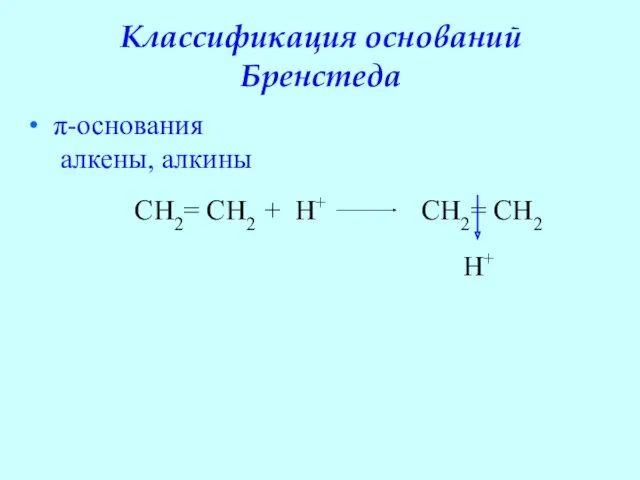
- 48. Классификация оснований Бренстеда π-основания алкены, алкины CH2= CH2 + H+ CH2= CH2 H+
- 49. π-основания – слабые, т.к. протонирование происходит не за счет свободной пары электронов, а за счет электронов
- 50. Сила основания выражается величиной pKBH+ . pKBH+ - это pKa сопряженной с данным основанием кислоты. Чем
- 51. Факторы, влияющие на основные свойства С увеличением электроотрицательности атома основного центра основность уменьшается. (Чем выше электроотрицательность,
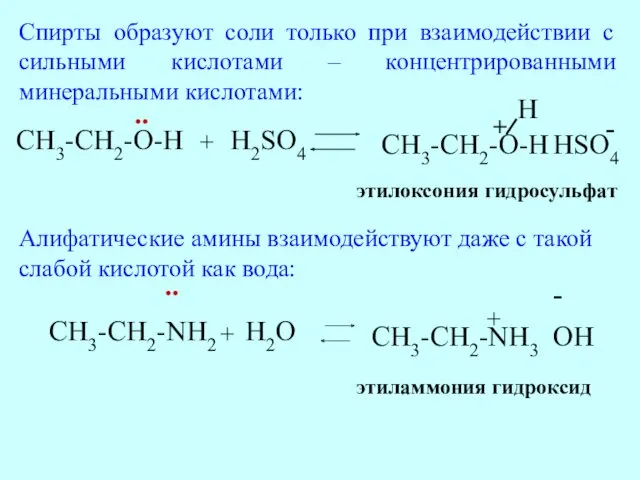
- 52. CH3-CH2-NH2 + H2O CH3-CH2-NH3 + OH - этиламмония гидроксид .. CH3-CH2-O-H .. + H2SO4 CH3-CH2-O-H H
- 53. Факторы, влияющие на основные свойства С увеличением поляризуемости атома основного центра основность уменьшается. (Чем выше поляризуемость
- 54. Факторы, влияющие на основные свойства Влияние заместителей, особенно наличие сопряженной системы. Электронодонорные заместители повышают основность, а
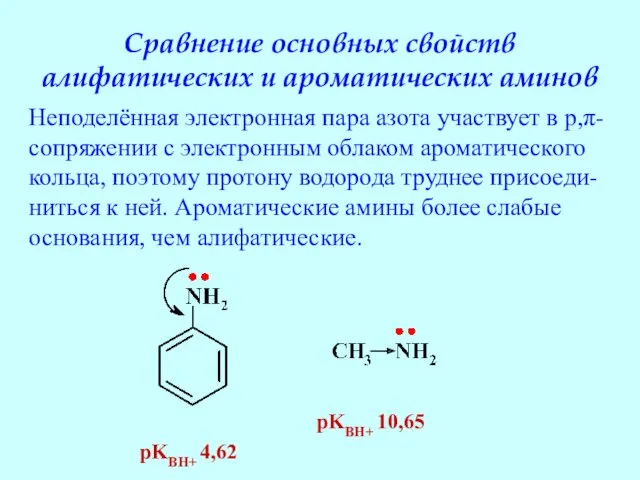
- 55. Сравнение основных свойств алифатических и ароматических аминов pKBH+ 4,62 pKBH+ 10,65 Неподелённая электронная пара азота участвует
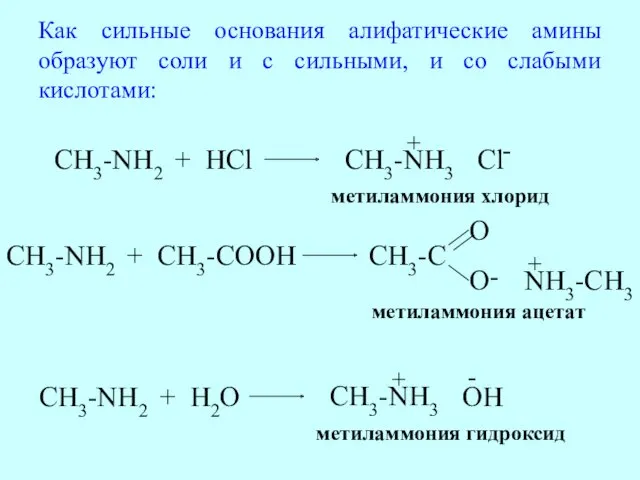
- 56. Как сильные основания алифатические амины образуют соли и с сильными, и со слабыми кислотами: CH3-NH2 +
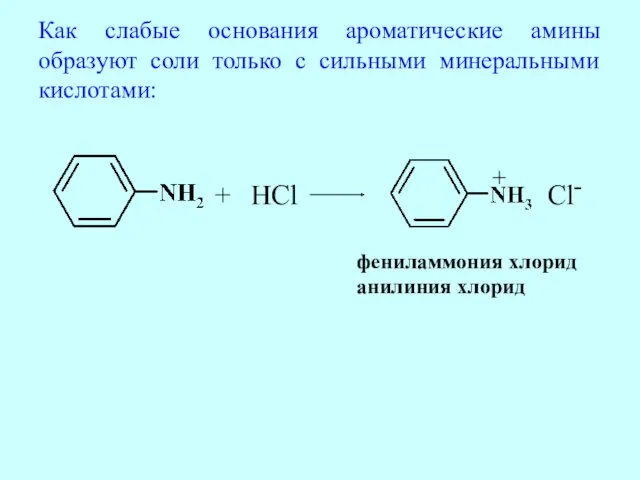
- 57. Как слабые основания ароматические амины образуют соли только с сильными минеральными кислотами: + HCl + Cl
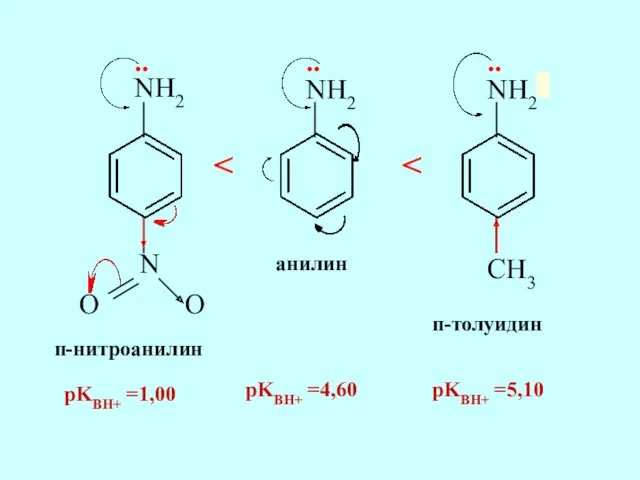
- 58. Электронодонорные заместители в кольце повышают основные свойства, электроно-акцепторные - понижают
- 59. NH2 NH2 N O O NH2 CH3 анилин п-нитроанилин п-толуидин .. .. .. pKBH+ =1,00 pKBH+
- 61. Скачать презентацию


































 Композиционные материалы
Композиционные материалы Биохимическая трансформация веществ (2)
Биохимическая трансформация веществ (2) Методы выращивания монокристаллов кремния. Сравнение. Сферы применения монокристаллов, выращенных различными методами
Методы выращивания монокристаллов кремния. Сравнение. Сферы применения монокристаллов, выращенных различными методами Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева
Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева Р-элементы IV Группы Периодической Системы
Р-элементы IV Группы Периодической Системы Польза и вред химического производства
Польза и вред химического производства Мир камня. Чувашский национальный музей
Мир камня. Чувашский национальный музей Свойства растворов электролитов
Свойства растворов электролитов Растворы электролитов. Ионизация воды и шкала рН
Растворы электролитов. Ионизация воды и шкала рН Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне Физико-химические свойства аммиака. Производство аммиака
Физико-химические свойства аммиака. Производство аммиака Происхождение химических элементов
Происхождение химических элементов Химические реакции. Закон сохранения массы веществ
Химические реакции. Закон сохранения массы веществ Химические формулы
Химические формулы Химическая промышленность
Химическая промышленность Строение атома углерода. Валентные состояния атома углерода
Строение атома углерода. Валентные состояния атома углерода Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие Приёмы обращения с лабораторным оборудованием и основы техники безопасности
Приёмы обращения с лабораторным оборудованием и основы техники безопасности Основные типы химический реакций
Основные типы химический реакций Процессы нитрования
Процессы нитрования Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер
Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Хімічна рівновага
Хімічна рівновага Растворы. Роль растворов в природе
Растворы. Роль растворов в природе Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Молекулы и атомы
Молекулы и атомы Нефть
Нефть Ионная связь и степень окисления. 8 класс
Ионная связь и степень окисления. 8 класс