Содержание
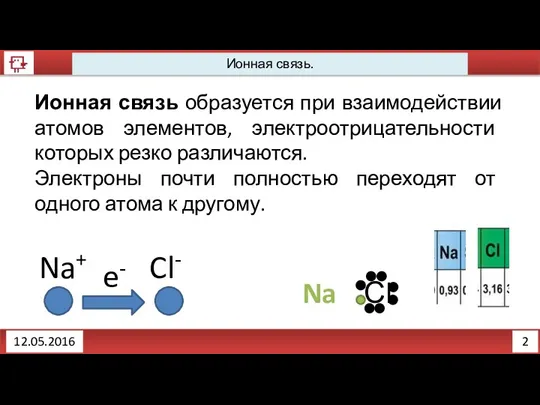
- 2. 2 12.05.2016 Ионная связь. Ионная связь образуется при взаимодействии атомов элементов, электроотрицательности которых резко различаются. Электроны
- 3. 3 12.05.2016 Ионная связь. Химическую связь, возникающую между ионами в результате действия электростатических сил притяжения, называют
- 4. 4 12.05.2016 Степени окисления Степень окисления –условный заряд атома в молекуле, вычисленный в предположении, что все
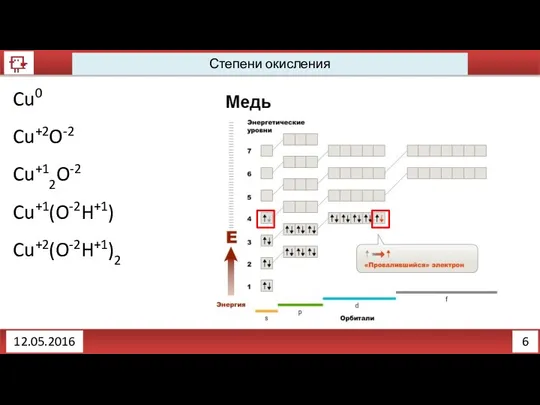
- 5. 5 12.05.2016 Степени окисления Определим степени окисления: Cu CuO Cu2O Cu(OH) Cu(OH)2
- 6. 6 12.05.2016 Степени окисления Cu0 Cu+2O-2 Cu+12O-2 Cu+1(O-2H+1) Cu+2(O-2H+1)2
- 7. 7 12.05.2016 Степени окисления Определим степени окисления: Li Li2O Li(OH)
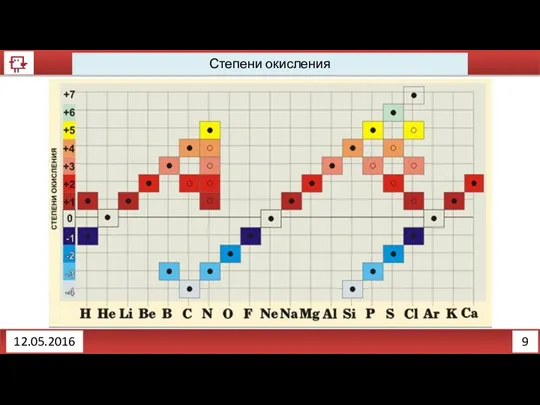
- 8. 8 12.05.2016 степень окисления определяет число электронов, смещенных от атома менее электроотрицательного элемента к атому более
- 9. 9 12.05.2016 Степени окисления
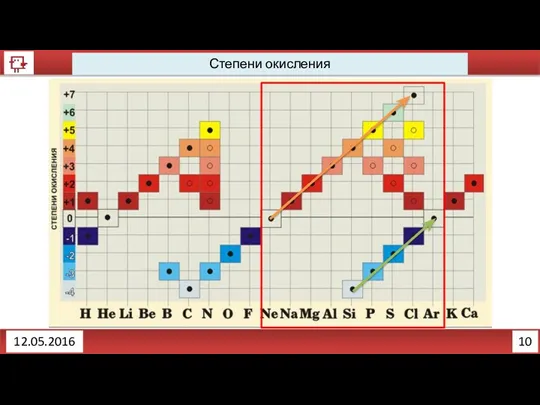
- 10. 10 12.05.2016 Степени окисления
- 11. 11 12.05.2016 Запись степени окисления и заряда иона различаются. Li0 Li+ Li+12O-2 OH- Li+1(O-2H+1) [AlCl6]3- Степени
- 12. 12 12.05.2016 Правила вычисления степени окисления элементов Сумма степеней окисления атомов в соединении всегда равна нулю,
- 13. 12 12.05.2016 Степени окисления versus валентность Степень окисления не всегда совпадает с валентностью. Например, молекула H2.
- 14. 14 12.05.2016 Окислительно-восстановительные реакции Окислительно-восстановительные реакции – такие реакции, в которых меняется степень окисления элементов. С
- 15. 15 12.05.2016 Окислительно-восстановительные реакции Окислительно-восстановительные реакции – такие реакции, в которых меняется степень окисления элементов. С
- 16. 16 12.05.2016 Метод электронно-ионного баланса Окислительно-восстановительные реакции бывает сложно уровнять. K2Cr2O7 + H2SO4 + H2S =
- 17. 17 12.05.2016 Метод электронно-ионного баланса K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т)
- 18. 18 12.05.2016 Метод электронно-ионного баланса K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т)
- 19. 19 12.05.2016 Метод электронно-ионного баланса K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т)
- 20. 20 12.05.2016 Метод электронно-ионного баланса K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т)
- 21. 29 5.05.2016 Ковалентная связь Химическая связь Ковалентная Металлическая Ионная H2O H2 Fe, Au NaCl 1.24 0
- 23. Скачать презентацию
















 Каменный уголь. Физические и химические свойства
Каменный уголь. Физические и химические свойства Природный газ
Природный газ Поливинилхлорид (ПВХ, PVC)
Поливинилхлорид (ПВХ, PVC) Периодический закон и периодическая система Д.И. Менделеева. 9 класс
Периодический закон и периодическая система Д.И. Менделеева. 9 класс Средние породы. Типичный андезитовый вулкан
Средние породы. Типичный андезитовый вулкан Окислительно-восстановительные реакции. Подготовка к К/Р. 9 класс
Окислительно-восстановительные реакции. Подготовка к К/Р. 9 класс Углеводы. Моносахариды
Углеводы. Моносахариды Цинк
Цинк ОСНОВАНИЯ, ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА
ОСНОВАНИЯ, ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА Хімічні властивості алкенів
Хімічні властивості алкенів Центрифугирование в цитологии
Центрифугирование в цитологии Пища, с точки зрения химика
Пища, с точки зрения химика Сплавы металлов. 11 класс
Сплавы металлов. 11 класс Водород. Строение, свойства, получение, применение
Водород. Строение, свойства, получение, применение Химические реакции в органической химии (10 класс)
Химические реакции в органической химии (10 класс) Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Коллигативные свойства растворов
Коллигативные свойства растворов Пластмассы
Пластмассы Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Галогены. Положение в ПСХЭ Д.И. Менделеева
Галогены. Положение в ПСХЭ Д.И. Менделеева Methods for processing of liquid waste
Methods for processing of liquid waste Готовимся к экзамену по химии
Готовимся к экзамену по химии Хроматографические методы в аналитической химии
Хроматографические методы в аналитической химии Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г
Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г Сульфиды. Занятие 7
Сульфиды. Занятие 7 Судың кермектілігі. Сілтілік металдар мен сілтілікжер металдардың табиғи қосылыстарының қазақстандағы кен орындары
Судың кермектілігі. Сілтілік металдар мен сілтілікжер металдардың табиғи қосылыстарының қазақстандағы кен орындары Аммиак. Строения молекулы аммиака, его физических и химических свойств
Аммиак. Строения молекулы аммиака, его физических и химических свойств