Содержание
- 3. КЛАССИФИКАЦИЯ ОСНОВАНИЙ
- 4. Гидроксид аммония Гидра́т аммиа́ка (гидрокси́д аммо́ния, аммиа́чная вода́) — соединение, образующееся при взаимодействии аммиака с водой
- 5. ОСНОВАНИЯ сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном
- 6. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ При взаимодействии с кислотой образуется соль и вода: NaOH + HCl → NaCl
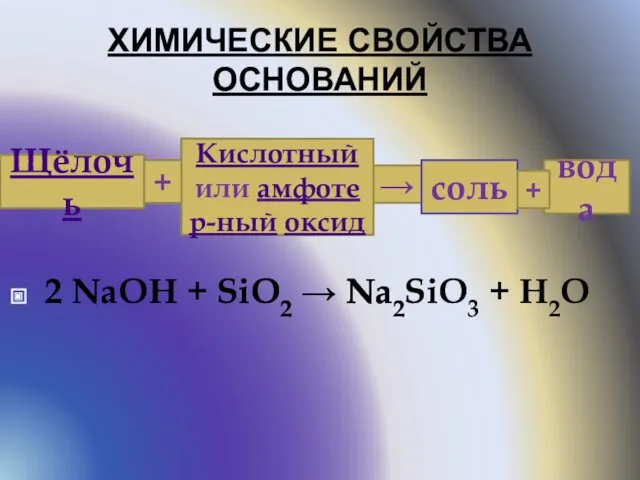
- 7. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 2 NaOH + SiO2 → Na2SiO3 + H2O Щёлочь + Кислотный или амфотер-ный
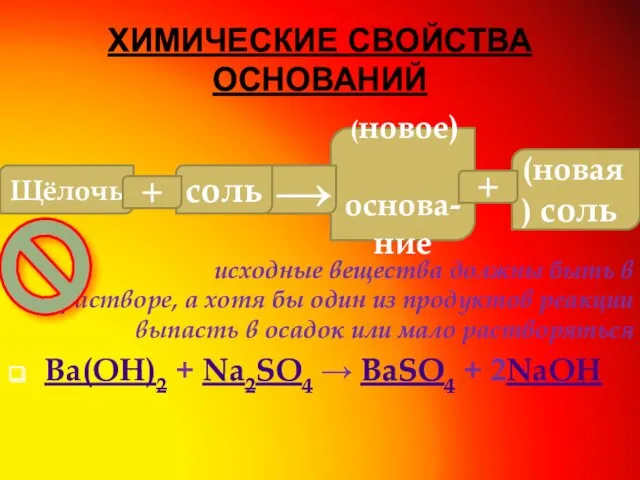
- 8. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ исходные вещества должны быть в растворе, а хотя бы один из продуктов реакции
- 9. Получение гидроксида меди (II) Сu2+ + 2OH- =Cu(OH)2↓
- 10. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ Слабые основания при нагревании разлагаются: t Cu(OH)2 CuO + H2O
- 11. ЛАКМУС МЕТИЛОВЫЙ ФЕНОЛФТА- ОРАНЖЕВЫЙ ЛЕИН ОКРАСКА ИНДИКАТОРОВ В ЩЕЛОЧНОЙ СРЕДЕ
- 12. ОКРАСКА ФЕНОЛФТАЛЕИНА ГИДРОКСИДОМ НАТРИЯ
- 13. ПРИМЕНЕНИЕ ЩЕЛОЧЕЙ
- 15. Скачать презентацию










 Удивительные свойства воды
Удивительные свойства воды Органические кислоты и основания. Лекция 6
Органические кислоты и основания. Лекция 6 Жиры. Мыла. СМС. 10 класс
Жиры. Мыла. СМС. 10 класс Контроль качества лекарственных средств производных спиртов и альдегидов
Контроль качества лекарственных средств производных спиртов и альдегидов Комплексті қосылыстар және олардың биологиялық маңызы
Комплексті қосылыстар және олардың биологиялық маңызы Сильные и слабые электролиты. Кислотность среды. 9 класс
Сильные и слабые электролиты. Кислотность среды. 9 класс Углерод и его свойства
Углерод и его свойства Способи очищення води
Способи очищення води Вольтамперометрические методы анализа
Вольтамперометрические методы анализа Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды)
Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды) Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений
Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров Теория сплавов
Теория сплавов Определение качества нефтепродуктов (на примере бензинов и дизельного топлива)
Определение качества нефтепродуктов (на примере бензинов и дизельного топлива) CО2 sequestration in mining residues – probing heat effects associated to carbonation
CО2 sequestration in mining residues – probing heat effects associated to carbonation Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар
Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар Кремний және оның қосылыстары
Кремний және оның қосылыстары Эмпирические законы кристаллографии
Эмпирические законы кристаллографии Хроматографические методы в радиохимии
Хроматографические методы в радиохимии Ионная связь и степень окисления. 8 класс
Ионная связь и степень окисления. 8 класс Інгібіювання та регуляція ензимів
Інгібіювання та регуляція ензимів Нанокомпозттерді алу жолдары
Нанокомпозттерді алу жолдары Мінеральні добрива
Мінеральні добрива Амфотерные соединения
Амфотерные соединения Растительные индикаторы
Растительные индикаторы Амины
Амины Химические реакции
Химические реакции Теория строения химических соединений А. М. Бутлерова
Теория строения химических соединений А. М. Бутлерова