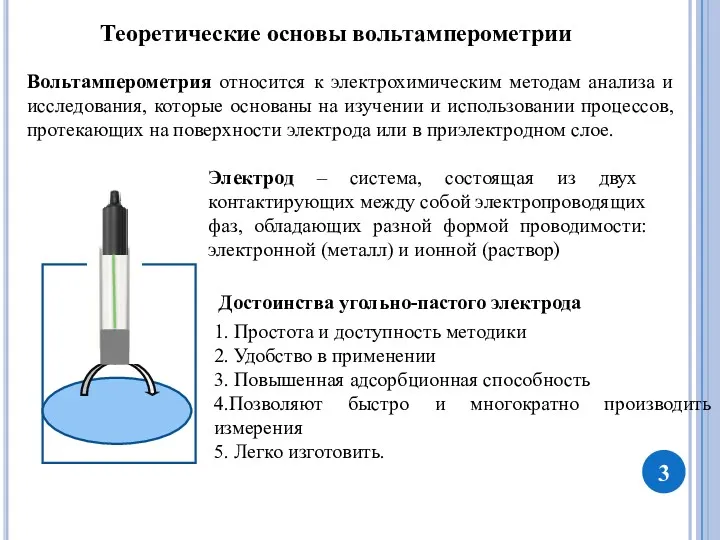
Используемые электроды в вольтамперометрии
К индикаторным (рабочим) относятся электроды, электрические характеристики которых
прямо или косвенно связаны с активностью анализируемых ионов. На этом электроде протекает требуемая электрохимическая реакция, благодаря чему мы получаем необходимую аналитическую информацию.
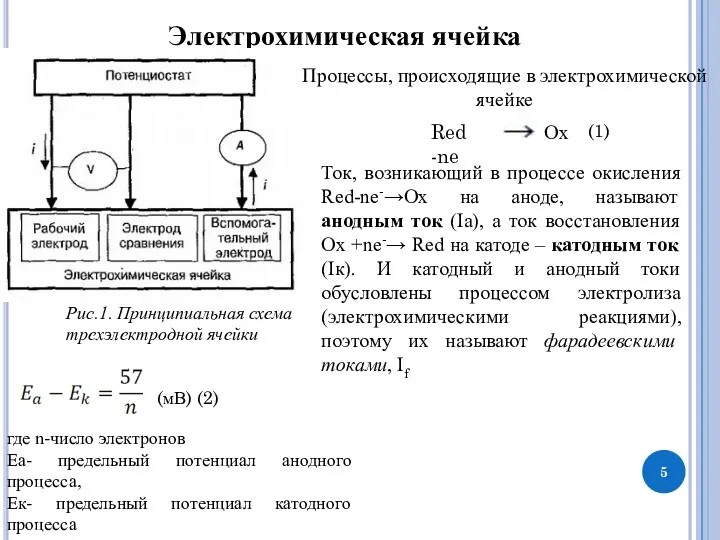
Вспомогательный электрод: инертный электрод с большой поверхностью, обычно платиновая сетка или титановая проволока; Данный электрод является противотоком между электродом сравнения и рабочим электродом. Без вспомогательного электрода электрод сравнения становится проводником тока, вследствие чего потенциал на нем может меняться.
Электрод сравнения – это электрод, относительно которого измеряется потенциал индикаторного электрода. Электрод сравнения обладает постоянным, не зависимым от компонентов среды, потенциалом.
Электрод сравнения: чаще всего используют хлоридсеребряный электрод
AgCl + e- =Ag + Cl-
, где Е0 = +0,22В
или каломельный электрод
Hg2Cl2 + 2e- = 2Hg + 2Cl-
, где Е0 = +0,24



 Биосенсорные системы
Биосенсорные системы Комплексные соединения
Комплексные соединения Тест по неорганической химии
Тест по неорганической химии Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель
Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель Полиамиды. Классификация по методу получения
Полиамиды. Классификация по методу получения Химические реакции
Химические реакции Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза
Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості Шестая группа элементов
Шестая группа элементов Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Кристаллизация
Кристаллизация Алкени (етиленові вуглеводні, олефіни)
Алкени (етиленові вуглеводні, олефіни) Химическая связь в кристаллах
Химическая связь в кристаллах Осадительное титрование
Осадительное титрование Дисперсні системи
Дисперсні системи Кислоты в свете теории электролитической диссоциации (ТЭД)
Кислоты в свете теории электролитической диссоциации (ТЭД) Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ)
Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ) Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций становление органической химии
становление органической химии Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Поширення металів у природі
Поширення металів у природі Воспламенение (зажигание) газовых смесей
Воспламенение (зажигание) газовых смесей Химическая связь
Химическая связь Материаловедение и технология обработки материалов
Материаловедение и технология обработки материалов Товары бытовой химии
Товары бытовой химии Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Катализ кислотами и основаниями. Лекция 3
Катализ кислотами и основаниями. Лекция 3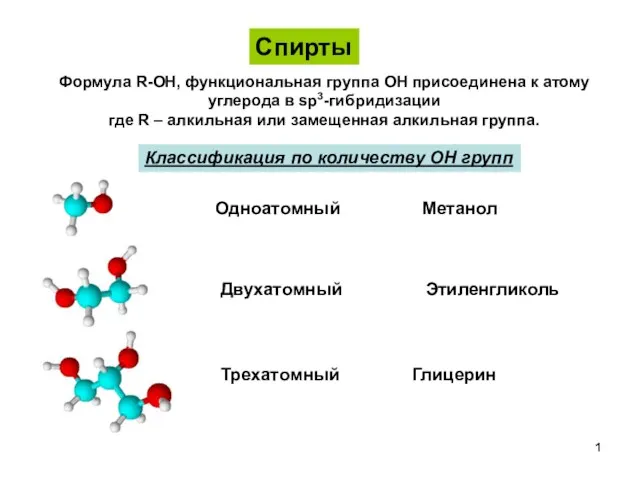 Спирты, фенолы, простые эфиры
Спирты, фенолы, простые эфиры