Содержание
- 2. Глинка Н.Л. Общая химия. – М., КНОРУС, 2009. Коровин Н.В. Общая химия. – М., ВШ, 2006.
- 3. Тема: Строение атома и Периодический закон Д.И. Менделеева 1. Современные квантово-механические представления о строении атома. 2.
- 4. 1. Современные квантово-механические представления о строении атома Учение о строении вещества является основным в системе знаний
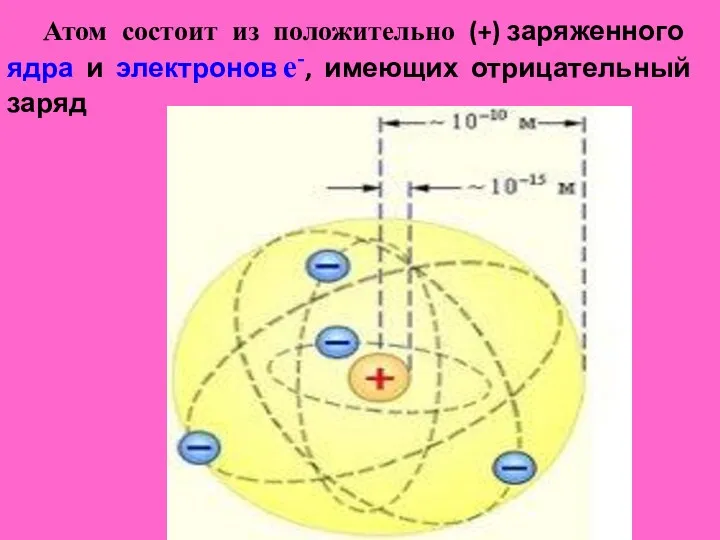
- 5. Атом состоит из положительно (+) заряженного ядра и электронов е-, имеющих отрицательный заряд
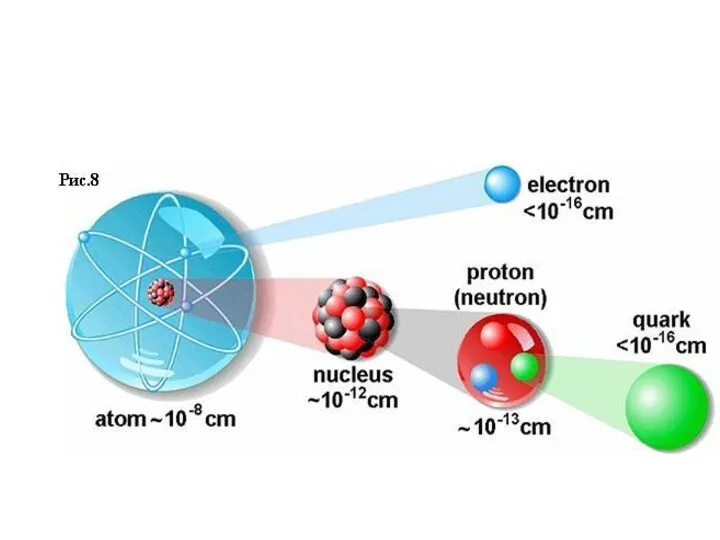
- 6. Вся масса атома сосредоточена в ядре, образован-ного протонами p+ (частицы с зарядом +1,60 ∙ 10-19 Кл
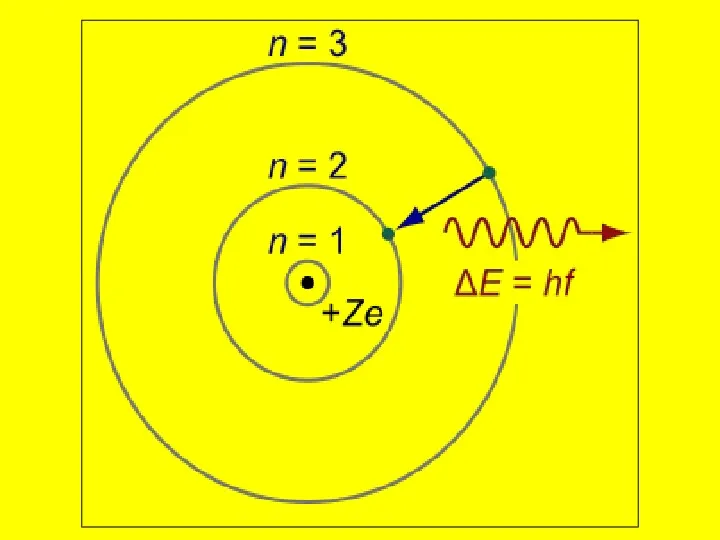
- 8. Данная модель не укладывалась в рамки класси-ческой физики, т.к. вращающийся по орбите электрон должен терять энергию.
- 10. В химических превращениях масса и заряд ядра не меняются, поэтому на них базируется электронная структура атома.
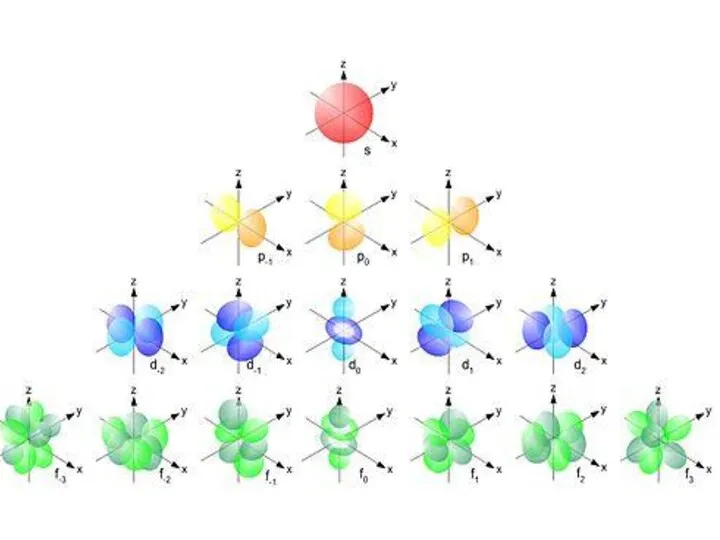
- 11. Пространство вокруг ядра, в котором может нахо-диться е- , называется орбиталью. В соответствии с дискретностью энергии
- 12. В реально существующих атомах электронами могут быть заполнены 6 уровней, 7-ой заполнен частично (табл.). Орбитальное квантовое
- 14. 3. Магнитное квантовое число ml. Подуровни также делятся на атомные орбитали АО, обозначаемые квантовым числом ml.
- 15. 3 первых квантовых числа характеризуют вращение электронов вокруг ядра атома (отсюда название Планетарная модель атома Резерфорда),
- 16. 2. Правила квантовой механики Состояние е- в атоме определяется набором 4-х квантовых чисел. Подобно любой системе,
- 17. На одной АО по принципу Паули не может быть больше 2-х электронов (е- на одной АО
- 18. 2) Правило Гунда. Заполнение электронами АО одного подуровня происходит таким образом, чтобы суммарный спин (по модулю)
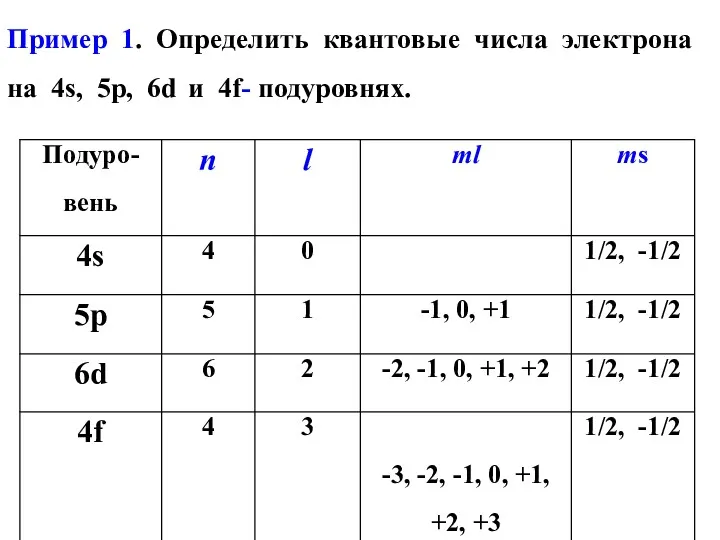
- 19. Пример 1. Определить квантовые числа электрона на 4s, 5р, 6d и 4f- подуровнях.
- 20. Электронную структуру атома принято записывать двумя квантовыми числами в виде nl. Число электронов на подуровне обозначается
- 21. 3) Правила Клечковского (принцип наименьшей энергии атома) устанавливают последовательность заполнения электронами энергетических подуров-ней в зависимости от
- 22. (n – 1)d4 ns2 → (n – 1)d5 ns1 (n – 1)d9 ns2 → (n –
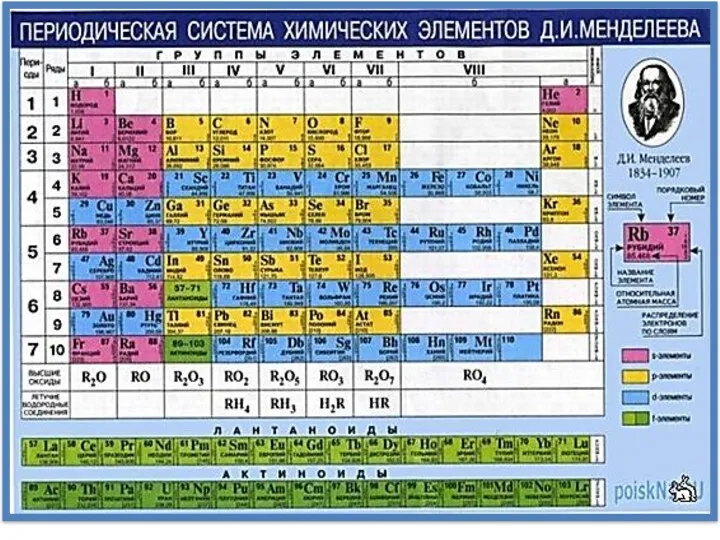
- 24. Номер периода совпадает со значением главного квантового числа n внешнего уровня. Каждый период начинается с s-
- 25. Количество элементов в периоде: χчетн = (N + 2)2/2; χнечетн = (N + 1)2/2, N –
- 26. Из электронной формулы атома легко определить валентные электроны и орбитали: им соответству-ют подуровни с максимальным значением
- 27. Металлы - это элементы, способные отдавать электроны, превращаясь в положительно (+) заряженный ион, проявляют восстановительные свойства.
- 28. Потенциал ионизации I - наименьшее значение энергии, необходимое для отрыва одного электрона от атома. Эта энергия
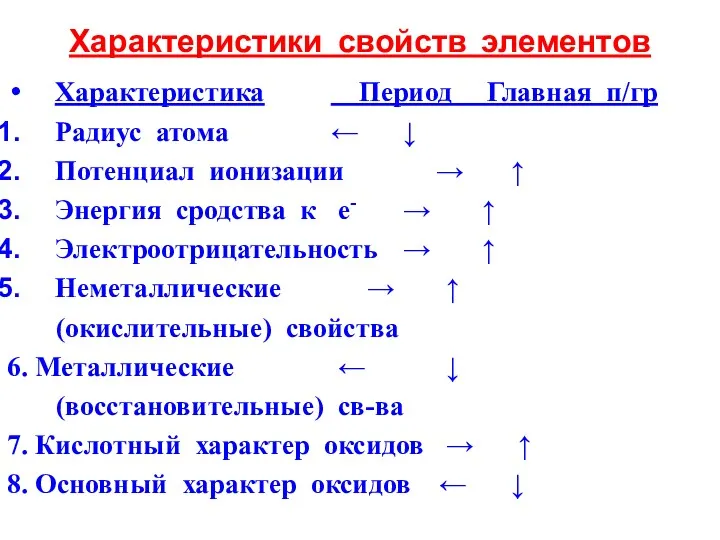
- 29. Характеристики свойств элементов Характеристика Период Главная п/гр Радиус атома ← ↓ Потенциал ионизации → ↑ Энергия
- 30. Изменение кислотно-основных свойств гидроксидов: (3-ий период): NaOH (щел) → Mg(OH)2 (осн) → Al(OH)3 (амфот. гидроксид) →
- 32. Скачать презентацию






















 Реакции ионного обмена. Ионное произведение воды. Водородный показатель. Индикаторы
Реакции ионного обмена. Ионное произведение воды. Водородный показатель. Индикаторы Белки. Строение
Белки. Строение Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Технология промышленных газов
Технология промышленных газов Строение электронных оболочек атомов
Строение электронных оболочек атомов Йод. Химические свойства
Йод. Химические свойства Происхождение химических элементов
Происхождение химических элементов Решение задач по теме Растворы
Решение задач по теме Растворы Хінони
Хінони Оксиды, их классификация и свойства
Оксиды, их классификация и свойства Обратимые реакции. Химическое равновесие. Смещение равновесия
Обратимые реакции. Химическое равновесие. Смещение равновесия Термический анализ
Термический анализ Узагальнення й систематизація знань з теми Початкові хімічні поняття (1 частина)
Узагальнення й систематизація знань з теми Початкові хімічні поняття (1 частина) СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ
СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ Калийные Удобрения
Калийные Удобрения Мембранное материаловедение. Топливные элементы
Мембранное материаловедение. Топливные элементы Химическая связь. Кристаллические решетки. (Лекция 2.2)
Химическая связь. Кристаллические решетки. (Лекция 2.2) Алкены. Номенклатура. Строение молекулы
Алкены. Номенклатура. Строение молекулы Классы неорганических веществ. Классификация неорганических веществ
Классы неорганических веществ. Классификация неорганических веществ Тепловой эффект химических реакций
Тепловой эффект химических реакций Химия в быту
Химия в быту Озоновый слой. Механизмы образования и разрушения
Озоновый слой. Механизмы образования и разрушения Elements of group 2 (IIA)
Elements of group 2 (IIA) Методы разделения и очистки биомолекул. Ультрацентрифугирование (седиментация)
Методы разделения и очистки биомолекул. Ультрацентрифугирование (седиментация) Сероводород. Сульфиды
Сероводород. Сульфиды АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ.
АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ. Тема. Водородная связь
Тема. Водородная связь Химическая термодинамика
Химическая термодинамика