Содержание
- 2. Какие из химических реакций являются обратимыми? 1. NaOH + HCl ? NaCl + H2O 2. N2
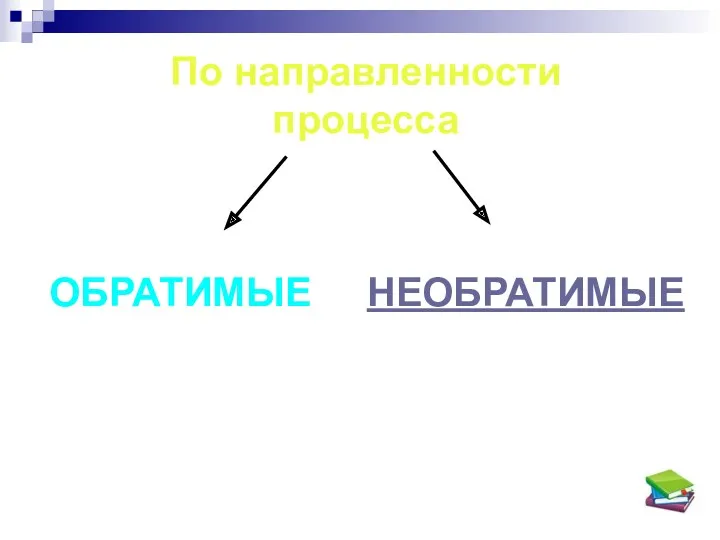
- 3. По направленности процесса ОБРАТИМЫЕ НЕОБРАТИМЫЕ
- 4. НЕОБРАТИМЫЕ РЕАКЦИИ – ЭТО РЕАКЦИИ, ПРОТЕКАЮЩИЕ В ДАННЫХ УСЛОВИЯХ ТОЛЬКО В ОДНОМ НАПРАВЛЕНИИ. К ним можно
- 5. Обратимые реакции – это реакции, протекающие в данных условиях одновременно в двух противоположных направлениях
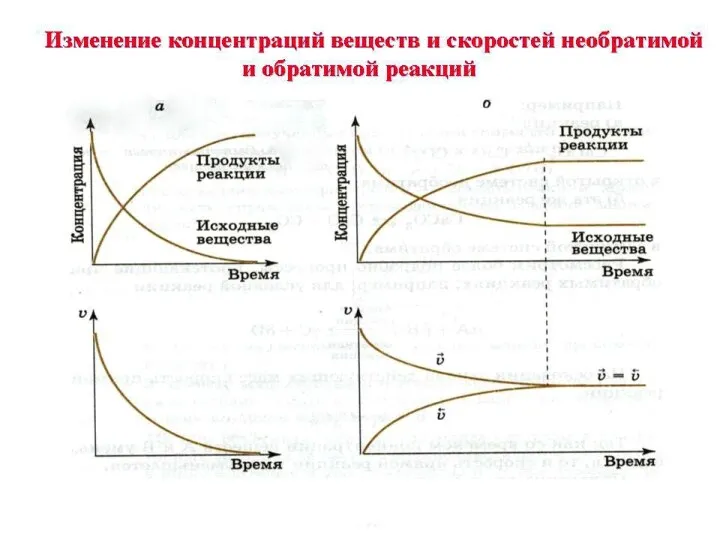
- 6. Равновеснные концентрации равновесие является динамическим, т.к. сколько молекул продукта прямой реакции образуется в единицу времени, столько
- 7. Обратимые реакции Н2+ I2 ⬄ 2НI 3H2 + N2 ⬄ 2NH3 + Q
- 9. N 2 + 3 H2 2 NH3 прямая обратная Состояние системы, при котором скорость прямой реакции
- 10. ПРИНЦИП ЛЕ ШАТЕЛЬЕ Если на систему, находящуюся в состоянии равновесия произвести внешнее воздействие (изменить давление, температуру,
- 11. Анри Луи Ле Шателье (8. 10. 1850 – 17. 09. 1936) Французский физикохимик и металловед, член
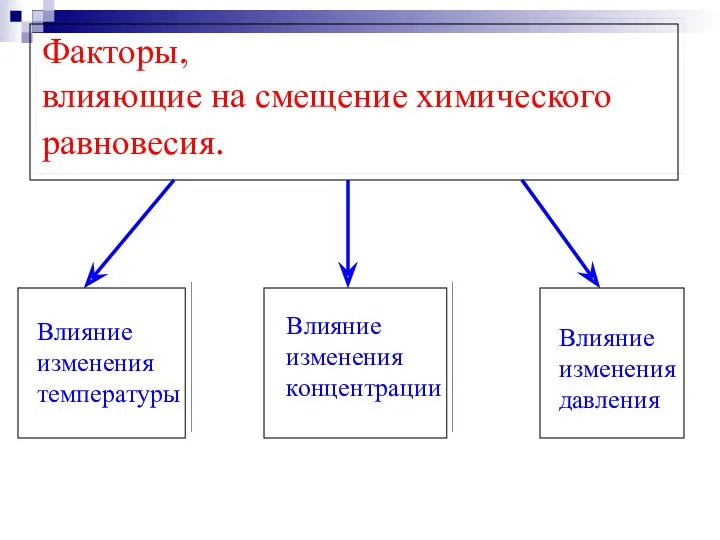
- 12. Факторы, влияющие на смещение химического равновесия.
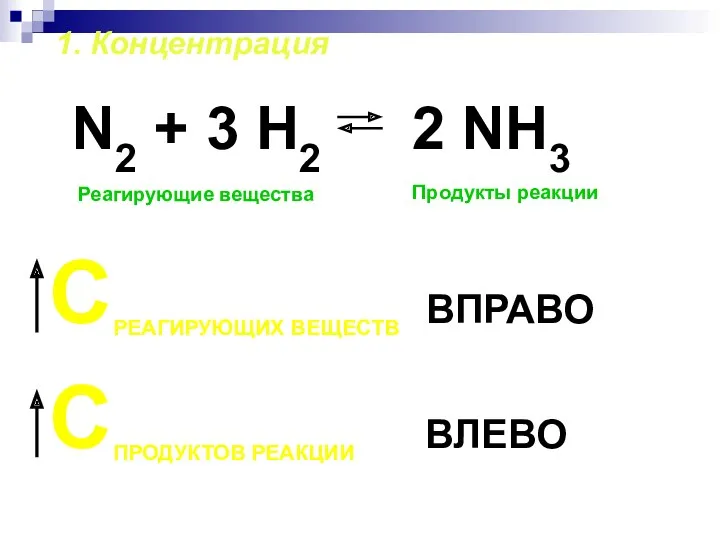
- 13. 1. Концентрация N2 + 3 H2 Реагирующие вещества Продукты реакции СРЕАГИРУЮЩИХ ВЕЩЕСТВ ВПРАВО СПРОДУКТОВ РЕАКЦИИ ВЛЕВО
- 14. 2. Температура эндотермическая реакция ( - Q ) экзотермическая реакция ( + Q ) N2 +
- 15. 3. Давление Давление применяется только для газов! N2(г) + 3 H2(г) 1V 3V 2V 4V Р
- 16. В какую сторону сместится равновесие в обратимом процессе, уравнение которого 2 NO(г) + O2(г) ⬄ 2
- 17. Как известно, в воздухе содержится 21% кислорода (по массе). Такое количество необходимо для поддержания естественного равновесия:
- 18. Принцип Ле Шателье широко используется в химической технологии для повышения выхода продукта производства. Согласуется ли процесс
- 19. Тесты I Репродуктивный уровень: тесты с альтернативными ответами, в которых испытуемый должен ответить да или нет.
- 20. тесты * Тесты с выбором одного правильного ответа 6. В какой системе при повышении давления химическое
- 22. Скачать презентацию















 Домашнее задание по теме Химические свойства альдегидов, их получение
Домашнее задание по теме Химические свойства альдегидов, их получение Степень окисления. Составление химических формул бинарных соединений. 8 класс
Степень окисления. Составление химических формул бинарных соединений. 8 класс Электролиз расплавов и водных растворов солей
Электролиз расплавов и водных растворов солей Алкены. Химические свойства алкенов
Алкены. Химические свойства алкенов Мыла и синтетические моющие средства
Мыла и синтетические моющие средства Ациклические углеводороды
Ациклические углеводороды Теория диаграмм состояния
Теория диаграмм состояния Застосування неметалів
Застосування неметалів Химические свойства алкенов
Химические свойства алкенов Коллоидные ПАВ
Коллоидные ПАВ Строение атома и атомного ядра. Изотопы
Строение атома и атомного ядра. Изотопы Полиэлектролиты. (Тема 3)
Полиэлектролиты. (Тема 3) Хімія запаху і смаку
Хімія запаху і смаку Синтез высокомолекулярных соединений
Синтез высокомолекулярных соединений Воздух и его свойства
Воздух и его свойства Химические свойства солей
Химические свойства солей Полисахариды. Крахмал
Полисахариды. Крахмал Полівінілхлорид
Полівінілхлорид Массовая доля химического элемента
Массовая доля химического элемента Химиялық кинетика және химиялық тепе-теңдік
Химиялық кинетика және химиялық тепе-теңдік Термическая переработка газов, нефтяных фракций и остатков нефтепереработки
Термическая переработка газов, нефтяных фракций и остатков нефтепереработки Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды
Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды Нуклеозиды. Нуклеиновые кислоты
Нуклеозиды. Нуклеиновые кислоты Алюминий. Строение и свойство атомов
Алюминий. Строение и свойство атомов Галогены. Свойства галогенов
Галогены. Свойства галогенов Борьба с биологической коррозией
Борьба с биологической коррозией Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции
Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год
Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год