Содержание
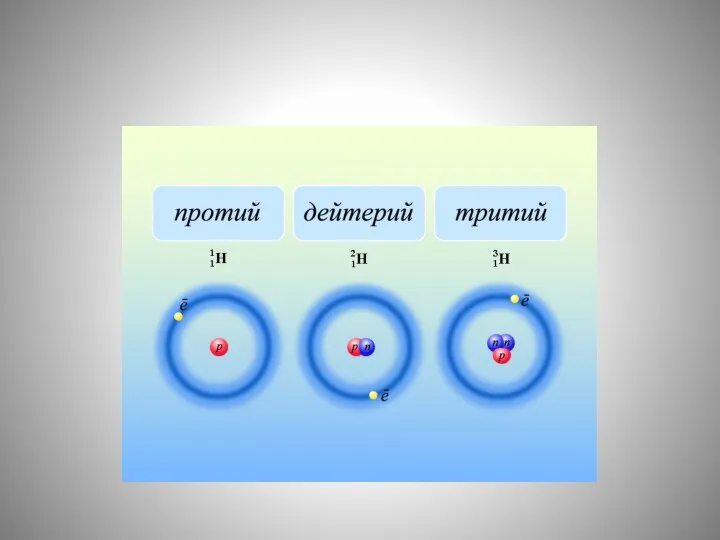
- 11. Название «изотопы» было предложено в 1912 английским радиохимиком Фредериком Содди, который образовал его из двух греческих
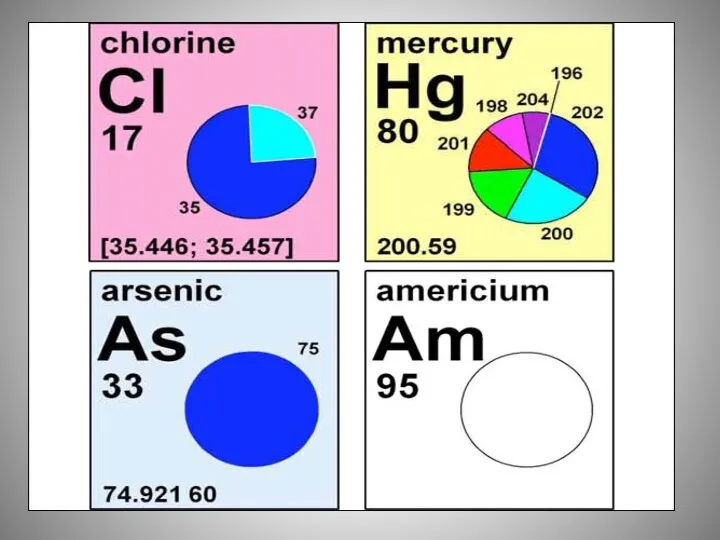
- 15. Наибольшее количество изотопов (по 36 у каждого) у ксенона (Xe), открыт в 1898 г. Рамзаем и
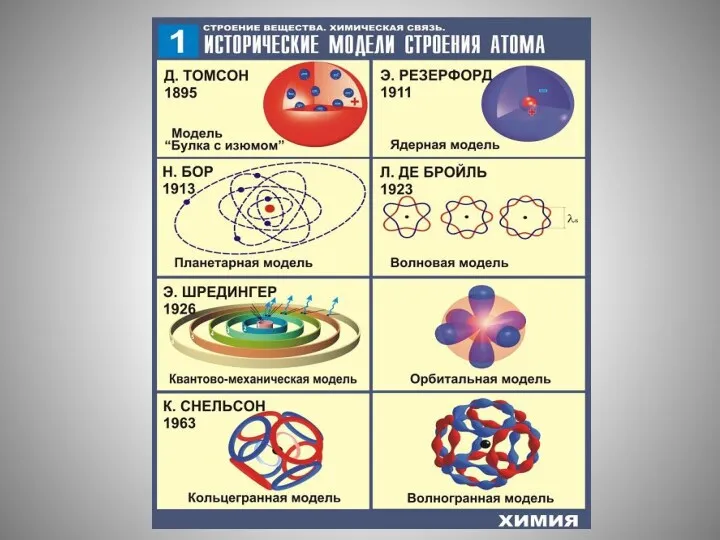
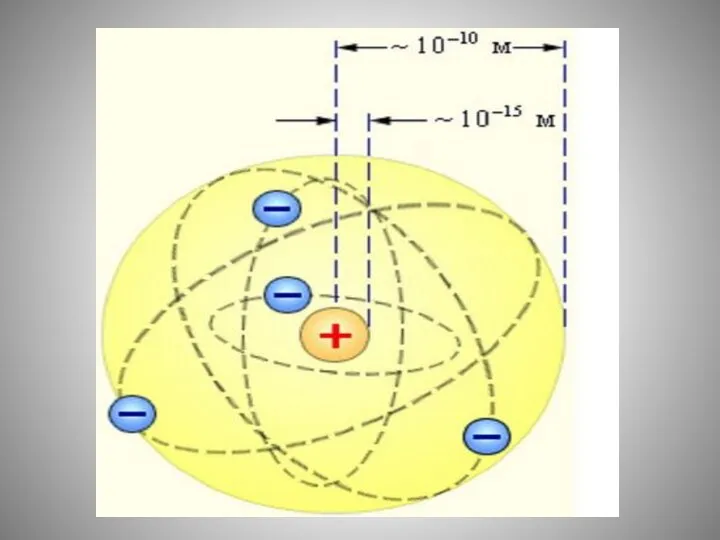
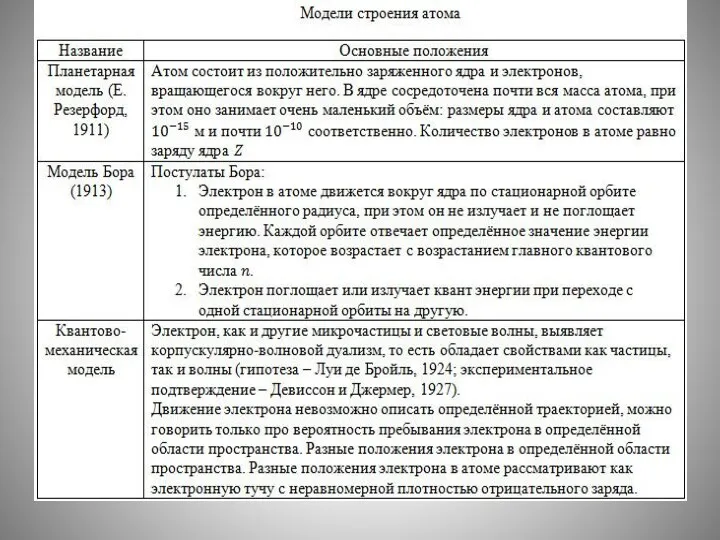
- 17. Заряд ядра совпадает с порядковым номером элемента в периодической системе химических элементов Д. И. Менделеева. Протонное
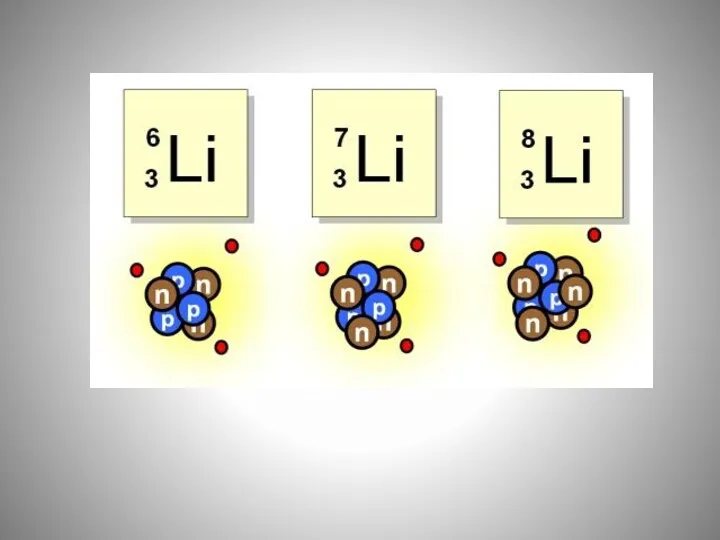
- 18. Изобары – атомы (нуклиды) разных химических элементов, обладающие одинаковыми массовыми числами. Например, массовым числом 40 обладают
- 19. Изотоны – ядра атомов химических элементов, обладающие разным количеством протонов и одинаковым количеством нейтронов. Примером изотонов
- 20. 1. Число протонов в атоме элемента, который находится в четвертом периоде и в главной подгруппе V
- 21. 2. Изотопы – это частицы, имеющие одинаковое число: а) протонов; б) нейтронов; в) нуклонов; г) электронов.
- 22. 3.Что одинаковое в атомах 126С и 146С? а) массовое число; б) число протонов; в) число электронов;
- 23. 4. Чему равен заряд ядра атома натрия? а) 0; б) +1; в) +11; г) +23.
- 24. 5. Чему равен заряд ядра атома азота? а) 0; б) +7; в) +14; г) –1.
- 25. 6. Выберите атомы, в которых число протонов равно числу нейтронов: а) 2H; б) 11B; в) 16O;
- 26. 7. Cколько протонов и электронов содержит нитрит-ион? а) 46р, 46е; б) 23р, 24е; в) 23р, 23е;
- 27. 8. В природе существуют два стабильных изотопа водорода и три изотопа кислорода. Сколько разных стабильных молекул
- 29. Скачать презентацию




















 Катализ металлами. Лекция 3
Катализ металлами. Лекция 3 Амины. Анилин
Амины. Анилин Исследование процесса диффузии на примере движения частиц в жидкостях и газах
Исследование процесса диффузии на примере движения частиц в жидкостях и газах Пироксены. Группа пироксенов
Пироксены. Группа пироксенов Реакции элиминирование галогеналканов
Реакции элиминирование галогеналканов Свободное окисление и токсические формы кислорода
Свободное окисление и токсические формы кислорода Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019
Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019 Химические свойства алкенов
Химические свойства алкенов Фосфор и его соединения
Фосфор и его соединения Лужноземельні метали
Лужноземельні метали Создание слоев пористого кремния на p-Si
Создание слоев пористого кремния на p-Si Газоподібна і тверда фаза грунту. Методи аналізу зернового складу
Газоподібна і тверда фаза грунту. Методи аналізу зернового складу Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Вуглеводи прості і складні
Вуглеводи прості і складні Диазины. Общая характеристика диазинов
Диазины. Общая характеристика диазинов Практическая работа №2. Наблюдение за горящей свечой
Практическая работа №2. Наблюдение за горящей свечой Горные породы Крыма
Горные породы Крыма Основы термодинамики
Основы термодинамики Химическая связь
Химическая связь Тепловой эффект химических реакций
Тепловой эффект химических реакций Каучук
Каучук Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) 9 Амины
9 Амины Сучасні каталізатори у процесах нафтопереробки та нафтохімії
Сучасні каталізатори у процесах нафтопереробки та нафтохімії Парфюмерия. Основные химические элементы, производство
Парфюмерия. Основные химические элементы, производство Жескость воды
Жескость воды Каучук. Получение натурального каучука
Каучук. Получение натурального каучука Электрохимические методы
Электрохимические методы