Содержание
- 2. ЛИТЕРАТУРА
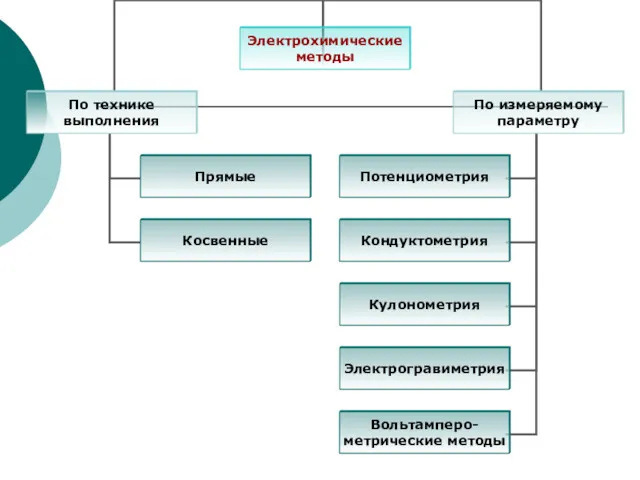
- 3. Теоретические основы электрохимических методов Электрохимические методы основаны на изучении и использовании процессов, протекающих на поверхности электрода
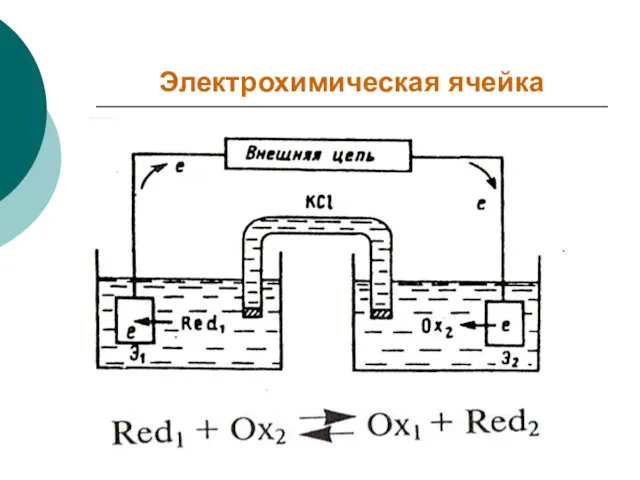
- 5. Электрохимическая ячейка
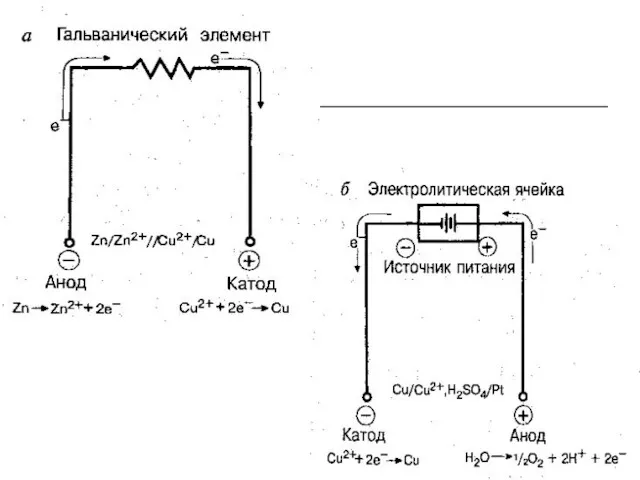
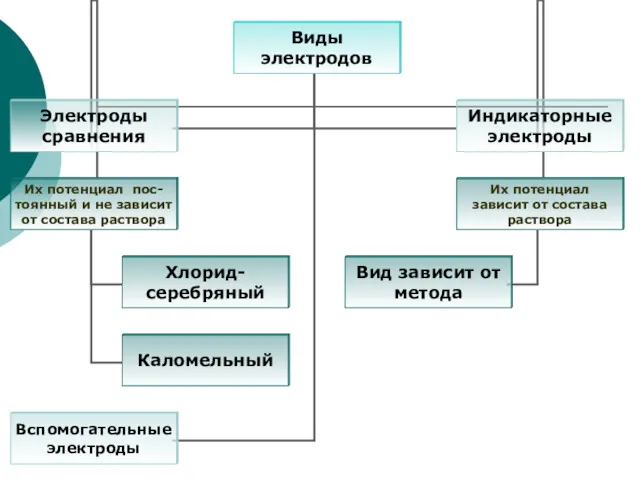
- 6. Электроды, используемые в электрохимии Электроды первого рода (обратимые относительно катиона, общего с материалом электрода): Металлические и
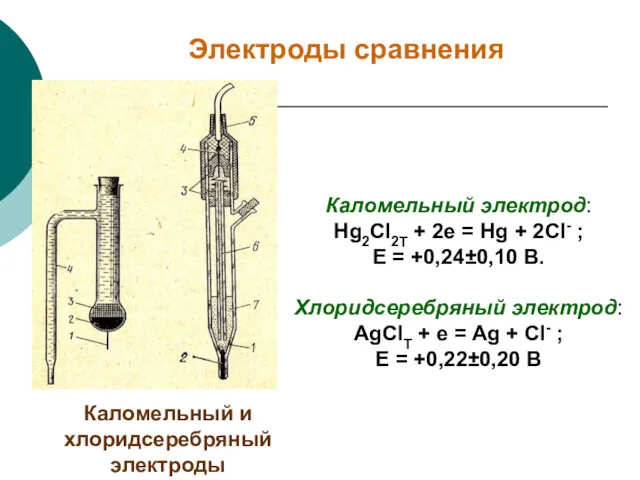
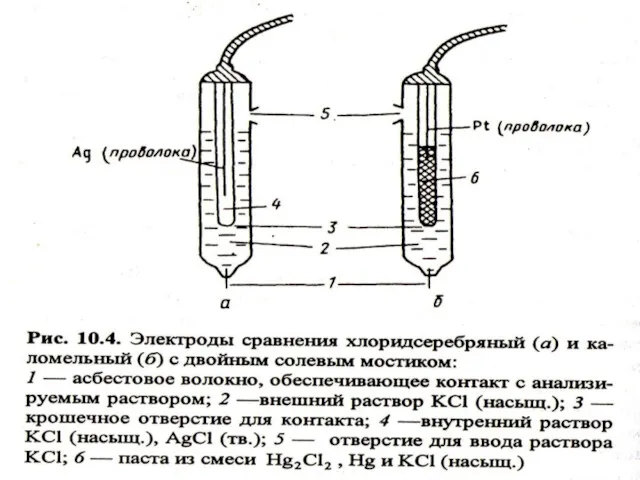
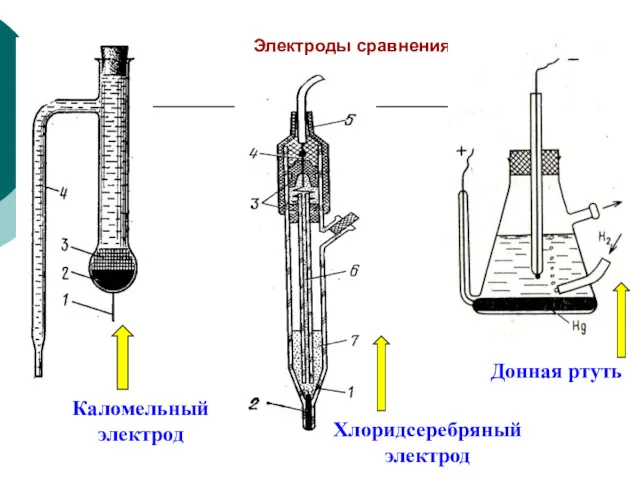
- 8. Электроды сравнения Каломельный и хлоридсеребряный электроды Каломельный электрод: Hg2Cl2Т + 2e = Hg + 2Cl- ;
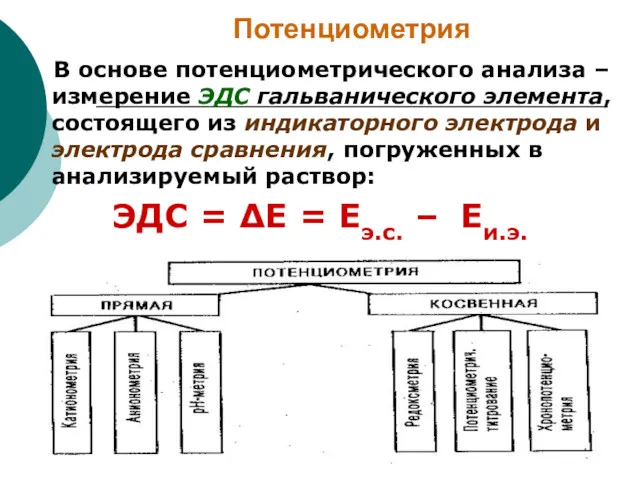
- 11. Потенциометрия В основе потенциометрического анализа – измерение ЭДС гальванического элемента, состоящего из индикаторного электрода и электрода
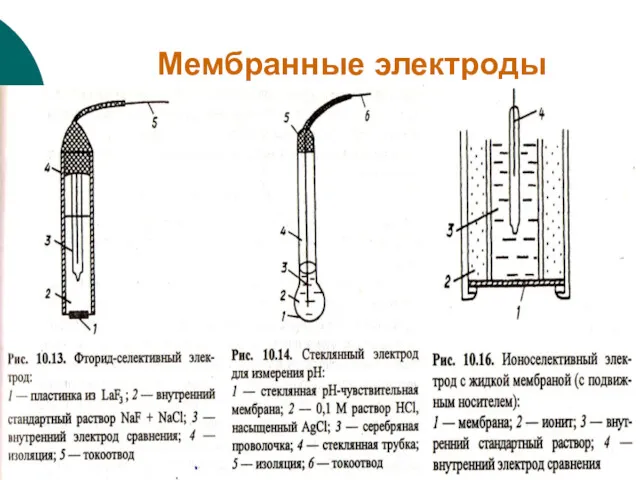
- 12. Индикаторные электроды Металлические: Активные (первого рода); Инертные (третьего рода). Ионоселективные (мембранные): С твердой мембраной (монокристалл, таблетка);
- 13. Мембранные электроды
- 14. Оборудование для потенциометрии
- 15. Прямая потенциометрия В основе метода – зависимость равновесного потенциала индикаторного электрода от концентрации иона в анализируемом
- 16. Ионометрия Построить калибровочный график и по нему определить основные характеристики ионоселективного электрода (см. далее рис.): Крутизна
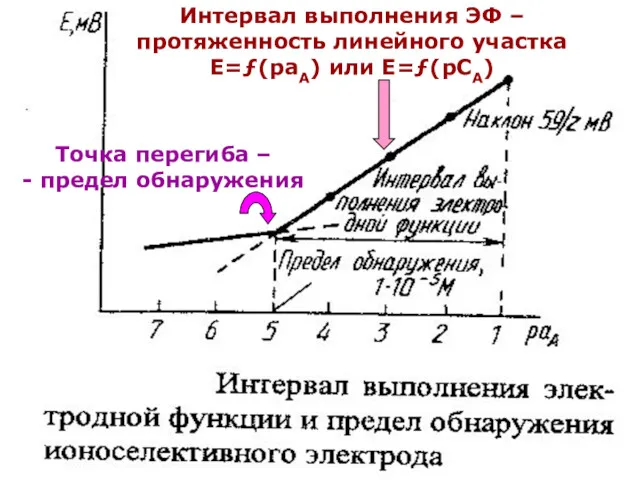
- 17. Интервал выполнения ЭФ – протяженность линейного участка Е=ƒ(раА) или Е=ƒ(рСА) Точка перегиба – - предел обнаружения
- 18. Способы определения концентрации Способ калибровочного графика После обработки экспериментальных данных МНК рассчитываем рХ: Рассчитав рХ, определяем
- 19. Потенциометрическое титрование Сущность метода – измерение потенциала индикаторного электрода (ЭДС) в ходе титрования для последующего определения
- 20. Установка потенциометрического титрования
- 21. Ручной способ титрования Сначала проводится ориентировочное титрование для нахождения объема титранта, приблизительно отвечающего КТТ. Для этой
- 22. Способы определения КТТ Расчетный способ N – число капель; Vк – объем капли; m – число
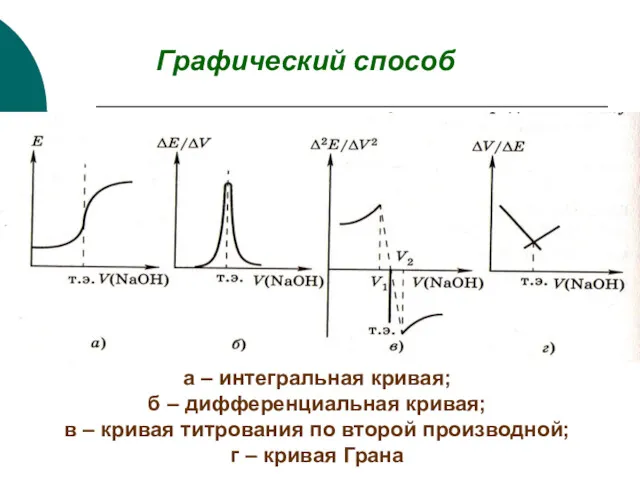
- 23. Графический способ а – интегральная кривая; б – дифференциальная кривая; в – кривая титрования по второй
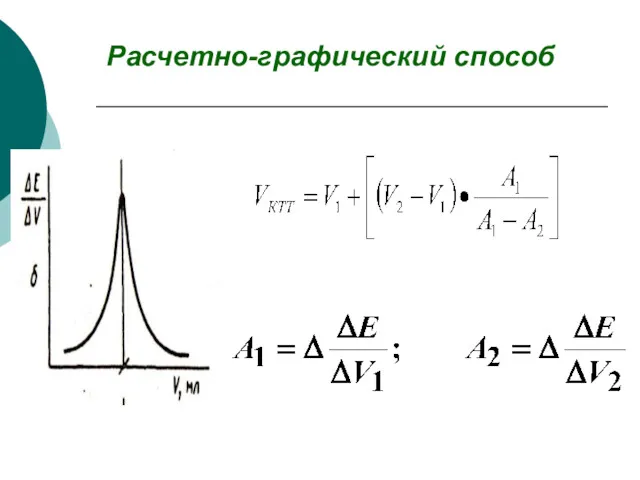
- 24. Расчетно-графический способ
- 25. Виды потенциометрического титрования Кислотно-основное (рН-селективный электрод). Комплексонометрическое (Ме-селективные электроды ). Окислительно-восстановительное (Pt-электрод). Осадительное (Ag-электрод; другие ионоселективные
- 26. Кондуктометрия Основана на измерении удельной электропроводности анализируемого раствора. Используется электролитическая ячейка с переменным током. Классификация методов:
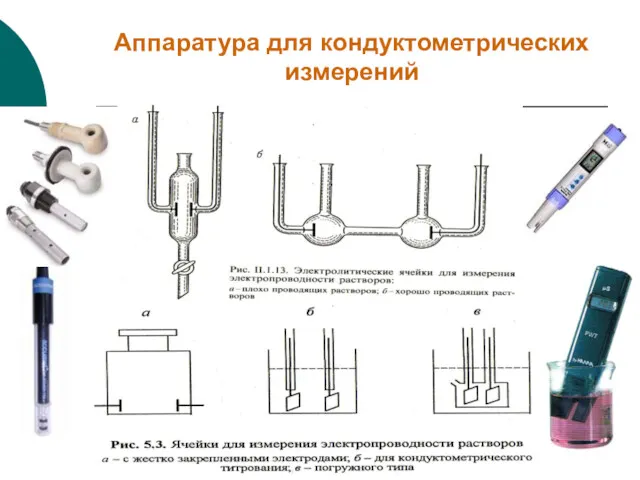
- 27. Аппаратура для кондуктометрических измерений
- 28. Аналитическая кондуктометрия
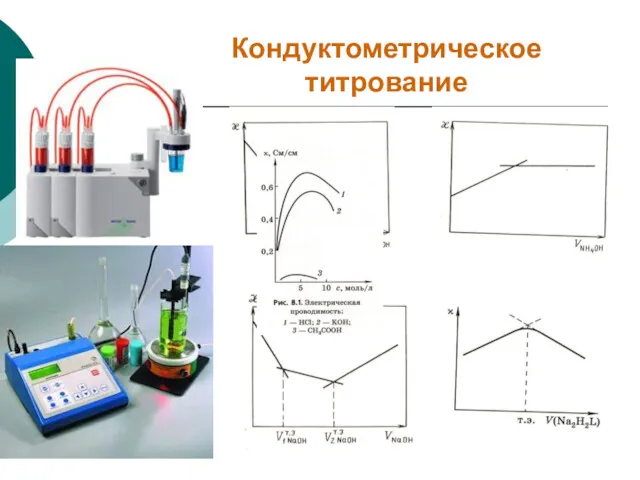
- 29. Кондуктометрическое титрование
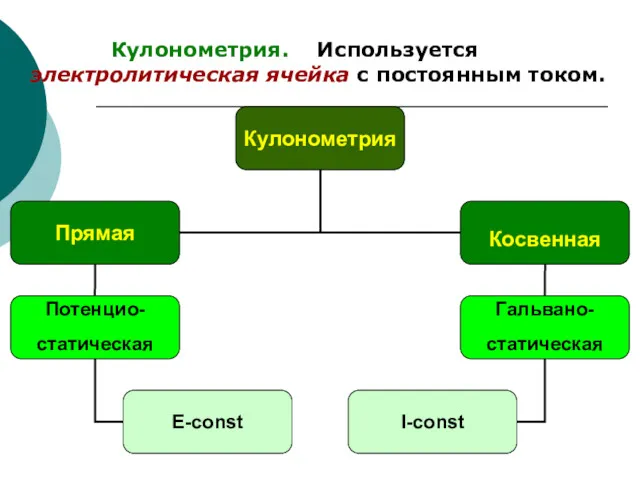
- 30. Кулонометрия Основана на измерении количества электричества, израсходованного на окисление или восстановление определяемого вещества. Используется электролитическая ячейка
- 31. Кулонометрия. Используется электролитическая ячейка с постоянным током.
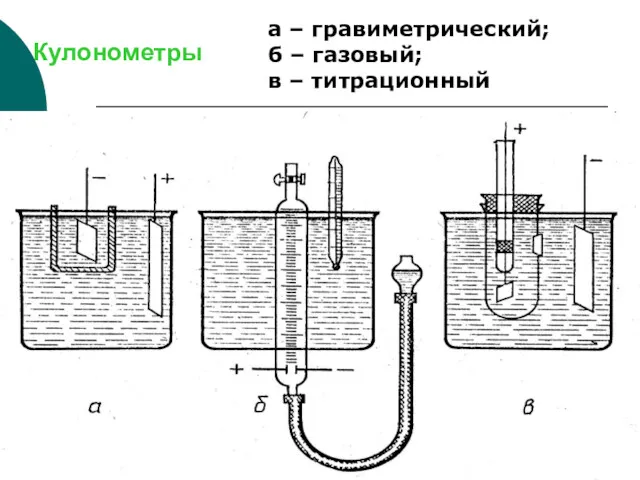
- 32. Кулонометры а – гравиметрический; б – газовый; в – титрационный
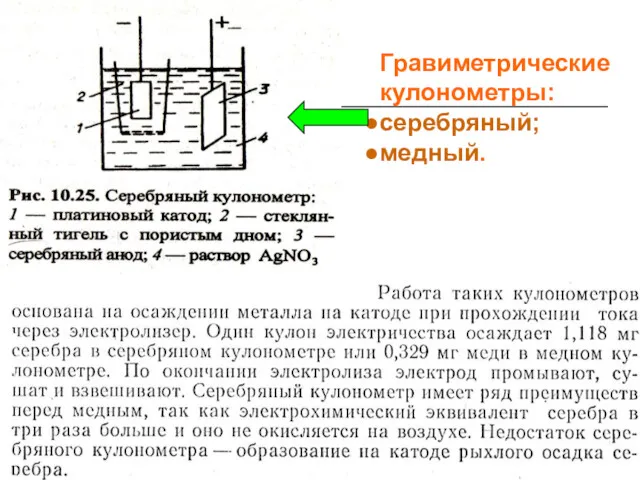
- 33. Гравиметрические кулонометры: серебряный; медный.
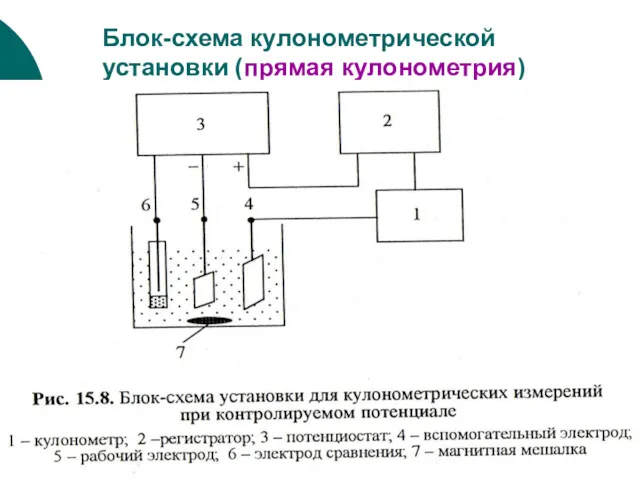
- 34. Блок-схема кулонометрической установки (прямая кулонометрия)
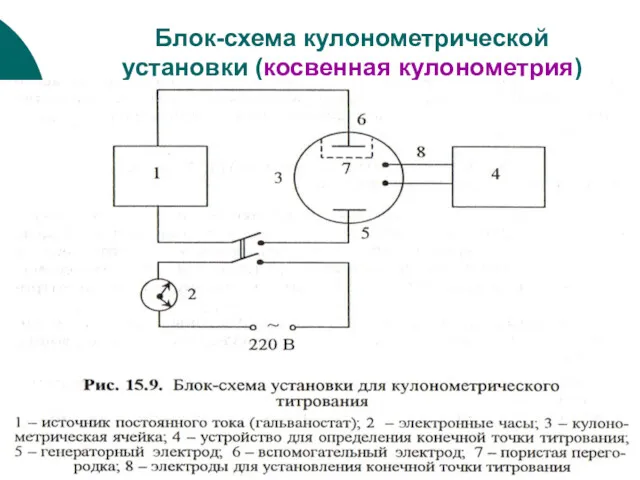
- 35. Блок-схема кулонометрической установки (косвенная кулонометрия)
- 36. Применение кулонометрии 1. Экспресс-анализаторы углерода и серы. 2. Газоанализаторы на СО; SO2; H2S; CO2; Cl2 и
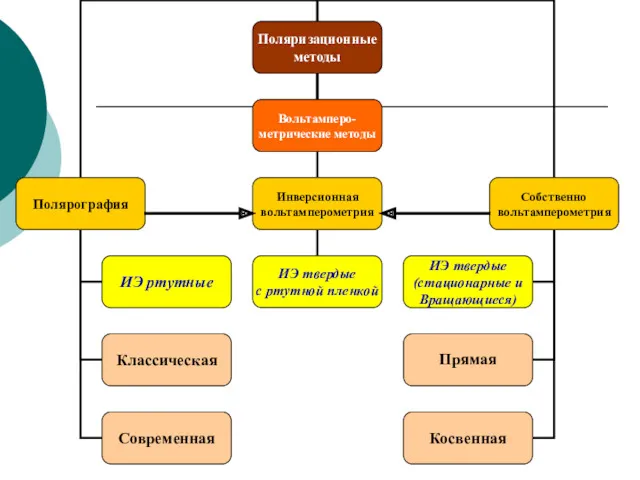
- 37. Вольтамперометрические методы Основаны на расшифровке поляризационных кривых (вольтамперограмм), полученных в электролитической ячейке с поляризующимся индикаторным электродом
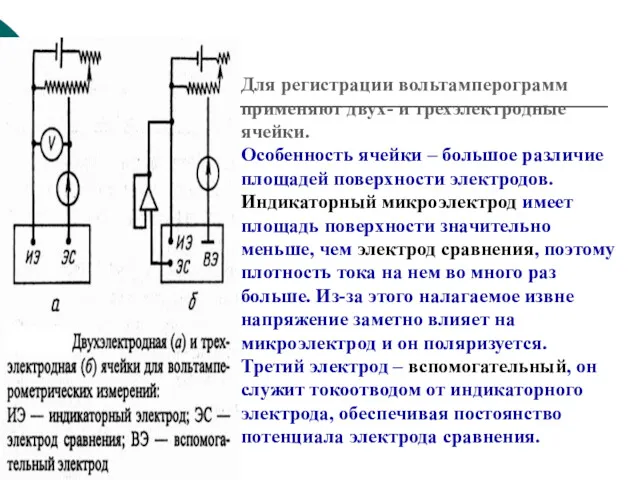
- 38. Для регистрации вольтамперограмм применяют двух- и трехэлектродные ячейки. Особенность ячейки – большое различие площадей поверхности электродов.
- 40. Электроды сравнения Донная ртуть Каломельный электрод Хлоридсеребряный электрод
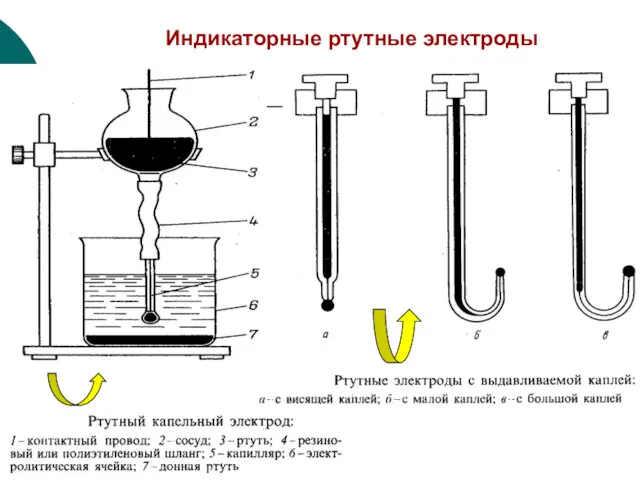
- 41. Индикаторные ртутные электроды
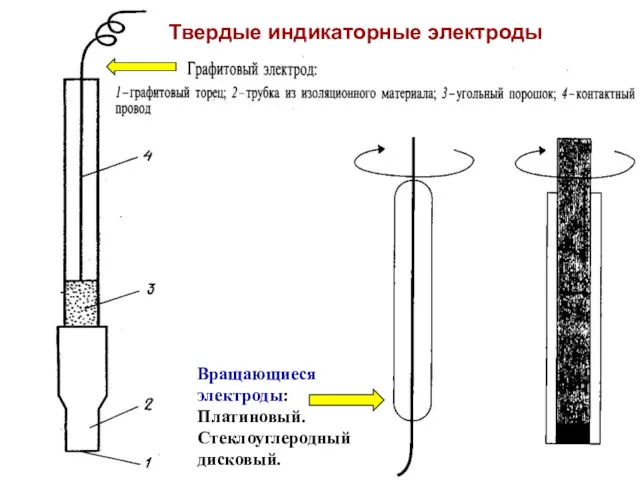
- 42. Вращающиеся электроды: Платиновый. Стеклоуглеродный дисковый. Твердые индикаторные электроды
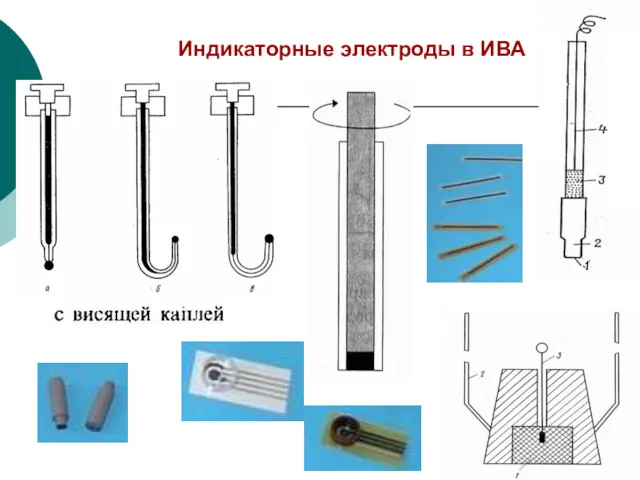
- 43. Индикаторные электроды в ИВА
- 45. Скачать презентацию


















 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей