Содержание
- 2. План 1. Основні поняття хімічної термодинаміки. Основные понятия химической термодинамики 2. Внутрішня енергія та робота. Перший
- 3. 4. Закон Гесса і наслідки з нього. Закон Гесса и его следствия. 5. Ентропія. Другий закон
- 4. Термодинаміка вивчає закони взаємних перетворень різних видів енергії, стану рівноваги та їх залежність від різних факторів.
- 5. Хімічна термодинаміка Химическая термодинамика дисципліна, що використовує математичний апарат та положення класичної термодинаміки для опису закономірностей
- 6. Термодинаміка вивчає Термодинамика изучает: переходи енергії з однієї форми в іншу, від однієї частини системи –
- 7. Термодинамічна система - сукупність тіл, що взаємодіють між собою і відмежовані від оточуючого середовища реальною або
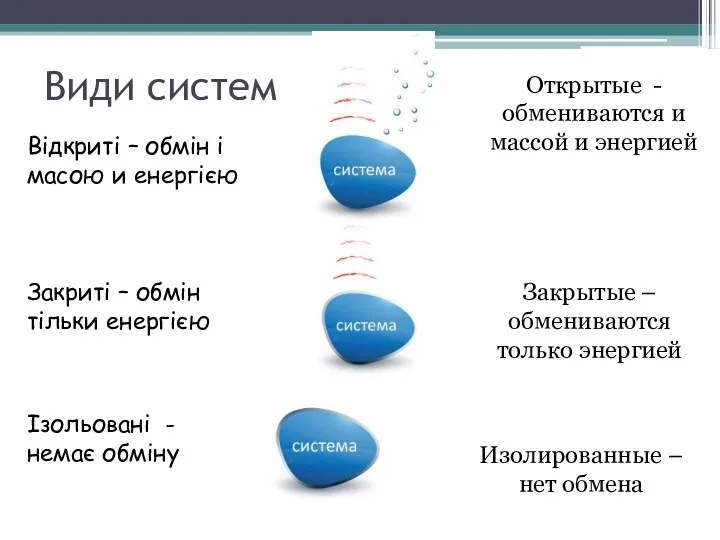
- 8. Види систем Відкриті – обмін і масою и енергією Закриті – обмін тільки енергією Ізольовані -
- 10. Фаза сукупність усіх однорідних частин системи, що мають однакові властивості і відокремлені від інших частин системи
- 11. Термодинамічні параметри стану – Термодинамические параметры состояния Параметри – це показники, що характеризують стан системи екстенсивні
- 12. Процес – Зміна одного чи кількох параметрів системи Процеси : Ізотермічні (при сталій температурі); Ізобарні (при
- 13. ФУНКЦІЇ СТАНУ (внутрішня енергія, ентальпія, ентропія, енергія Гіббса) Функции состояния (внутренняя энергия, энтальпия, энтропия, энергия Гибсса)
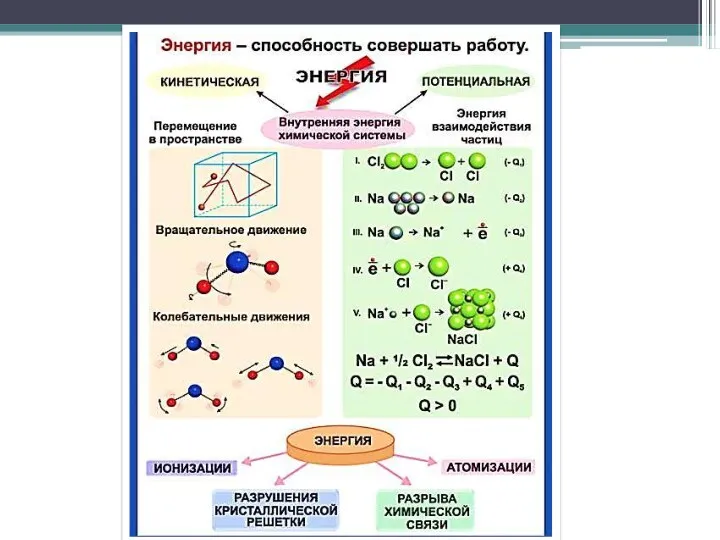
- 15. 2. Внутрішня енергія Внутренняя энергия ВНУТРІШНЯ ЕНЕРГІЯ системи (U) – загальний запас енергії всіх частинок системи
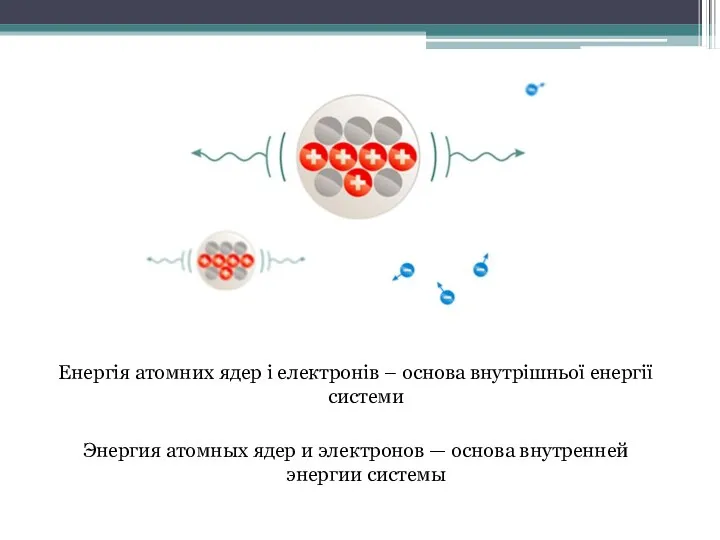
- 16. Енергія атомних ядер і електронів – основа внутрішньої енергії системи Энергия атомных ядер и электронов —
- 17. форми обміну енергією формы обмена энергией 1) Робота – спосіб передачі енергії пов’язаний зі зміною зовнішніх
- 18. 2) Теплота Q – спосіб передачі без змін зовнішніх параметрів (теплообмін). Форми передачи теплоти Теплота Q
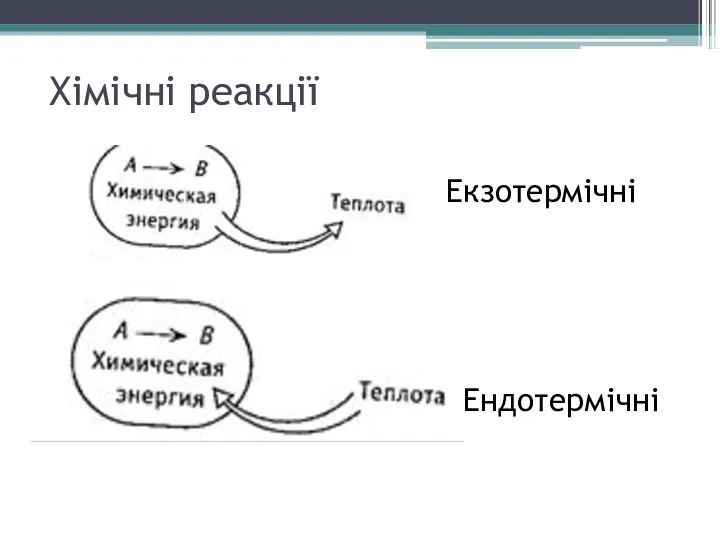
- 19. Хімічні реакції Екзотермічні Ендотермічні
- 20. Перший закон термодинаміки Первый закон термодиамики Теплота, яку отримує система витрачається на зміну внутрішньої енергії і
- 21. Ентальпія Н характеризує теплові ефекти процесів при постійному тиску. Фізичний смисл Н: якщо система оточена пружним
- 22. Стандартні умови стандартные условия Порівняння енергетичних ефектів різних процесів проводять для рівної кількості речовин, частіше 1
- 23. Стандартна ентальпія утворення стандартная энтальпия образования тепловий ефект реакції утворення 1 моля речовини з простих речовин
- 24. Стандартні ентальпії утворення простих речовин дорівнюють нулю. Стандартные энтальпии образования простых веществ равны нулю Проста речовина
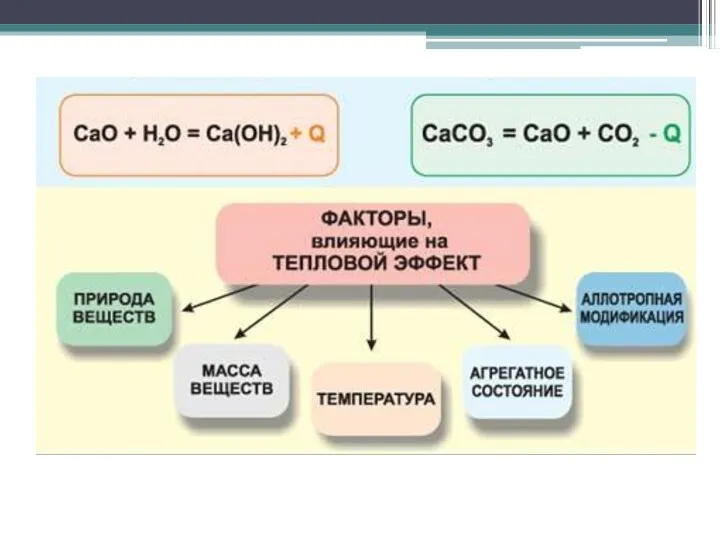
- 25. Ca(к) + C (т) + 3/2O2(г) = CaCO3(т) ΔH° = -1207 кдж/моль Рівняння хімічної реакції з
- 27. 3. Ентропія (S)- міра невпорядкованості, хаосу в системі. Энтропия (S) – мера беспорядка в системе Ентропія
- 28. Ентропія будь-якої речовини при стандартних умовах називається стандартною ентропією энтропия любого вещества при стандартных условиях –
- 29. ІІ закон термодинаміки Р. Клаузіус 1850 р. Будь-яка ізольована система представлена сама собі змінюється в напрямку
- 30. 4. Закон Гесса: Тепловий ефект залежить тільки від стану вихідних і кінцевих продуктів, і не залежить
- 31. Наслідки з закону Гесса следствия из закона Гесса Тепловий ефект будь-якої реакції можна розрахувати, знаючи энтальпії
- 32. У 1901 Гіббса було нагороджено - Медаллю Коплі Королівського товариства Лондона, за те, що він був
- 33. Для оцінки можливості протікання хімічної реакції було запропоновано ізобарно-ізотермічний потенціал G, який назвали енергією Гіббса. Δ
- 35. Скачать презентацию



























 Минералогия литофильных редких элементов. Барий и стронций
Минералогия литофильных редких элементов. Барий и стронций Спирт µндіру технологиясы
Спирт µндіру технологиясы Простые и сложные вещества
Простые и сложные вещества Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Полимеры. Протезы трахеи
Полимеры. Протезы трахеи Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс
Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем
Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем Облагораживание тяжелых нефтей и природных битумов
Облагораживание тяжелых нефтей и природных битумов Важнейшие минералы
Важнейшие минералы Крахмал. Физические свойства
Крахмал. Физические свойства Карбоновые кислоты. Строение
Карбоновые кислоты. Строение Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Валентность и степень окисления
Валентность и степень окисления Каменный уголь. Переработка и применение угля
Каменный уголь. Переработка и применение угля Чистые вещества и смеси
Чистые вещества и смеси Лихеоиндикация. Экологические аспекты переработки полимеров
Лихеоиндикация. Экологические аспекты переработки полимеров Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Свойства спирта и воды
Свойства спирта и воды Метаболизм углеводов
Метаболизм углеводов Коррозия металлов и способы защиты от коррозии
Коррозия металлов и способы защиты от коррозии Цеолиты. Свойства и область применения
Цеолиты. Свойства и область применения Теория строения химических соединений А. М. Бутлерова
Теория строения химических соединений А. М. Бутлерова Влияние состава вещества на эффективность таяния льда и замерзания водных растворов
Влияние состава вещества на эффективность таяния льда и замерзания водных растворов Использование методов проблемного обучения на уроках химии
Использование методов проблемного обучения на уроках химии Проведення полімеразної ланцюгової реакції з використанням діагностичних тест-систем
Проведення полімеразної ланцюгової реакції з використанням діагностичних тест-систем Валентность и степень окисления 8 класс
Валентность и степень окисления 8 класс Аминокислоты. Изомерия. Белки
Аминокислоты. Изомерия. Белки Лекция 3. Гидроксисоединения. Карбонильные соединения
Лекция 3. Гидроксисоединения. Карбонильные соединения