Содержание
- 2. КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ электронное строение атома кислорода
- 3. КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ электронное строение атома кислорода 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
- 4. 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
- 5. Атом кислорода имеет две неподелённые пары электронов, одну из которых он может обобществлять с кислотой Льюиса
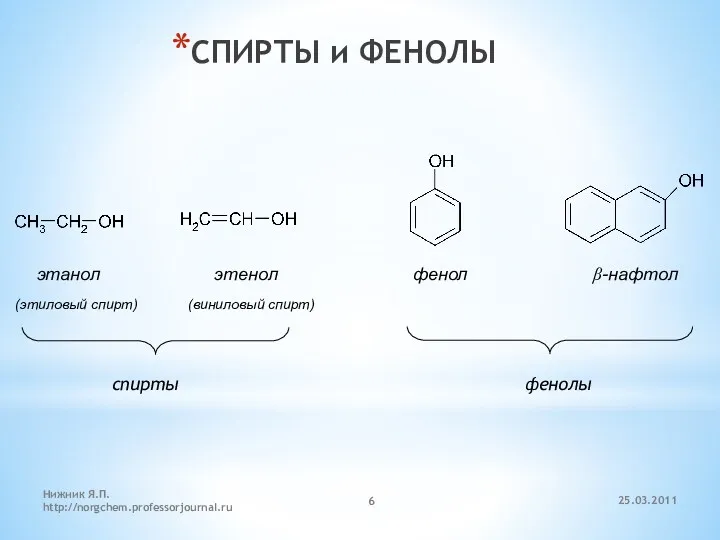
- 6. СПИРТЫ и ФЕНОЛЫ этанол этенол фенол β-нафтол (этиловый спирт) (виниловый спирт) спирты фенолы 25.03.2011 Нижник Я.П.
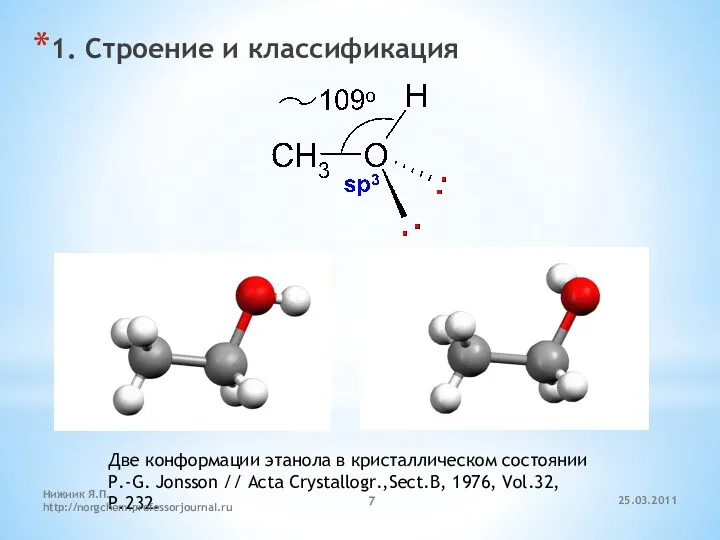
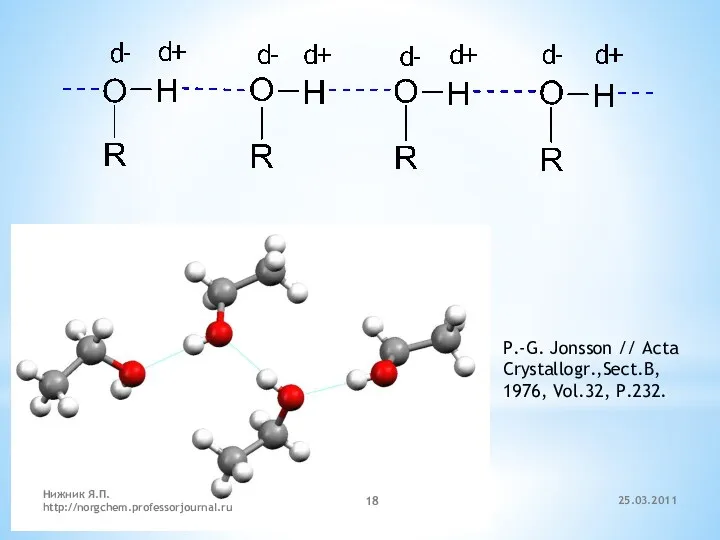
- 7. 1. Строение и классификация Две конформации этанола в кристаллическом состоянии P.-G. Jonsson // Acta Crystallogr.,Sect.B, 1976,
- 8. 1. Классификация спиртов по количеству гидроксильных групп 1). Одноатомные спирты (моноолы) 2). двухатомные спирты (диолы) этандиол-1,1
- 9. 3). Многоатомные спирты пропантриол-1,2,3 бутантетраол-1,2,3,4 (глицерин) (эритрит) 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
- 10. 2. Классификация по типу спиртового атома углерода 1). Первичные спирты. первичный бутиловый спирт (бутанол-1) 2). Вторичные
- 11. 2. Номенклатура 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
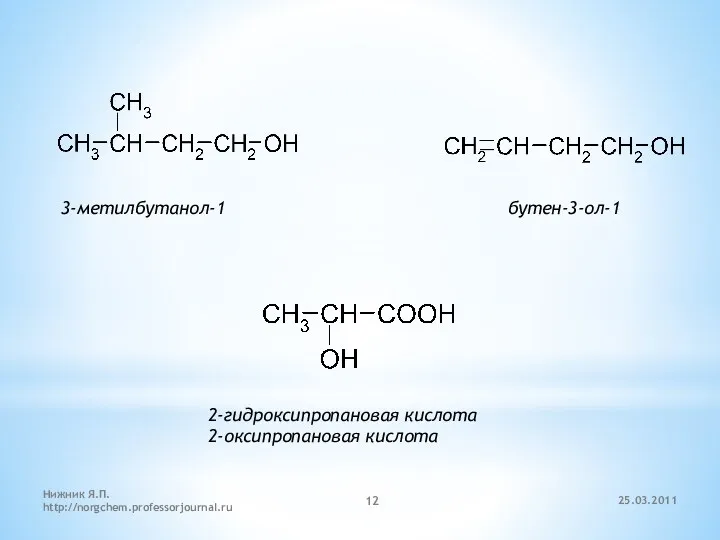
- 12. 3-метилбутанол-1 бутен-3-ол-1 2-гидроксипропановая кислота 2-оксипропановая кислота 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
- 13. 3. Изомерия 3.1. Cтруктурная изомерия 3.1. 1. Изомерия положения заместителей пентанол-1 пентанол-2 пентанол-3 3.1. 2. Изомерия
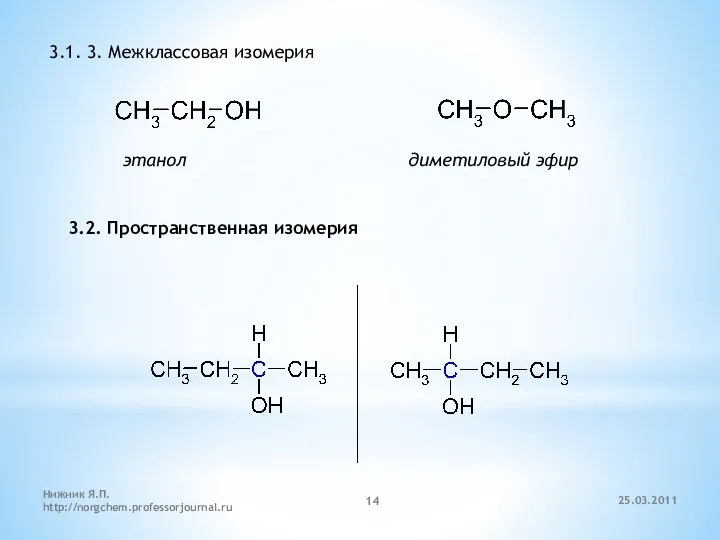
- 14. 3.1. 3. Межклассовая изомерия этанол диметиловый эфир 3.2. Пространственная изомерия 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
- 15. 4. Физические и биологические свойства Гидроксигруппа является сильно полярной группой, поэтому низшие спирты растворяются в воде
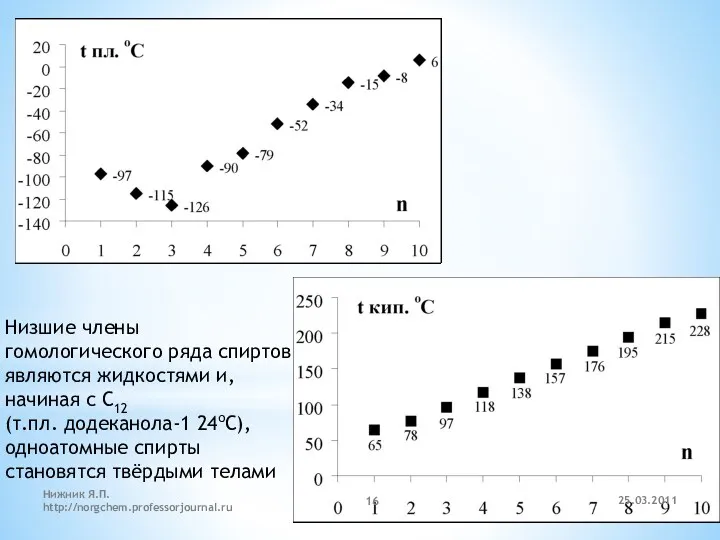
- 16. Низшие члены гомологического ряда спиртов являются жидкостями и, начиная с C12 (т.пл. додеканола-1 24оС), одноатомные спирты
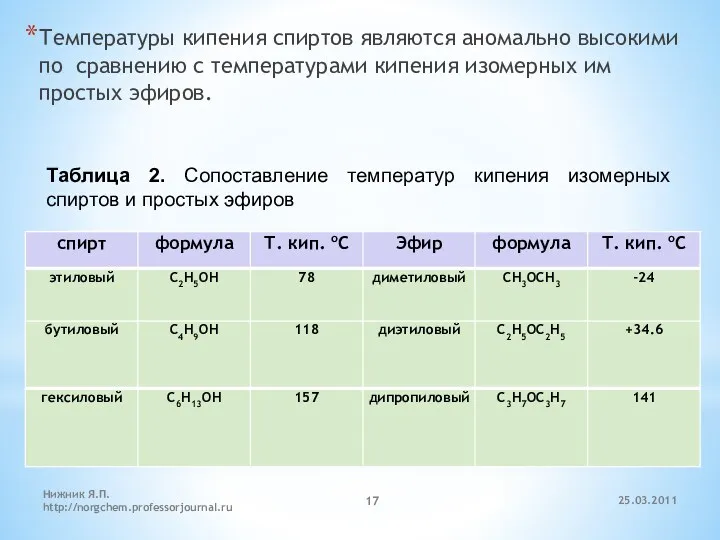
- 17. Температуры кипения спиртов являются аномально высокими по сравнению с температурами кипения изомерных им простых эфиров. Таблица
- 18. P.-G. Jonsson // Acta Crystallogr.,Sect.B, 1976, Vol.32, P.232. 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
- 19. Метиловый спирт считается самым ядовитым спиртом. Вызывает слепоту или смерть. http://photofile.ru/users/pratezgalavy/2175396/37069795/ 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
- 20. Токсическое действие метанола связано с угнетением центральной нервной системы, развитием тяжелого метаболического ацидоза, поражением сетчатки глаза
- 21. Этиловый спирт оказывает опьяняющее действие. “вино веселит сердце человека” (Псалом103:15) В высоких концентрациях этанол оказывает анестезирующее
- 22. 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
- 23. 5. Химические свойства 5.1. Кислотные свойства спиртов этоксид натрия 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
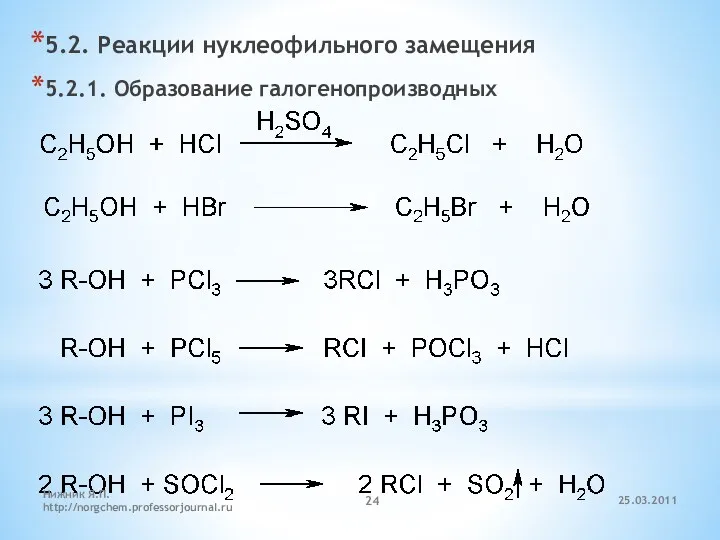
- 24. 5.2. Реакции нуклеофильного замещения 5.2.1. Образование галогенопроизводных 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
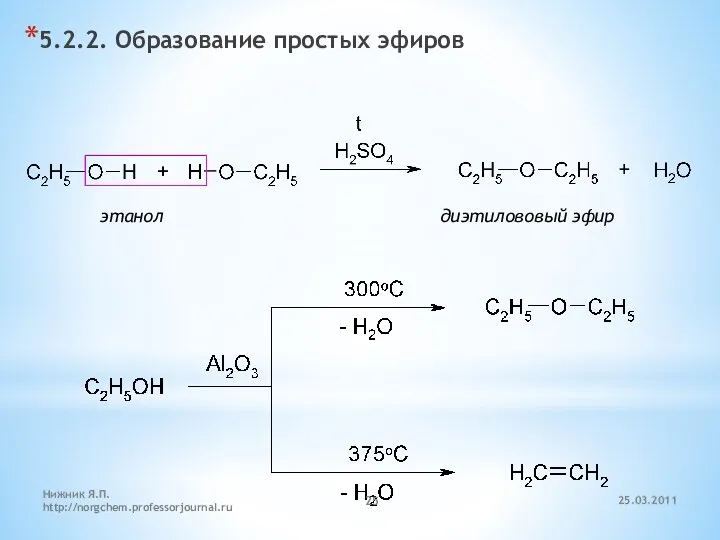
- 25. 5.2.2. Образование простых эфиров этанол диэтилововый эфир 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
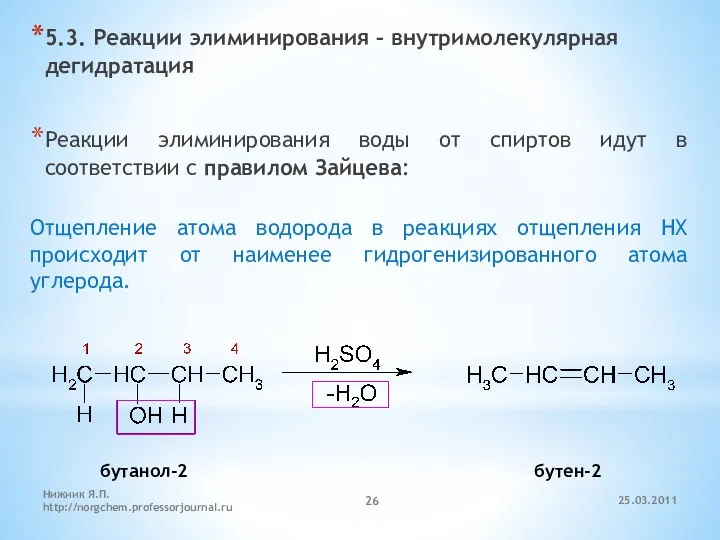
- 26. 5.3. Реакции элиминирования – внутримолекулярная дегидратация Реакции элиминирования воды от спиртов идут в соответствии с правилом
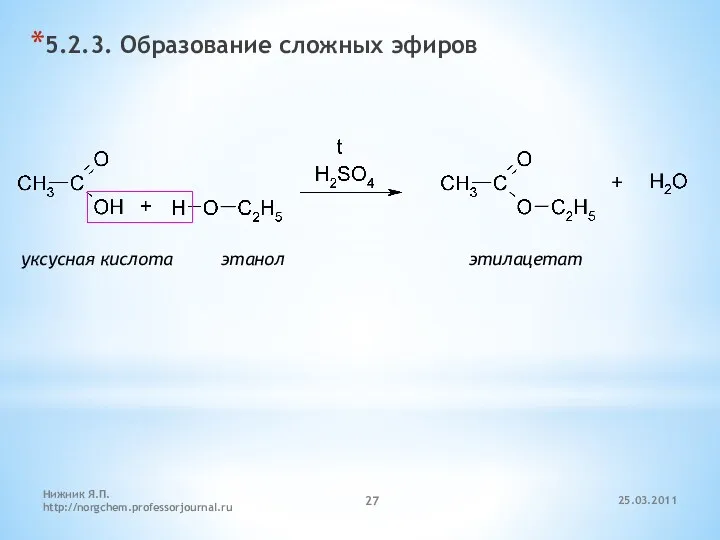
- 27. 5.2.3. Образование сложных эфиров уксусная кислота этанол этилацетат 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
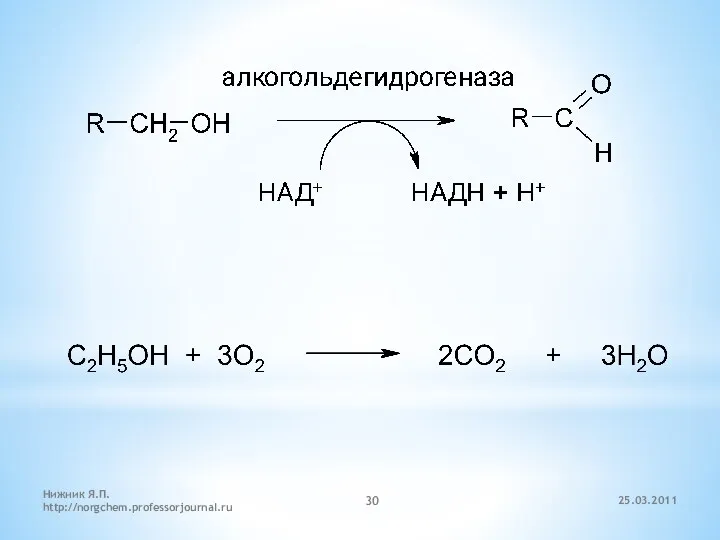
- 28. 5.3. Реакции окисления спиртов Мягкие окислители окисляют первичные спирты в альдегиды, а вторичные спирты в кетоны.
- 29. ретинол (витамин А) ретиналь первичный спирт альдегид карбоновая кислота вторичный спирт кетон 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
- 30. 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
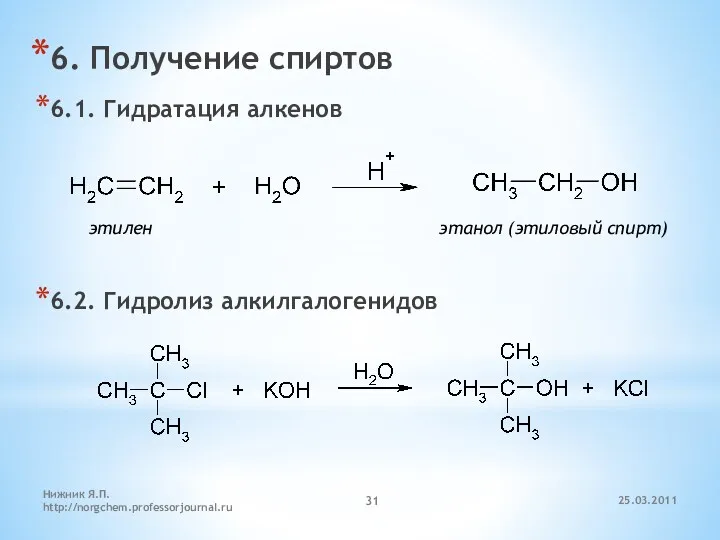
- 31. 6. Получение спиртов 6.1. Гидратация алкенов 6.2. Гидролиз алкилгалогенидов этилен этанол (этиловый спирт) 25.03.2011 Нижник Я.П.
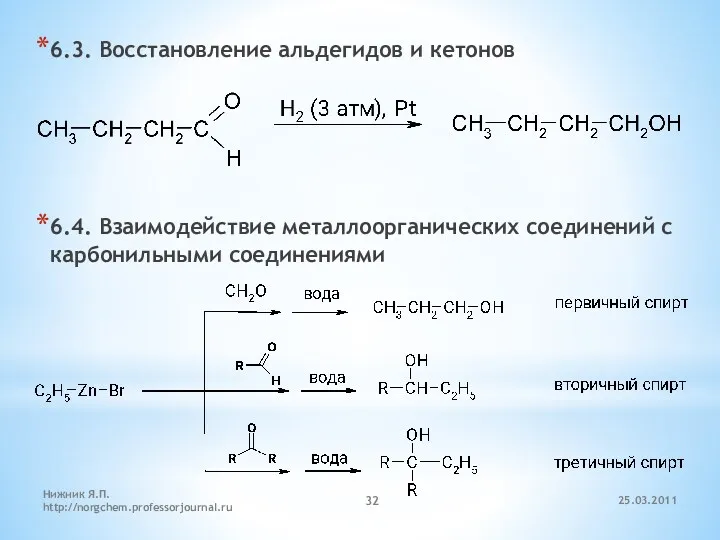
- 32. 6.3. Восстановление альдегидов и кетонов 6.4. Взаимодействие металлоорганических соединений с карбонильными соединениями 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
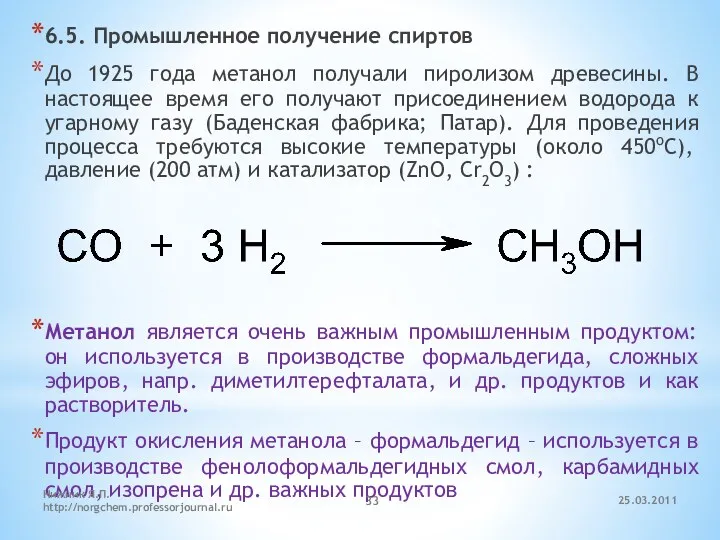
- 33. 6.5. Промышленное получение спиртов До 1925 года метанол получали пиролизом древесины. В настоящее время его получают
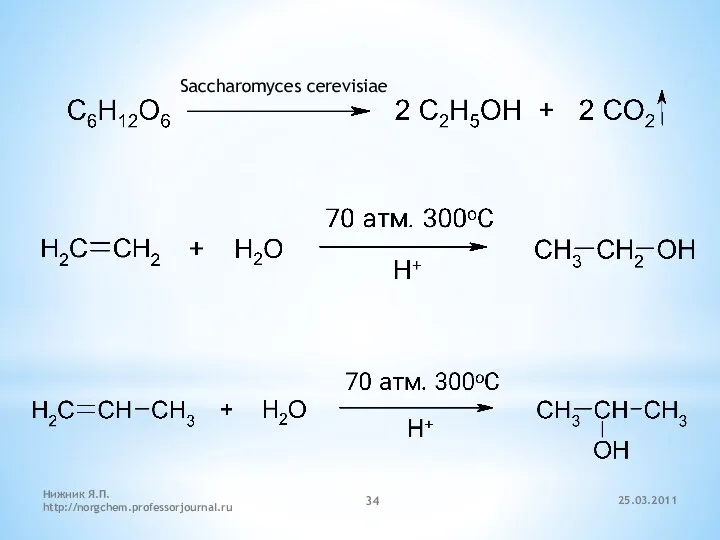
- 34. Saccharomyces cerevisiae 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
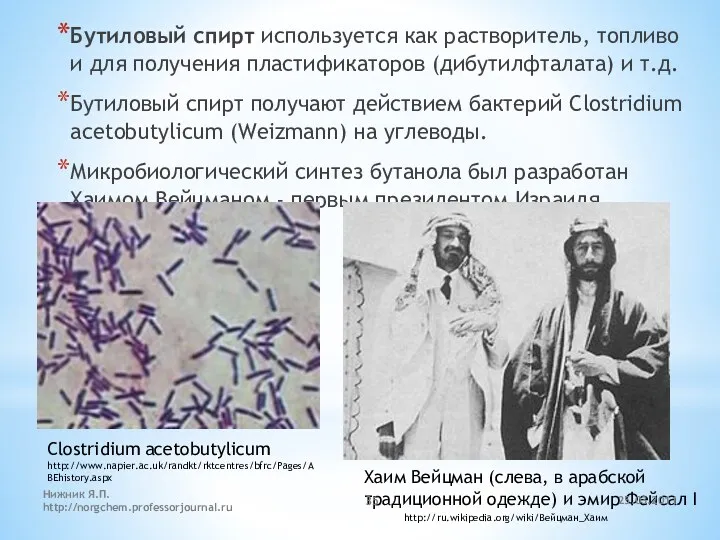
- 35. Бутиловый спирт используется как растворитель, топливо и для получения пластификаторов (дибутилфталата) и т.д. Бутиловый спирт получают
- 36. МНОГОАТОМНЫЕ СПИРТЫ 1. Изомерия и номенклатура этиленгликоль глицерин эритрит 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
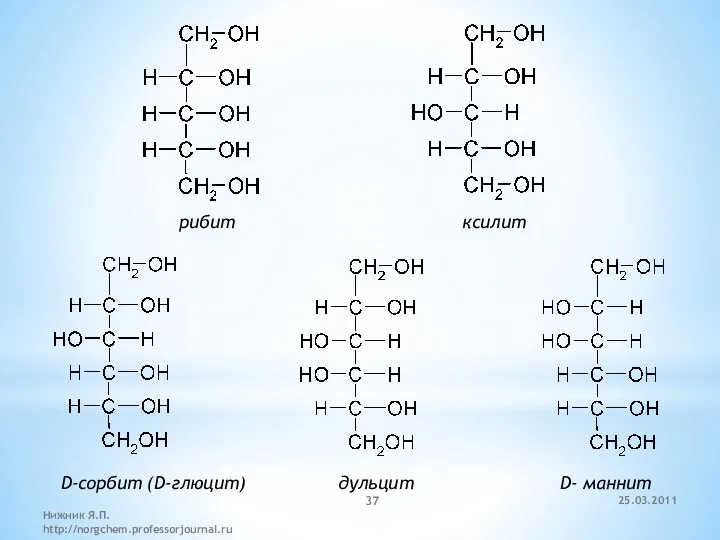
- 37. рибит ксилит D-сорбит (D-глюцит) дульцит D- маннит 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
- 38. 2. Физические и биологические свойства Этиленгликоль и пропиленгликоль являются высококипящими жидкостями, глицерин представляет собой очень вязкую
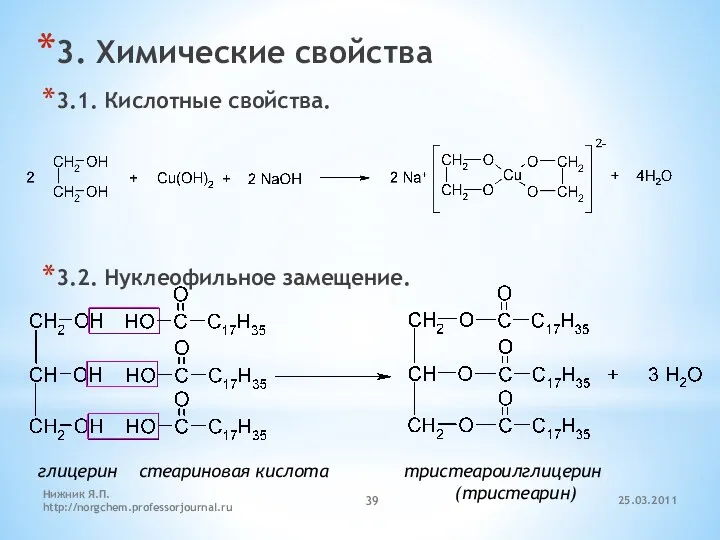
- 39. 3. Химические свойства 3.1. Кислотные свойства. 3.2. Нуклеофильное замещение. глицерин стеариновая кислота тристеароилглицерин (тристеарин) 25.03.2011 Нижник
- 40. Нитроглицерин используется во взрывчатых веществах - динамитах и бездымных порохах - баллиститах. Динамит и баллистит были
- 41. этиленгликоль диоксан 3.3. Реакции элиминирования – внутримолекулярная дегидратация. глицерин пропадиенол акролеин 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
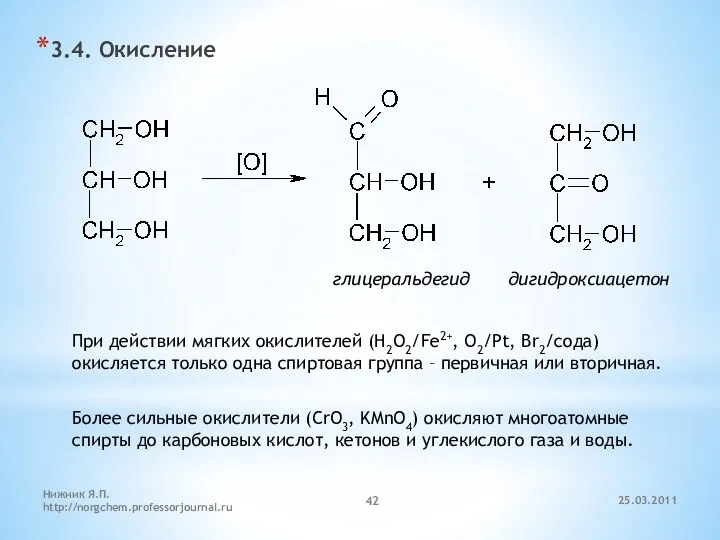
- 42. 3.4. Окисление глицеральдегид дигидроксиацетон При действии мягких окислителей (H2O2/Fe2+, O2/Pt, Br2/сода) окисляется только одна спиртовая группа
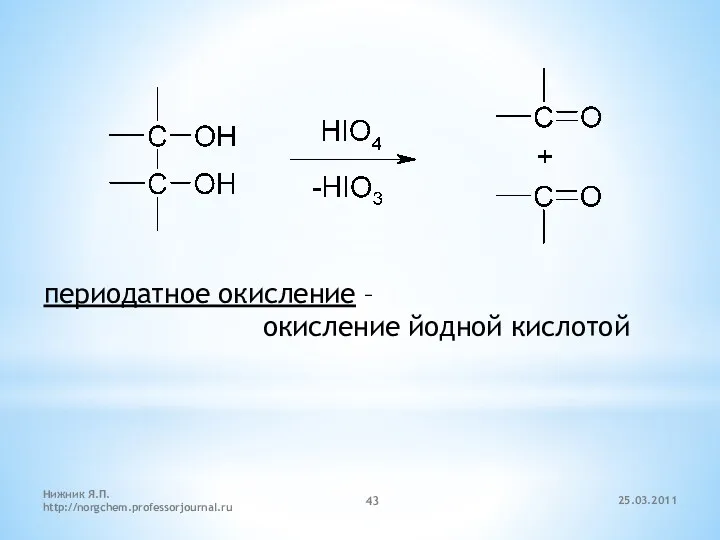
- 43. периодатное окисление – окисление йодной кислотой 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
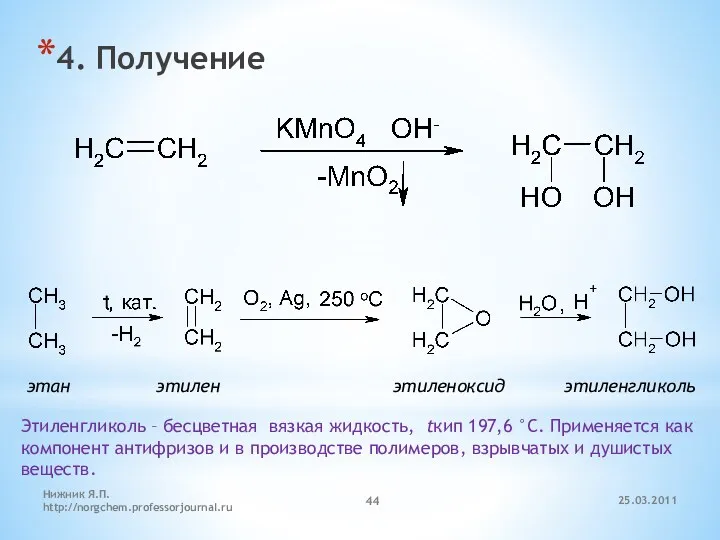
- 44. 4. Получение этан этилен этиленоксид этиленгликоль Этиленгликоль – бесцветная вязкая жидкость, tкип 197,6 °С. Применяется как
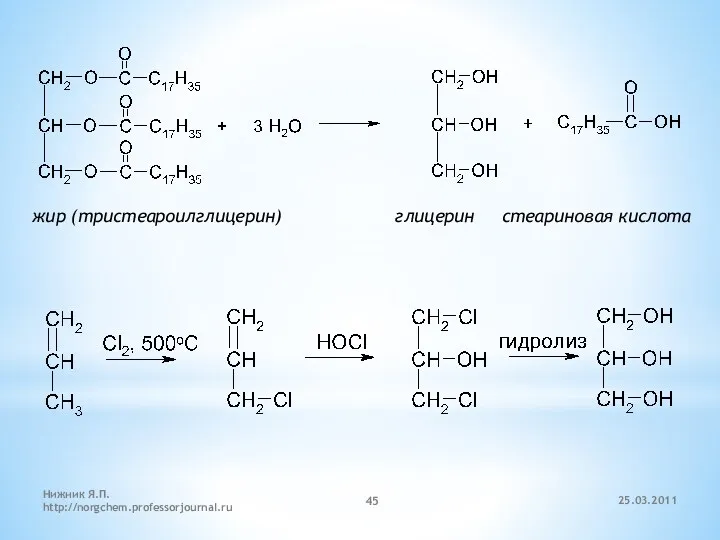
- 45. жир (тристеароилглицерин) глицерин стеариновая кислота 25.03.2011 Нижник Я.П. http://norgchem.professorjournal.ru
- 46. ксилоза ксилит Многоатомные спирты часто встречаются в природе. Сорбит содержится в плодах рябины (лат. sorbus –
- 48. Скачать презентацию






















 Основы термодинамики
Основы термодинамики Химическое равновесие. Азот и Фосфор. 9 класс
Химическое равновесие. Азот и Фосфор. 9 класс Особенности органических веществ. Теория химического строения А.М.Бутлерова
Особенности органических веществ. Теория химического строения А.М.Бутлерова Водород. Сущность водорода как химического элемента
Водород. Сущность водорода как химического элемента Аналитическая химия. Количественный анализ (ч.1. титриметрия)
Аналитическая химия. Количественный анализ (ч.1. титриметрия) Кислоты
Кислоты Катионная полимеризация (Лекция 6)
Катионная полимеризация (Лекция 6) Получение и установление состава кристаллогидрата фосфата цинка
Получение и установление состава кристаллогидрата фосфата цинка Простые вещества
Простые вещества Электролиз. Коррозия и защита металлов
Электролиз. Коррозия и защита металлов Классификация и свойства природных энергоносителей
Классификация и свойства природных энергоносителей Фосфор и его соединения. Урок по химии для 9 класса
Фосфор и его соединения. Урок по химии для 9 класса Кислоты. Состав кислот
Кислоты. Состав кислот Определение качественного состава минеральных вод
Определение качественного состава минеральных вод Арены
Арены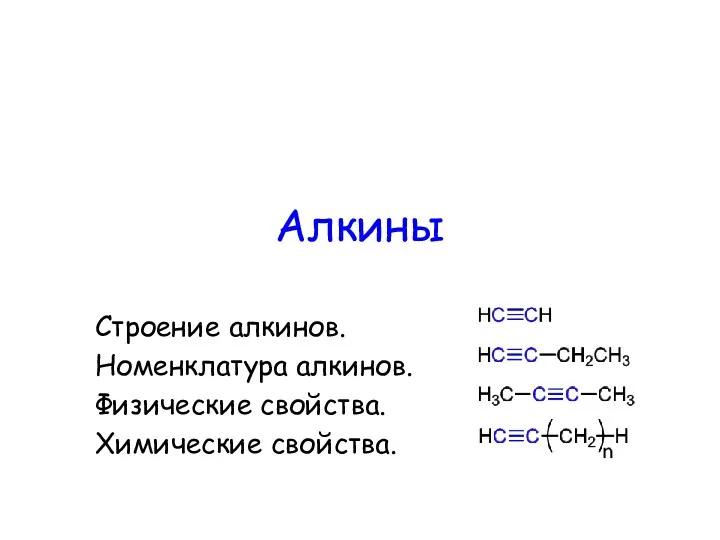 Алкины. Строение алкинов. Номенклатура алкинов. Физические свойства. Химические свойства
Алкины. Строение алкинов. Номенклатура алкинов. Физические свойства. Химические свойства Техники ювелирного дела. Введение в предмет. Общие сведения
Техники ювелирного дела. Введение в предмет. Общие сведения Расчет реактора установки гидроочистки бензина
Расчет реактора установки гидроочистки бензина Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Жидкостная экстракция
Жидкостная экстракция Эфирные масла
Эфирные масла Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Природные источники углеводородов
Природные источники углеводородов Неорганические соединения галогенов
Неорганические соединения галогенов Изотопы, их свойства и применение
Изотопы, их свойства и применение Жиры. История открытия, строение, классификация, свойства
Жиры. История открытия, строение, классификация, свойства Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Алкадиены
Алкадиены