Содержание
- 2. План 1. Количественный анализ. Задачи и методы количественного анализа. 2. Общая характеристика титриметрических методов анализа. Понятие
- 3. Предмет аналитической химии Аналитическая химия – наука о методах определения качественного и количественного состава веществ или
- 4. 1. Количественный анализ. Задачи и методы количественного анализа Раздел аналитической химии, изучающий методы определения количественного содержания
- 5. 2. Общая характеристика титриметрических методов анализа. Понятие о титровании. Титриметрический метод - метод количественного анализа, основанный
- 6. Титрованные растворы – растворы с известной концентрацией - титром. Эти растворы называют рабочими растворами – титрантами.
- 7. Методы титриметрического анализа: В основе классификации лежат реакции, применяемые при титровании. 1. Метод нейтрализации – в
- 8. 3. Метод осаждения - в основе метода лежит реакция осаждения ионов в виде труднорастворимых соединений. Ag+
- 9. Условия титриметрического анализа 1. Точное измерение объемов реагирующих веществ. 2. Приготовление растворов точно известной концентрацией, с
- 10. Требования к реакциям титрования 1. Реакция должна проходить количественно, по определённому уравнению, без побочных реакций. 2.
- 11. Способы титрования А) прямое - при титровании используется один рабочий раствор, реакция идет между рабочим раствором
- 12. В) титрование заместителя – используются два рабочих раствора. Первый рабочий раствор вступает в реакцию с определяемым
- 13. 3. Индикаторы Вещества, окраска которых меняется в зависимости от рН среды. Индикаторы – это слабые органические
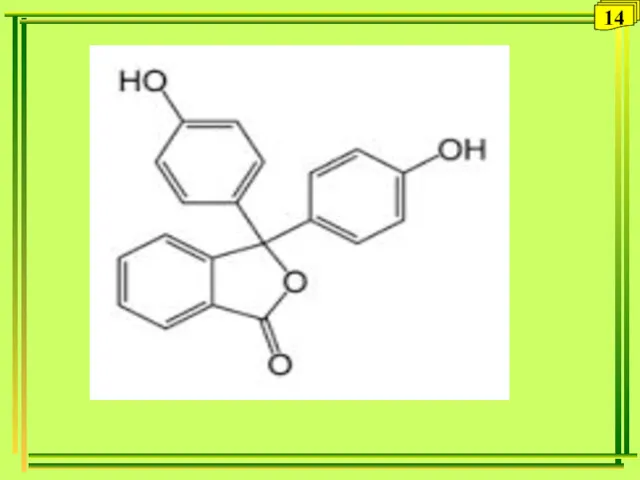
- 14. 14
- 15. 4. Стандартные и стандартизированные растворы Каким бы методом не проводилось титрование, в нем используются: - титрованный
- 16. 5. Кислотно-основное титрование Основные положения метода Объемы растворов реагирующих веществ обратно пропорциональны их нормальным концентрациям: V1
- 17. 6. Вычисления в титриметрическом анализе Формулы для расчета: рН раствора слабой кислоты рН раствора слабого основания
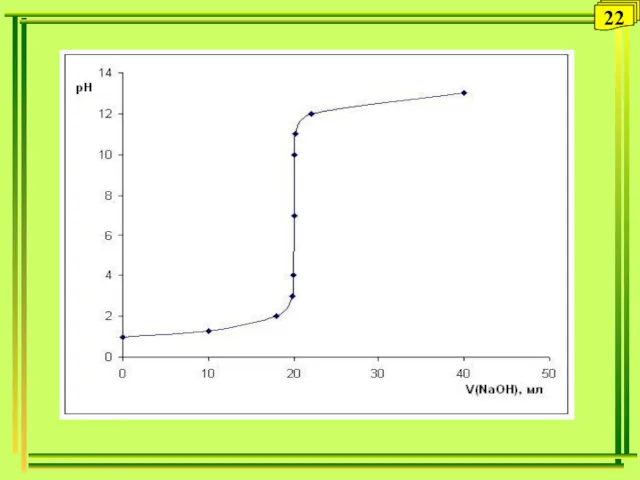
- 18. Вычисления в титриметрическом анализе (продолжение) Расчет кривой титрования сильной кислоты сильным основанием 1-я точка. Возьмем 100
- 19. продолжение: 4-я точка. Добавим еще 0,9 мл (всего 99,9 мл ) 0,1 М раствора NaOH ,
- 20. продолжение: 6-я точка. Добавим еще 0,01 мл 0,1 М раствора NaOH (всего 100,01 мл), объем раствора
- 21. Продолжение: 8-я точка. Добавим еще 0,9 мл (всего 101 мл ) 0,1 М раствора NaOH. избыток
- 22. 22
- 23. 6. Вычисления в титриметрическом анализе (продолжение) Расчет кривой титрования сильной кислоты слабым основанием рН буферной смеси
- 24. 24
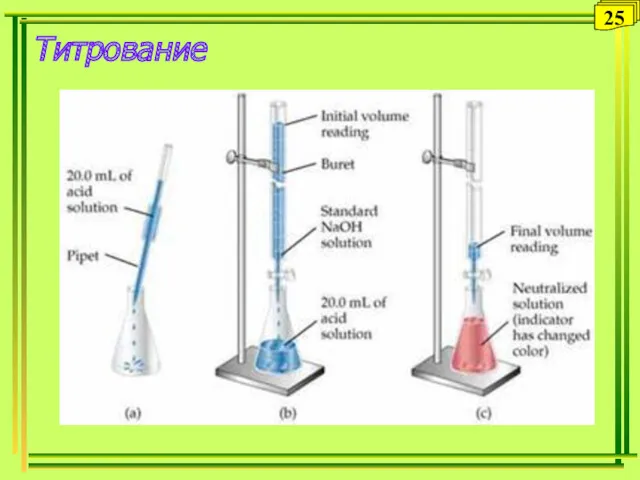
- 25. Титрование 25
- 27. Скачать презентацию





















 Химические свойства солей
Химические свойства солей Кислородные соединения серы
Кислородные соединения серы Классификация химических реакций по тепловому эффекту
Классификация химических реакций по тепловому эффекту Химическая технология ситаллов и композитов
Химическая технология ситаллов и композитов Общие сведения об электрорадиоматериалах
Общие сведения об электрорадиоматериалах Химические элементы в организме человека
Химические элементы в организме человека Химические формулы
Химические формулы Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов
Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов Предмет органической химии
Предмет органической химии Типы химических реакций
Типы химических реакций Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Реакции ионного обмена между растворами электролитов
Реакции ионного обмена между растворами электролитов Положение тугоплавких металлов в Периодической системе элементов
Положение тугоплавких металлов в Периодической системе элементов Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором
Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ
Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ Физические и химические явления
Физические и химические явления Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Углекислый газ
Углекислый газ Коллигативные свойства растворов неэлектролитов
Коллигативные свойства растворов неэлектролитов Биоорганическая химия
Биоорганическая химия Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Железо, его характеристики, свойства и соединения
Железо, его характеристики, свойства и соединения Радиохимия
Радиохимия Кислород и его применение
Кислород и его применение Строение атома. Химическая связь
Строение атома. Химическая связь Основные синтетические полимеры
Основные синтетические полимеры Строение атома
Строение атома