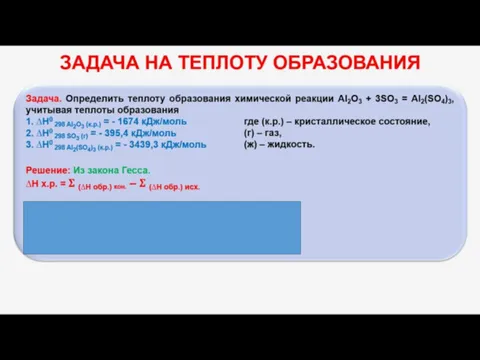
Мерой разупорядоченности или хаотичности системы в термодинамике служит энтропия .
В
изолированных системах самопроизвольно могут протекать процессы, сопровождающиеся увеличением энтропии, S2 > S1 или ∆S >0.
Энтропия зависит от всех видов движения частиц, составляющих систему, их количества, числа степеней свободы и возрастает с повышением температуры. Поэтому в процессах, вызываемых увеличением движения частиц, т.е. при нагревании, испарении, плавлении, разрыве связей между атомами и т.п., энтропия возрастает и наоборот.
Её обычно относят к молю вещества и выражают в Дж/моль К.
Энтропия, отнесённая к стандартной температуре 25 C ( 298 K ) и стандартному давлению (1 атм), называется стандартной ( S0).
∆S = S2 - S1









 Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов 20231113_tipy_him._reaktsiy_prezentatsiya
20231113_tipy_him._reaktsiy_prezentatsiya Физико-химические свойства поливинилового спирта и поливинилформаля
Физико-химические свойства поливинилового спирта и поливинилформаля Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Наглядное пособие Динамические модели. Химическое равновесие в растворах
Наглядное пособие Динамические модели. Химическое равновесие в растворах Total Synthesis of Aplysiasecosterol A
Total Synthesis of Aplysiasecosterol A Химико-лесной комплекс
Химико-лесной комплекс Металлы в организме человека
Металлы в организме человека Тепловой эффект химических реакций
Тепловой эффект химических реакций Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Занимательные опыты в качественном анализе
Занимательные опыты в качественном анализе Атомы и молекулы. Простые и сложные вещества. 6 класс
Атомы и молекулы. Простые и сложные вещества. 6 класс Пниктогены - элеметны VA группы
Пниктогены - элеметны VA группы Соли. Классификация. Физические и химические свойства солей
Соли. Классификация. Физические и химические свойства солей Теория электролитической диссоциации
Теория электролитической диссоциации Производство чугуна и стали
Производство чугуна и стали Основания. 8 класс
Основания. 8 класс Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Строение атома. Лекция №2
Строение атома. Лекция №2 Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию АТФ молекуласының құрылысы мен қызметтері
АТФ молекуласының құрылысы мен қызметтері Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс)
Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс) Спирты. Действие этанола на организм человека (10 класс)
Спирты. Действие этанола на организм человека (10 класс) Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Химия воды
Химия воды