Содержание
- 2. [ПО УРОКУ] В КЛАССЕ ВЫПОЛНЕНИЕ – ДОМА ОФОРМЛЕНИЕ (презентация будет)
- 3. Задачи урока: 1. Осуществить переходы генетической цепочки CuSO4 (CuOH)2CO3 2. Описать эффекты реакций Cu(NO3)2 Cu A
- 4. CuSO4 (CuOH)2CO3 Cu(NO3)2 Cu A B NaOH NH4OH 1 2 3 4 5 Описание: 1. В
- 5. [Учителю] Задайте вопрос детям, что нужно, чтобы «запустить» химическую реакцию. Объясните, что проблема гетерогенных реакций –
- 6. Эффект: В ходе взаимодействия двух порошков синего и белого цвета образуется осадок бирюзового (зелёного) цвета и
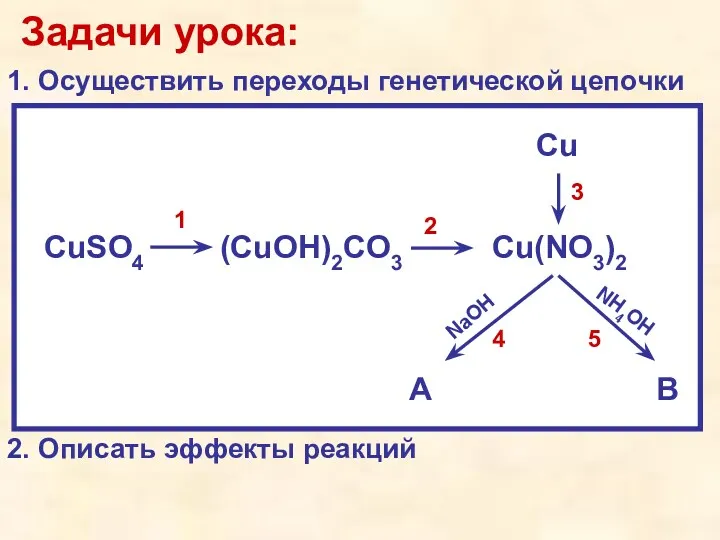
- 7. CuSO4 (CuOH)2CO3 Cu(NO3)2 Cu A B NaOH NH4OH 1 2 3 4 5 Описание: В пробирку
- 8. Эффект: В ходе взаимодействия с бесцветным раствором кислоты происходит растворение бирюзового (зелёного) осадка, образуется синий раствор
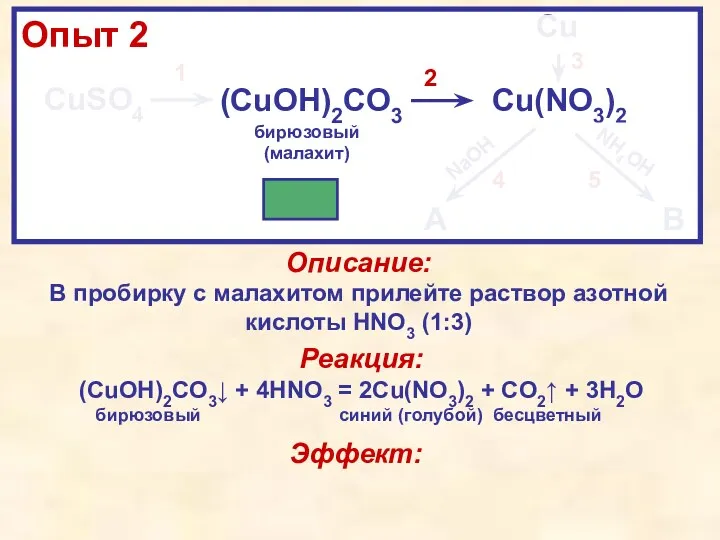
- 9. CuSO4 (CuOH)2CO3 Cu(NO3)2 Cu A B NaOH NH4OH 1 2 3 4 5 Описание: В чистую
- 10. [Учителю] В процессе работы учителю стоит озвучить, что NO2 токсичный, и сразу после получения его следовых
- 11. Эффект: В ходе взаимодействия розовой (коричневой) меди с бесцветным раствором кислоты происходит её растворение и образование
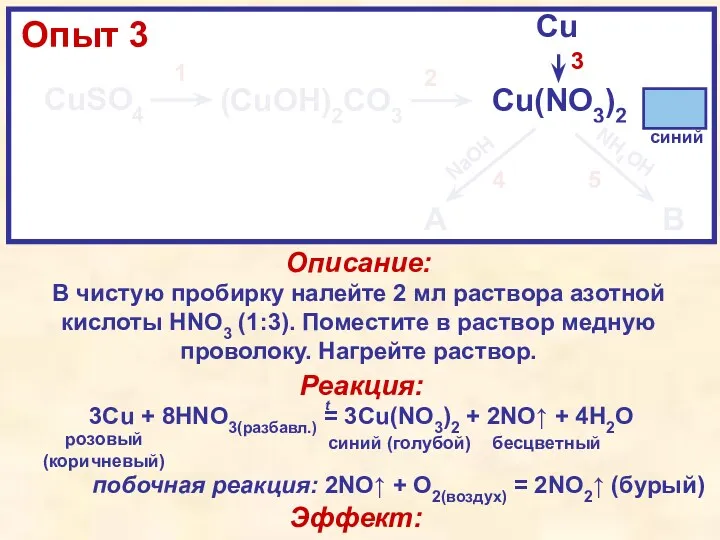
- 12. CuSO4 (CuOH)2CO3 Cu(NO3)2 Cu A B NaOH NH4OH 1 2 3 4 5 Описание: В одну
- 13. [Учителю] В этой части поясните детям, что несмотря на то, что в обеих пробирках у них
- 14. Эффект реакции 4: При добавлении к синему раствору Cu(NO3)2 бесцветного раствора NaOH выпал голубой осадок Cu(OH)2
- 15. Эффект реакции 5: При добавлении к синему раствору Cu(NO3)2 бесцветного раствора NH4OH произошло образование сине-фиолетового раствора
- 16. Примечание: Нельзя осадить гидроксиды меди, серебра, кобальта, никеля и ртути действием аммиака на их соли из-за
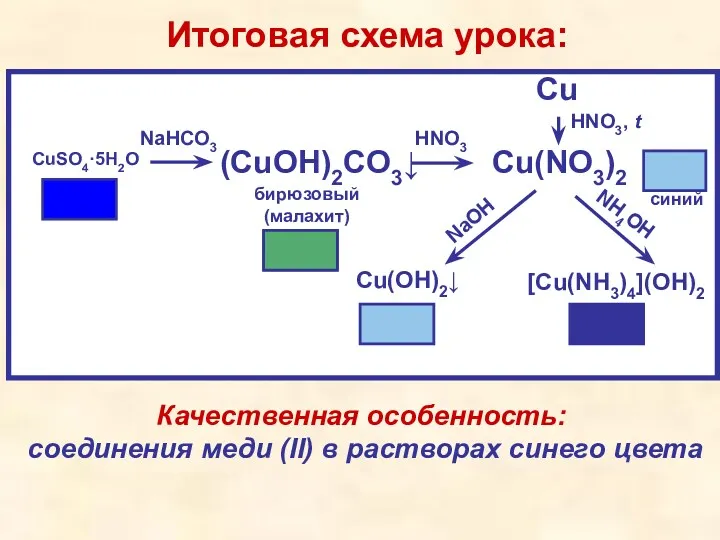
- 17. CuSO4·5H2O (CuOH)2CO3↓ Cu(NO3)2 Cu NaOH NH4OH Итоговая схема урока: синий Cu(OH)2↓ [Cu(NH3)4](OH)2 бирюзовый (малахит) NaHCO3 HNO3
- 18. [УЧИТЕЛЮ] Штативы с тремя пробирками – 1 – сухая, 2 – с медной проволокой, 3 –
- 20. Скачать презентацию
![[ПО УРОКУ] В КЛАССЕ ВЫПОЛНЕНИЕ – ДОМА ОФОРМЛЕНИЕ (презентация будет)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/377469/slide-1.jpg)

![[Учителю] Задайте вопрос детям, что нужно, чтобы «запустить» химическую реакцию.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/377469/slide-4.jpg)


![[Учителю] В процессе работы учителю стоит озвучить, что NO2 токсичный,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/377469/slide-9.jpg)

![[Учителю] В этой части поясните детям, что несмотря на то,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/377469/slide-12.jpg)



![[УЧИТЕЛЮ] Штативы с тремя пробирками – 1 – сухая, 2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/377469/slide-17.jpg)
 Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация Лекарственные средства, производные пиридина и пиперазина
Лекарственные средства, производные пиридина и пиперазина Растворы. Классификация, способы выражения концентрации, свойства растворов
Растворы. Классификация, способы выражения концентрации, свойства растворов Heavy metals
Heavy metals Химические методы выявления потожировых следов
Химические методы выявления потожировых следов Искусственные и трансурановые элементы
Искусственные и трансурановые элементы Карбонові кислоти
Карбонові кислоти Перманганат калия
Перманганат калия АЛКАНЫ Строение молекулы метана.
АЛКАНЫ Строение молекулы метана. Вещественный состав магматических горных пород и петрохимические пересчеты
Вещественный состав магматических горных пород и петрохимические пересчеты Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Периодический закон Менделеева
Периодический закон Менделеева Кислород
Кислород Непредельные углеводороды. Алкины
Непредельные углеводороды. Алкины Аллотропия
Аллотропия Химическая промышленность России входит в авангардную тройку
Химическая промышленность России входит в авангардную тройку Вещества и физические тела
Вещества и физические тела Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Алканы.Определение. Общая формула класса углеводородов
Алканы.Определение. Общая формула класса углеводородов Уникальная соль (для дошколников)
Уникальная соль (для дошколников) Химические свойства толуола
Химические свойства толуола Окислительно-восстановительные реакции. Основные положения электронной теории ОВР
Окислительно-восстановительные реакции. Основные положения электронной теории ОВР Перегонка с водяным паром
Перегонка с водяным паром Вода
Вода Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел 5.Алкины
5.Алкины Циклические углеводороды
Циклические углеводороды Химический элемент водород
Химический элемент водород