Содержание
- 2. СПИСОК ЛИТЕРАТУРЫ: Бухаркина Т.В., Дигуров Н.Г. Химия природных энергоносителей и углеродных материалов. – М.: РХТУ, 1999
- 3. ВВЕДЕНИЕ Химия природных энергоносителей и углеродных материалов рассматривает сырьевые материалы – природные энергоносители (горючие ископаемые ГИ):
- 4. ВВЕДЕНИЕ В первом приближении фазовое состояние ГИ может быть сопоставлено с соотношением Н/С максимум водорода содержат
- 5. ОСНОВНЫЕ РАЗДЕЛЫ КУРСА: Физические и химические свойства углерода Термодинамика и основные стадии процессов термической деструкции Твердые
- 6. УГЛЕРОД. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ УГЛЕРОДА Аллотропия – способность атомов одного и того же элемента существовать в виде
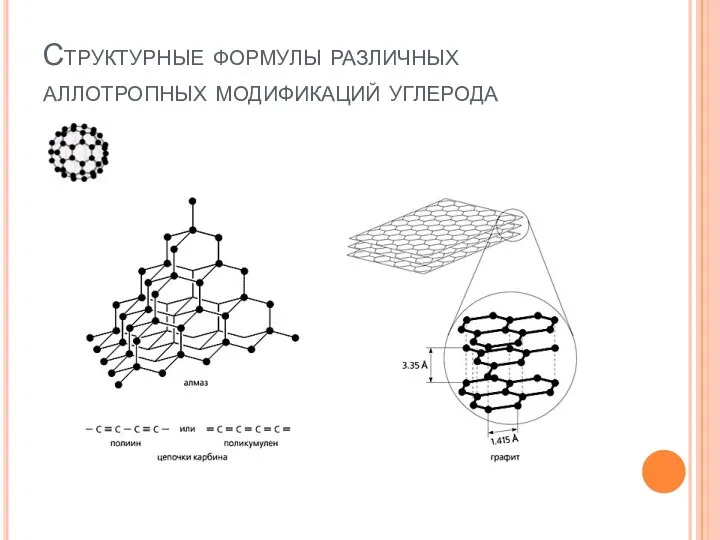
- 7. Структурные формулы различных аллотропных модификаций углерода
- 8. ФИЗИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА Векторные Скалярные Механические (упругость, хрупкость, пластичность) Тепловые (теплопроводность, теплоемкость, тепловое расширение) Электрические (электропроводность)
- 9. ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА При низких температурах углеродные материалы достаточно инертны ко многим реагентам, однако при высоких
- 10. СЛОИСТЫЕ СОЕДИНЕНИЯ Непроводящие: Получают при обработке графита смесью HNO3 и H2SO4, дымящей H2SO4 или др. сильными
- 11. ТЕРМОДИНАМИКА ПРОЦЕССОВ ТЕРМИЧЕСКОЙ ДЕСТРУКЦИИ Термодинамическая вероятность протекания хим. реакции определяется величиной изменения свободной энергии Гиббса ∆G
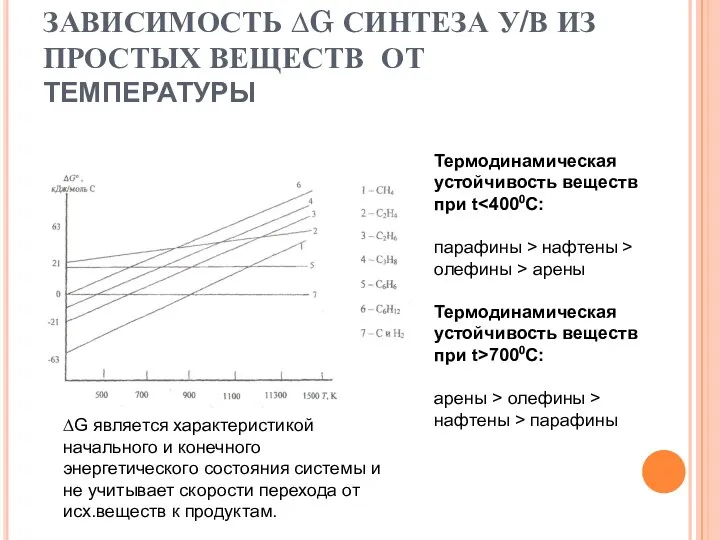
- 12. ЗАВИСИМОСТЬ ∆G СИНТЕЗА У/В ИЗ ПРОСТЫХ ВЕЩЕСТВ ОТ ТЕМПЕРАТУРЫ Термодинамическая устойчивость веществ при t парафины >
- 13. ЭНЕРГИЯ РАЗРЫВА СВЯЗЕЙ В ОРГАНИЧЕСКОМ ВЕЩЕСТВЕ Из сравнения энергий связи следует, что в первую очередь будут
- 14. СИНТЕЗ УГЛЕРОДА Материалы, состоящие из атомов углерода могут быть получены высокотемпературной обработкой углеродсодержащих веществ как в
- 15. СИНТЕЗ УГЛЕРОДА ИЗ ПЕКОВ Пеки - конденсированные ароматические и нафтеновые структуры. Стадии синтеза: Деструкция по связям
- 17. Скачать презентацию












 Процессы природного минералообразования. Формы природных выделений минералов
Процессы природного минералообразования. Формы природных выделений минералов 20191107_binarnye_oksidy_1
20191107_binarnye_oksidy_1 Основания
Основания Характер химического элемента по кислотно- основным свойствам. (Амфотерные соединения)
Характер химического элемента по кислотно- основным свойствам. (Амфотерные соединения) Химические свойства спиртов. Химические свойства предельных одноатомных спиртов
Химические свойства спиртов. Химические свойства предельных одноатомных спиртов Жаңа дәрілерді жасау
Жаңа дәрілерді жасау Реакции ионного обмена в растворах электролитов. рH раствора как показатель кислотности среды
Реакции ионного обмена в растворах электролитов. рH раствора как показатель кислотности среды Формулы веществ. Относительная атомная масса. Относительная молекулярная масса. Массовая доля элементов в сложных веществах
Формулы веществ. Относительная атомная масса. Относительная молекулярная масса. Массовая доля элементов в сложных веществах Спирты одноатомные и многоатомные
Спирты одноатомные и многоатомные Углерод
Углерод 20230306_oksidy
20230306_oksidy Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Индикаторы на кухне
Индикаторы на кухне Развитие теории восстановления металлов
Развитие теории восстановления металлов Химическая связь
Химическая связь Экспериментальное решение задач по теме: Классы неорганических соединений
Экспериментальное решение задач по теме: Классы неорганических соединений Алкадиены
Алкадиены Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс)
Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс) Термопластичные полимеры
Термопластичные полимеры Сутектік көрсеткіш ph. Тұздар гидролизі
Сутектік көрсеткіш ph. Тұздар гидролизі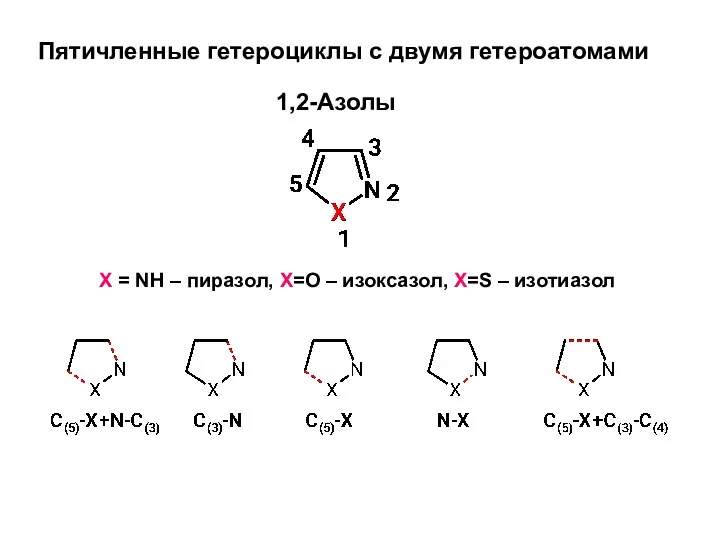 Пятичленные гетероциклы с двумя гетероатомами
Пятичленные гетероциклы с двумя гетероатомами Знакомство с образцами химических средств санитарии и гигиены
Знакомство с образцами химических средств санитарии и гигиены Периодический закон Д. И. Менделеева
Периодический закон Д. И. Менделеева Твердотільний ямр
Твердотільний ямр Оксид меди
Оксид меди Возникновение и развитие научной химии
Возникновение и развитие научной химии Технология получения многослойного и малослойного графена
Технология получения многослойного и малослойного графена Коррозия металлов
Коррозия металлов