Содержание
- 2. Коррозия металлов Коррозией называют самопроизвольное разрушение материалов вследствие химического или электрохи-мического взаимодействия их с окружающей средой.
- 3. КОРРОЗИЯ МЕТАЛЛОВ Первопричиной коррозии металлов является термодина-мическая неустойчивость металлов в различных средах при данных внешних условиях.
- 4. Стадии коррозионного процесса Отличительной особенностью коррозионных процессов является их сложность и многостадийность. Обычно кор-розионный процесс состоит
- 5. Классификация коррозионных процессов (по механизму процесса) Химическая коррозия – взаимодействие металлической поверхности с окружающей средой, не
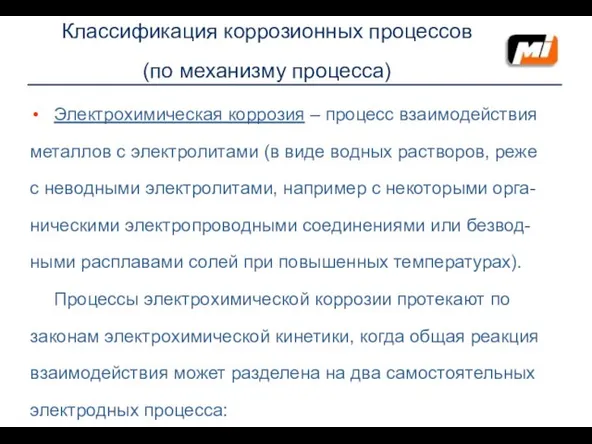
- 6. Классификация коррозионных процессов (по механизму процесса) Электрохимическая коррозия – процесс взаимодействия металлов с электролитами (в виде
- 7. Коррозионные процессы (по условиям протекания коррозии) Газовая Атмосферная Жидкостная Подземная Биокоррозия Структурная Коррозия внешним током Коррозия
- 8. ТИПЫ КОРРОЗИОННЫХ РАЗРУШЕНИЙ (по характеру разрушений) Общая коррозия (по поверхности металла)– равномерная, неравномерная, избирательная Местная (локальная)
- 9. ТИПЫ КОРРОЗИОННЫХ РАЗРУШЕНИЙ (по характеру разрушений) Нитевидная(в виде нитей под плёнкой лака на угл. стали) Подповерхностная
- 10. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ Анодный процесс-переход металла в раствор в виде ионов (в водных растворах, обычно гидратированных) с
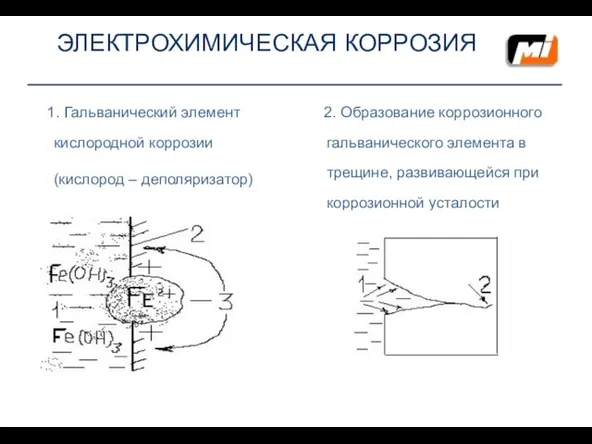
- 11. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ 1. Гальванический элемент кислородной коррозии (кислород – деполяризатор) 2. Образование коррозионного гальванического элемента в
- 12. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ Пояснения к рис. 1 - буровой раствор - бурильная труба - электрический ток Под
- 13. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ КОРРОЗИЯ В ПРИСУТСТВИИ СЕРОВОДОРОДА Этот вид коррозии известен в практике под названием сульфидное растрескивание
- 14. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ КОРРОЗИЯ В ПРИСУТСТВИИ СЕРОВОДОРОДА Для сталей с прочностными характеристиками ниже указанных (пластичные стали), разрушения
- 15. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ КОРРОЗИЯ В ПРИСУТСТВИИ СЕРОВОДОРОДА Сероводород в водной среде при растворении диссоции-рует на ионы в
- 16. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ КОРРОЗИЯ В ПРИСУТСТВИИ СЕРОВОДОРОДА Поэтому основным методом является использование реагентов-нейтрализаторов сероводорода. Наиболее применяемые это
- 17. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ КОРРОЗИЯ В ПРИСУТСТВИИ УГЛЕКИСЛОГО ГАЗА Углекислый газ, как и сероводород, при бурении сква-жин может
- 18. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ КОРРОЗИЯ В ПРИСУТСТВИИ УГЛЕКИСЛОГО ГАЗА Для предотвращения этого применяют ингибиторы осадкообразования (фосфорорганические комплексоны) и
- 19. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ КОРРОЗИЯ В ПРИСУТСТВИИ КИСЛОРОДА В буровых растворах растворах почти всегда присут-ствует кислород, растворившийся в
- 20. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ КОРРОЗИЯ В ПРИСУТСТВИИ КИСЛОРОДА При рН 12 скорость кислородной коррозии максимальна. Необходимые мероприятия для
- 21. МИКРОБИОЛОГИЧЕСКАЯ КОРРОЗИЯ В буровых растворах на водной основе присутствуют разнообразные микроорганизмы, которые способствуют коррозии по различным
- 22. МИКРОБИОЛОГИЧЕСКАЯ КОРРОЗИЯ Коррозии в этом случае способствует не только обра-зующейся Н2S , но и деполяризация катода.
- 23. Количественная характеристика коррозионных процессов При относительно равномерном типе коррозионного разрушения скорость коррозии может быть выражена массовым
- 24. Количественная характеристика коррозионных процессов Испытание бурового раствора на коррозионную актив-ность можно осуществлять в лаборатории. Для этого
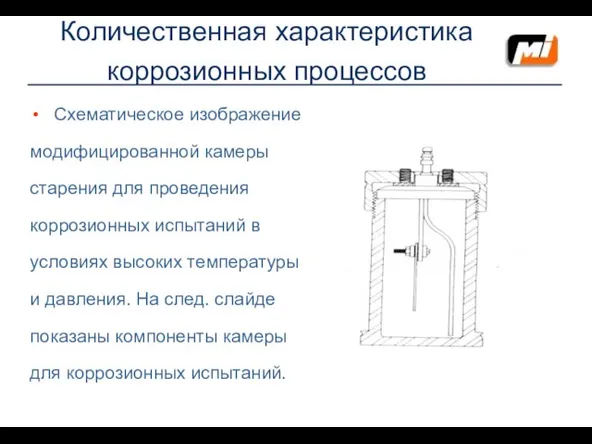
- 25. Количественная характеристика коррозионных процессов Схематическое изображение модифицированной камеры старения для проведения коррозионных испытаний в условиях высоких
- 26. Количественная характеристика коррозионных процессов
- 27. МЕТОДЫ ЗАЩИТЫ Широко применяются следующие методы защиты металлических конструкций от коррозии: Защитные покрытия Обработка коррозионной среды
- 28. МЕТОДЫ ЗАЩИТЫ Переход в ряде конструкций от металлических к химичес-ки стойким материалам (ВМС, стекло, керамика и
- 29. Факторы влияющие на коррозию рН Минерализация Давление Температура Бактерии Растворенные в растворе газы О2, СО2, Н2S
- 30. Контроль Коррозии в бурении рН 8.3 –9.0 Предотвращение аэрации раствора Использование ингибиторов коррозии Использование бактерицидов Проведение
- 31. ИНГИБИТОРЫ КОРОЗИИ Ингибиторы коррозии, вещества, введение которых в относительно небольших количествах в агрессивную среду, смазку, полимерное
- 32. ИНГИБИТОРЫ КОРОЗИИ Торможение коррозионного процесса м.б. обусловлено: непосредственным исключением поверхности, покрытой ингибитором коррозии, из коррозионного процесса;
- 33. ИНГИБИТОРЫ КОРОЗИИ Различают ингибиторы кислотной коррозии и ингибиторы атмосферной коррозии (т.н. летучие ингибиторы). Последние обладают повышенной
- 34. ИНГИБИТОРЫ КОРОЗИИ CONQOR 101 Вододиспергируемый пленкообразующй амин (для пресных надпакерных растворов) CONQOR 202 B Пленкообразующий амин
- 36. Скачать презентацию






























 Реакция Бэйлиса Хиллмана-Мориты
Реакция Бэйлиса Хиллмана-Мориты Гетероциклические соединения. Классификация, номенклатура, строение и значение гетероциклов
Гетероциклические соединения. Классификация, номенклатура, строение и значение гетероциклов Типичные реакции органических соединений
Типичные реакции органических соединений Алкены. Строение алкенов
Алкены. Строение алкенов Материаловедение-2
Материаловедение-2 Органічні сполуки. 3D моделі органічних сполук
Органічні сполуки. 3D моделі органічних сполук Лантаноидтар. Лантаноидтардың қасиеттері
Лантаноидтар. Лантаноидтардың қасиеттері Ненасыщенные углеводороды. Алкены
Ненасыщенные углеводороды. Алкены Основні властивості металів. Хімія металургійних процесів. Теорія сплавів. Корозія металів
Основні властивості металів. Хімія металургійних процесів. Теорія сплавів. Корозія металів Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1
Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1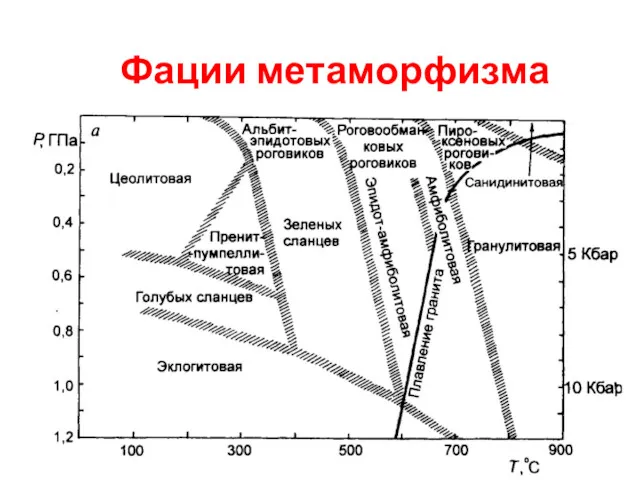 Фации метаморфизма
Фации метаморфизма Формы выделения минералов
Формы выделения минералов B13. Задачи на концентрацию и сплавы
B13. Задачи на концентрацию и сплавы Перегонка с водяным паром
Перегонка с водяным паром Застосування неметалів
Застосування неметалів Амины. Номенклатура аминов
Амины. Номенклатура аминов Определение критических точек двойного сплава
Определение критических точек двойного сплава Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Элемент цинк
Элемент цинк Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Топаз. Хімічна формула топаза
Топаз. Хімічна формула топаза Карбонові кислоти. Хімія. 9 клас
Карбонові кислоти. Хімія. 9 клас Хімічний зв’язок. Типи хімічного зв’язку
Хімічний зв’язок. Типи хімічного зв’язку Проект установки каталитического риформинга мощностью 1200 тыс. тонн
Проект установки каталитического риформинга мощностью 1200 тыс. тонн The structure and properties of the nitrogen and ammonia molecules. Industrial production of nitrogen fertilizers (topic 4.4)
The structure and properties of the nitrogen and ammonia molecules. Industrial production of nitrogen fertilizers (topic 4.4) Бериллий, магний и щелочноземельные металлы. Главная подгруппа II группы
Бериллий, магний и щелочноземельные металлы. Главная подгруппа II группы Хлор (лат. Chlorum, Cl)
Хлор (лат. Chlorum, Cl) Радиоактивные элементы почв
Радиоактивные элементы почв