Основні властивості металів. Хімія металургійних процесів. Теорія сплавів. Корозія металів презентация
Содержание
- 2. Метали (від лат. metallum - шахта, рудник): група елементів, що має характерні металеві властивості, такі як
- 3. Розташування металів в періодичній системі Якщо в періодичній системі елементів Д. І. Менделєєва провести діагональ від
- 4. З 118 хімічних елементів, відкритих на даний момент (з них не все офіційно визнані), до металам
- 5. Атоми металів легко віддають електрони зовнішнього електронного шару, перетворюючись в позитивні іони. Будова атомів металів Метали
- 6. Кристалічна структура металів Всі метали мають кристалічну будову. Розташовані тим або іншим способом атоми утворюють елементарну
- 7. Кристалічна структура металів + + + + + + + + + + + + -
- 8. Вміст металів у земній корі Металами є прості речовини більшості хімічних елементів (приблизно 80 % елементів
- 9. Платина Метеоритне залізо Золото Ртуть Срібло Осмій Мідь Паладій Метали у природі:
- 10. Червоний залізняк Залізний колчедан Сульфідна руда Боксити Хлорид натрію Халькопірит Хромна руда Нікелева руда Руди металів
- 11. Металургія - наука про методи і процеси виробництва металів із їх руд. Таку ж назву має
- 12. Cпособи добування металів
- 13. Фізичні властивості металів Всі метали за звичайних умов тверді речовини, окрім ртуті Найм'якший - калій Найтвердіший
- 14. Фізичні властивості металів Для всіх металів характерний металічний блиск обумовлюється їх здатністю сильно відбивати промені світла
- 15. Характерною властивістю металів є також пластичність Фізичні властивості металів Властивість під дією зовнішнього навантаження деформуватися, не
- 16. Фізичні властивості металів Для всіх металів характерні електро- і теплопровідність пояснюються наявністю вільних електронів Електро- і
- 17. Фізичні властивості металів Густина металів змінюються в широких межах Густина зростає Легкі густина менш як 5
- 18. Фізичні властивості металів У великих інтервалах змінюються температури плавлення металів Найменша — у ртуті (—38,9 °С)
- 19. Хімічні властивості металів
- 20. Хімічні властивості металів Взаємодія металів з киснем: 2Na + О2 = Na2О2 2Сu+ О2 = 2СuО
- 21. Хімічні властивості металів Взаємодія металів з водою: 2Na + 2Н2О = 2NaОН + Н2 Na0 -1е
- 22. Хімічні властивості металів Взаємодія з кислотами: Взаємодія з солями: Zn + 2HCl → ZnCl2 + H2
- 23. КОРОЗІЯ – самочинне руйнування металів і сплавів внаслідок взаємодії їх з навколишнім середовищем Це окисно-відновна реакція,
- 24. За характером руйнівної дії Суцільна (загальна) корозія Місцева (локальна) корозія Охоплює всю поверхню металу Охоплює окремі
- 25. Залежно від механізму процесу ЕЛЕКТРО- ХІМІЧНА ХІМІЧНА руйнування металу внаслідок окиснення його окисниками, що містяться в
- 26. Залежно від типу корозійного середовища АТМОСФЕРНА ГАЗОВА ГРУНТОВА РІДИННА КИСЛОТНА СОЛЬОВА ЛУЖНА Біокорозія Сu →(CuOH)2SO4 Корозія
- 27. Механізм електрохімічної корозії ПОВІТРЯ
- 28. повітря Крапля води ІРЖА ЗАЛІЗО (анод) Механізм електрохімічної корозії ОЛОВО (катод)
- 29. Електрохімічна реакція Анод Катод Мінеральні поверхні Механізм електрохімічної корозії ЕЛЕКТРОЛІТ ПОВІТРЯ
- 30. Внаслідок корозії виходять з ладу обладнання, машини, механізми, руйнуються металеві конструкції Корозія металів завдає великої економічної
- 31. Методи захисту металів і сплавів від корозії Металічні (Zn,Sn,Cr,Pb,Ni) Неметалічні (лаки, фарби, емалі) Zn Ni Cr
- 32. Протекторний захист і електрозахист деталь Ел. струм Анод - протектор Створення сплавів з антикорозійними властивостями Методи
- 33. Галузі застосування металів Застосування металів Літако – машино- будування Металургія Атомна та ядерна енергетика Металеві захисні
- 34. СПЛАВИ - це матеріали з характерними властивостями, які складаються з двох або більше компонентів, з яких
- 35. Однорідними – при сплавленні утворюється розчин одного металу у іншому Неоднорідними – це механічна суміш металів
- 36. В металургії залізо и всі його сплави об’єднують в одну групу під назвою ЧОРНІ МЕТАЛИ інші
- 37. Сталь - сплав на основі заліза, який має менш 2% вуглецю. По хімічному складу сталі поділяють
- 38. Нержавіюча сталь використовується для виготовлення столових приборів, містить близько 12% хрому і до 10% нікелю. Нержавіючі
- 39. ДЮРАЛЮМІНІЙ – сплав на основі алюмінію, який містить Cu, Mg, Mn, Ni. Має добрі механічні властивості,
- 40. Щоб зберегти залізо від іржавіння, його деталі вкривають тонким шаром олова (лудіння). Занурюючи листове залізо у
- 41. Фізичні та хімічні властивості алюмінію зумовили його широке застосування в техніці. Значним споживачем алюмінію, є авіаційна
- 43. Скачать презентацию

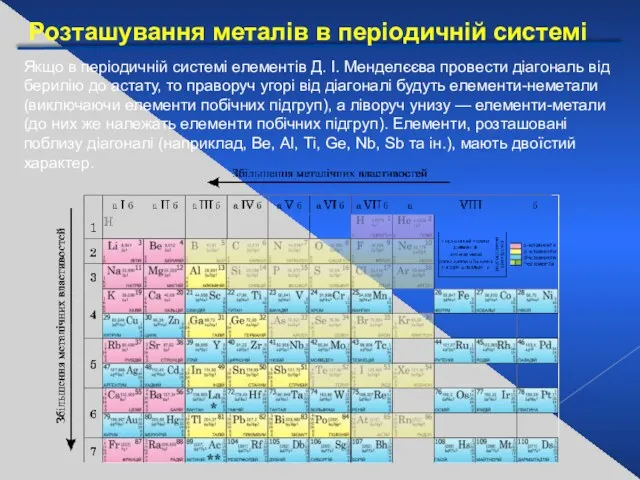

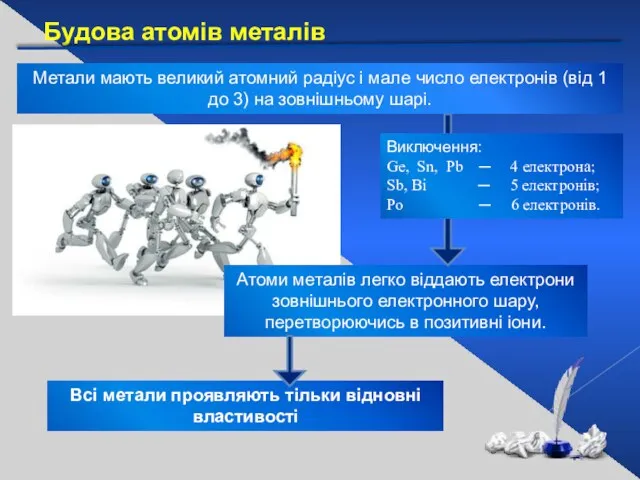
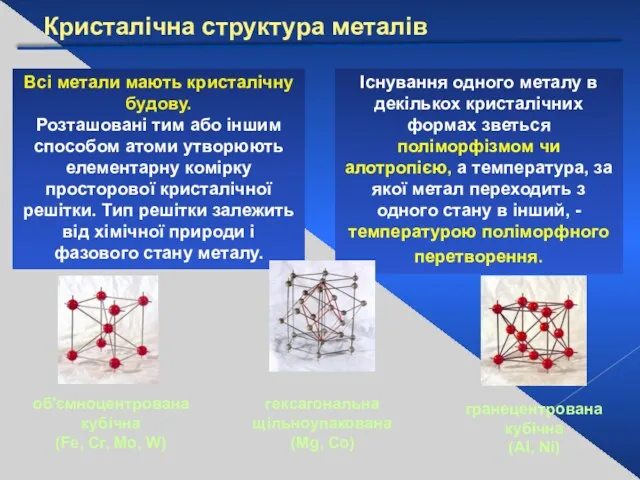





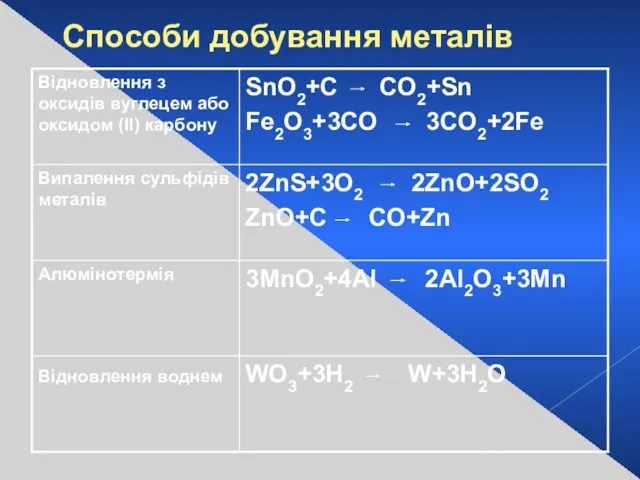
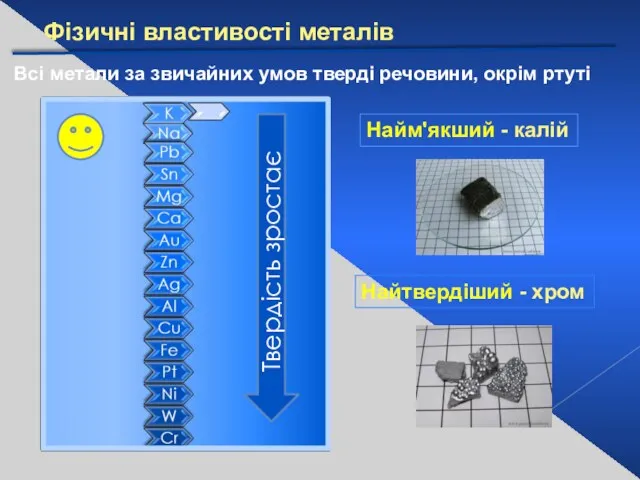


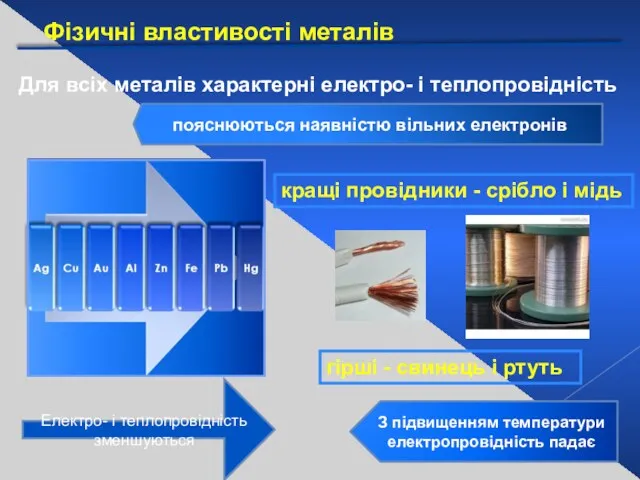
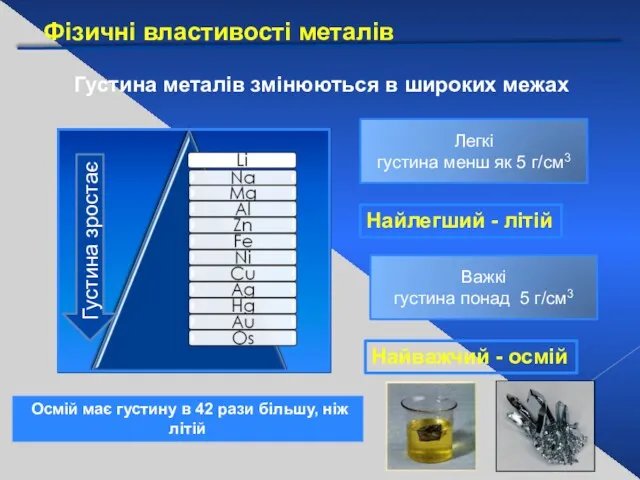

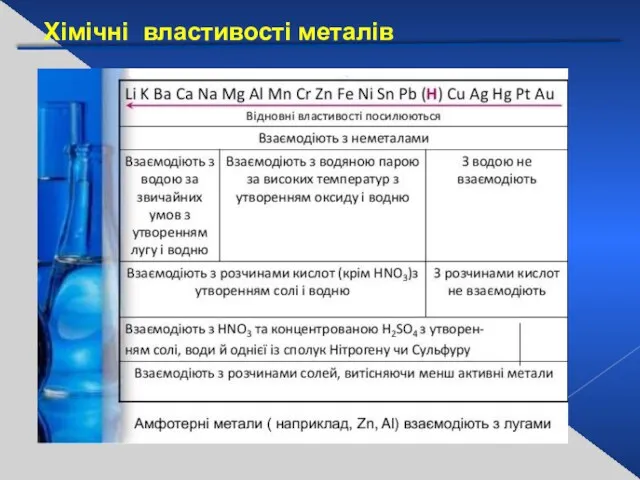

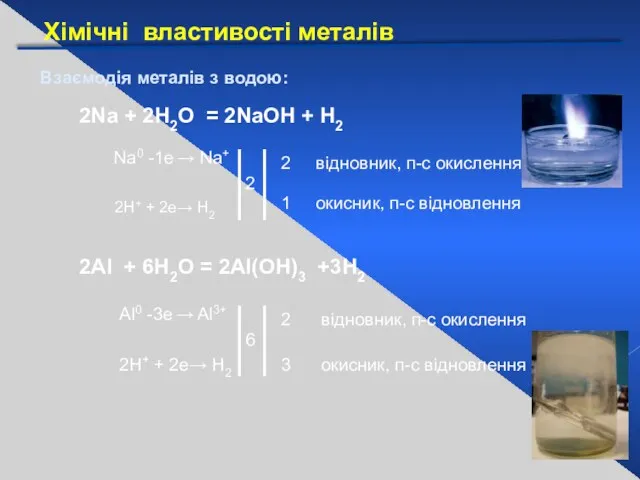
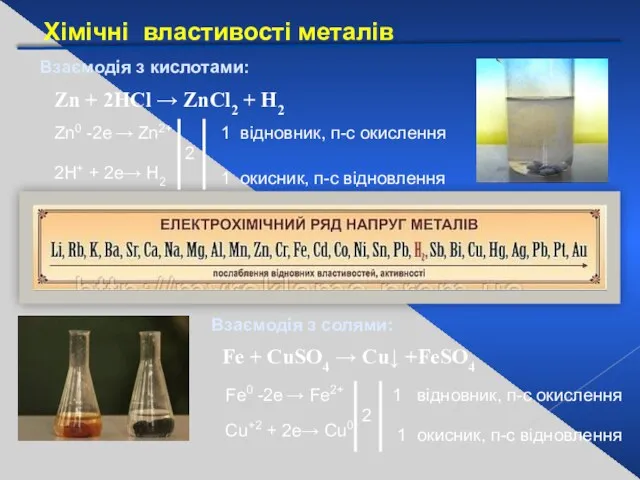

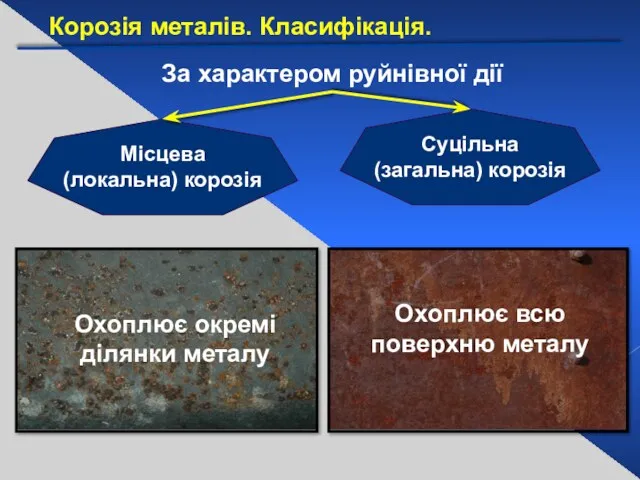

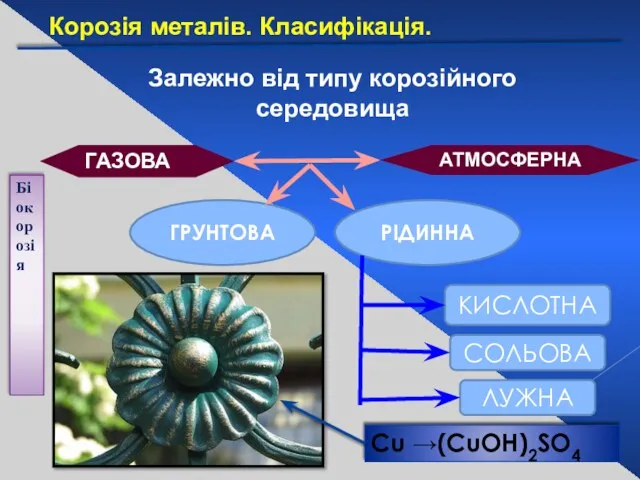
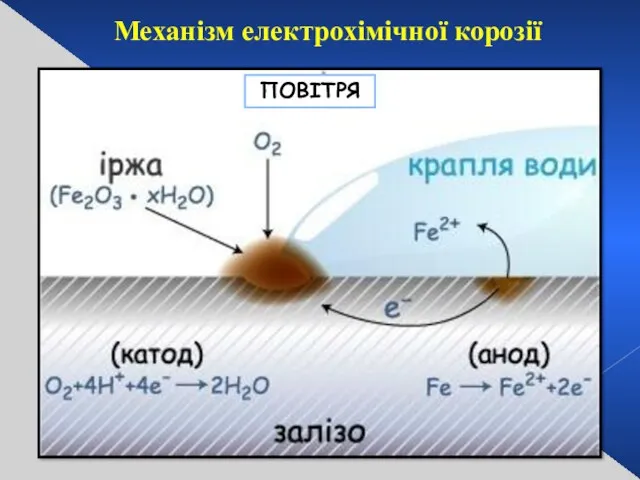
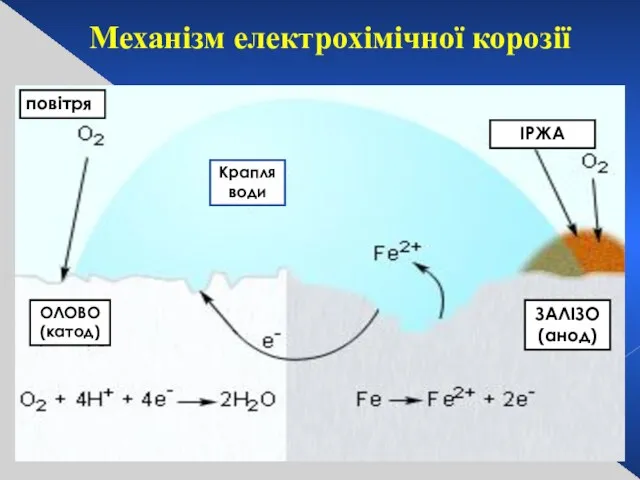
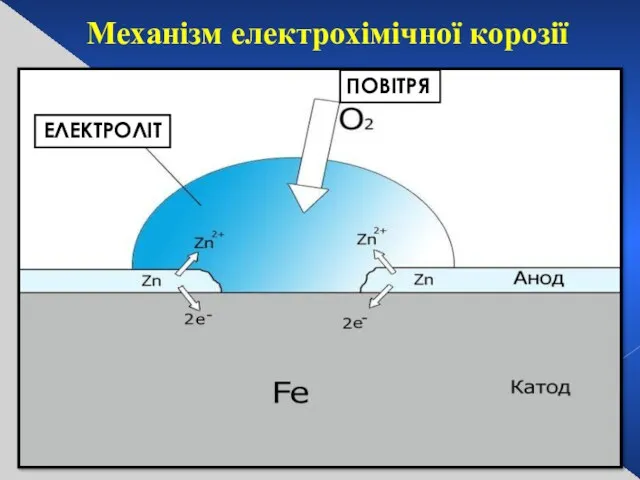

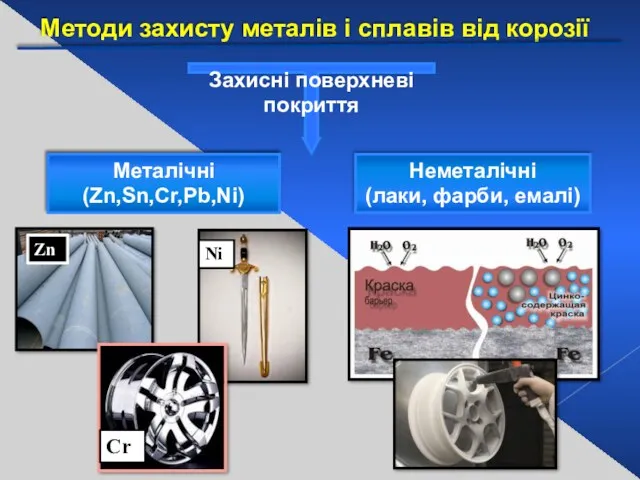
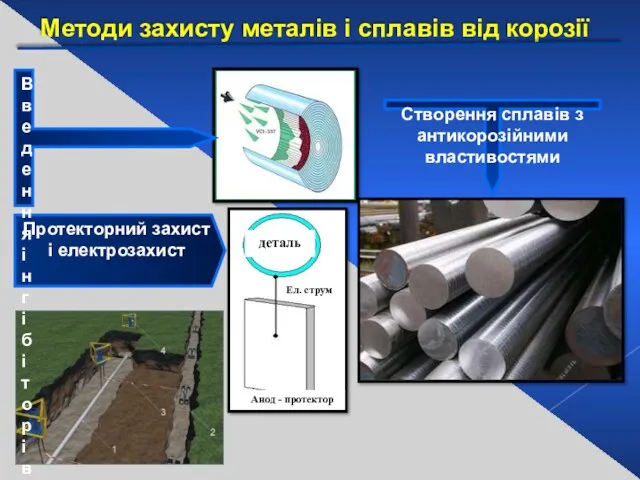
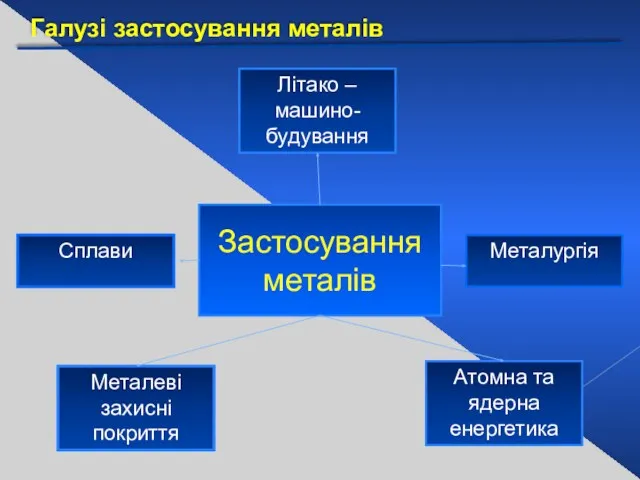








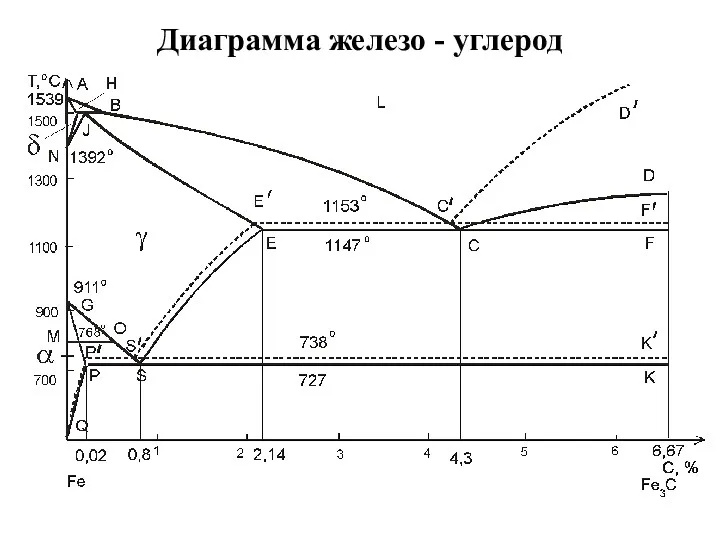 Диаграмма железо - углерод
Диаграмма железо - углерод Соли. Определение солей
Соли. Определение солей Месторождения турмалина
Месторождения турмалина Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс
Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс Алюминий IIIА топ элементі
Алюминий IIIА топ элементі Расчеты по химическим уравнениям. 8 класс
Расчеты по химическим уравнениям. 8 класс Катализ. Классификация каталитических процессов. Механизм действия катализаторов
Катализ. Классификация каталитических процессов. Механизм действия катализаторов Титриметрический метод анализа
Титриметрический метод анализа Періодична система Д.І.Менделєєва
Періодична система Д.І.Менделєєва Металдар мен бейметалдардың салыстырмалы сипаттамасы
Металдар мен бейметалдардың салыстырмалы сипаттамасы Знаки химических элементов
Знаки химических элементов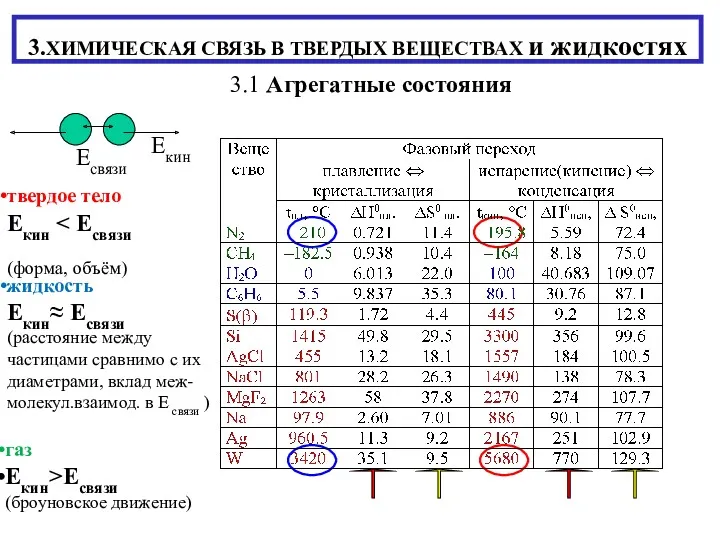 Химическая связь в твердых веществах и жидкостях
Химическая связь в твердых веществах и жидкостях Щелочные металлы
Щелочные металлы Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Задачи, включаемые в задание 33 тестов ЕГЭ
Задачи, включаемые в задание 33 тестов ЕГЭ Аллотропия
Аллотропия Ионная химическая связь
Ионная химическая связь Электролитическая диссоциация
Электролитическая диссоциация Розділ 3. Теорія комплексних сполук. Комплексні сполуки
Розділ 3. Теорія комплексних сполук. Комплексні сполуки Равновесные электрохимические системы
Равновесные электрохимические системы Мінеральні добрива
Мінеральні добрива Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс Титриметрический анализ. Сущность титриметрического анализа
Титриметрический анализ. Сущность титриметрического анализа Липиды
Липиды Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Вода. Химические и физические свойства
Вода. Химические и физические свойства Разделение углеводородных газов
Разделение углеводородных газов