Содержание
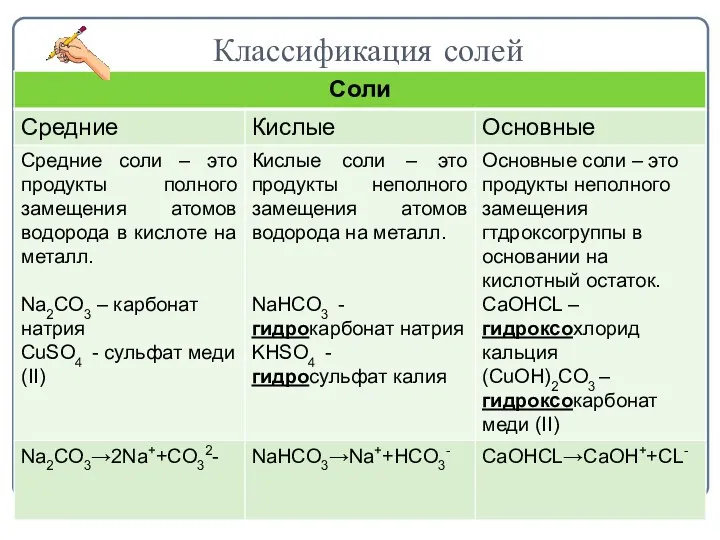
- 2. Определение солей Соли - это сложные вещества, состоящие из ионов металлов и кислотных остатков.
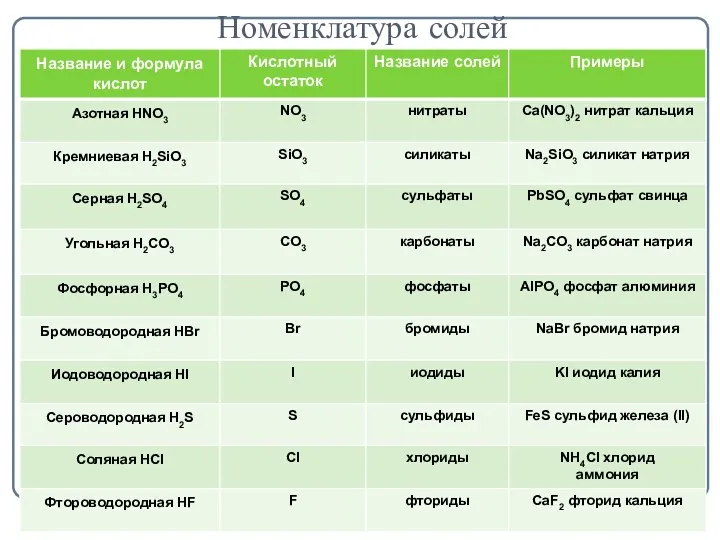
- 3. Номенклатура солей
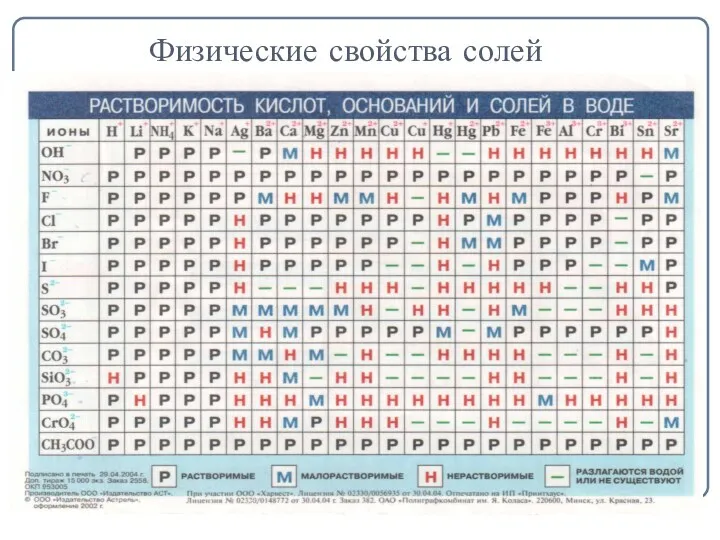
- 4. Физические свойства солей
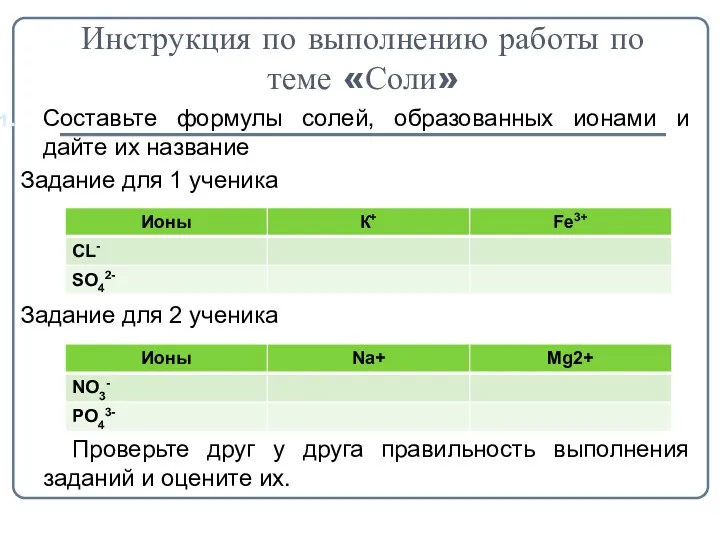
- 5. Инструкция по выполнению работы по теме «Соли» Cоставьте формулы солей, образованных ионами и дайте их название
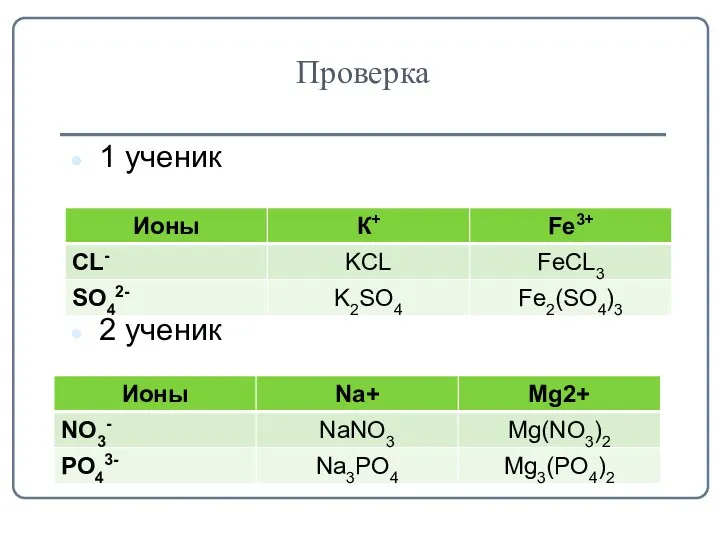
- 6. Проверка 1 ученик 2 ученик
- 7. Классификация солей
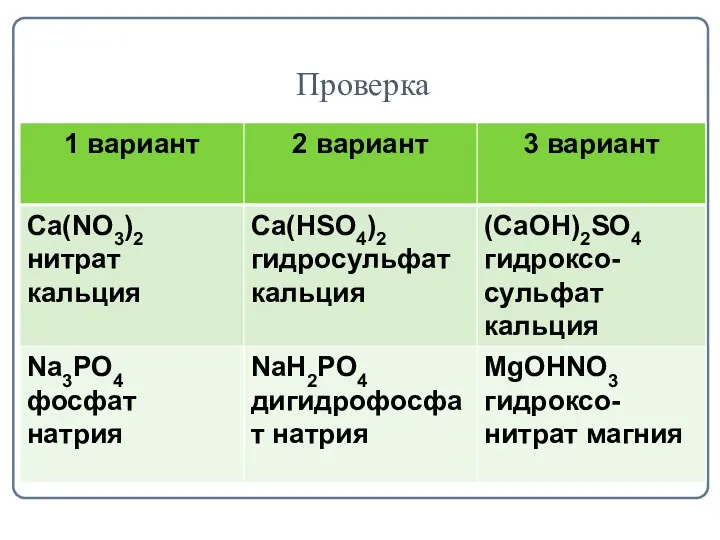
- 8. Классификация солей Задание: Из перечня формул Сa(HSO4)2, (CaOH)2SO4, Ca(NO3)2, NaH2PO4, Na3PO4, MgOHNO3 выпишите отдельно 1 вариант
- 9. Проверка
- 10. Химические свойства солей 1. Соль + кислота → другая соль + кислота (реакция обмена) 2. Соль
- 11. Химические свойства солей Обе соли (и реагирующая и образующая в результате реакции ) должны быть растворимыми;
- 12. Химические свойства солей 1. HgCl2 + Cu → CuCl2 + Hg Hg2+ + 2Cl- + Cu0
- 13. Инструкция по проведению химического исследования 1. Проделайте химическую реакцию взаимодействия раствора нитрата серебра AgNO3 с соляной
- 14. Инструкция по проведению химического исследования 3. Проделайте химическую реакцию взаимодействия раствора сульфата натрия Na2SO4 с раствором
- 15. Проверка 1. HCL + AgNO3 → HNO3 + AgCl↓ Н+ + СL- + Ag+ + NO3-
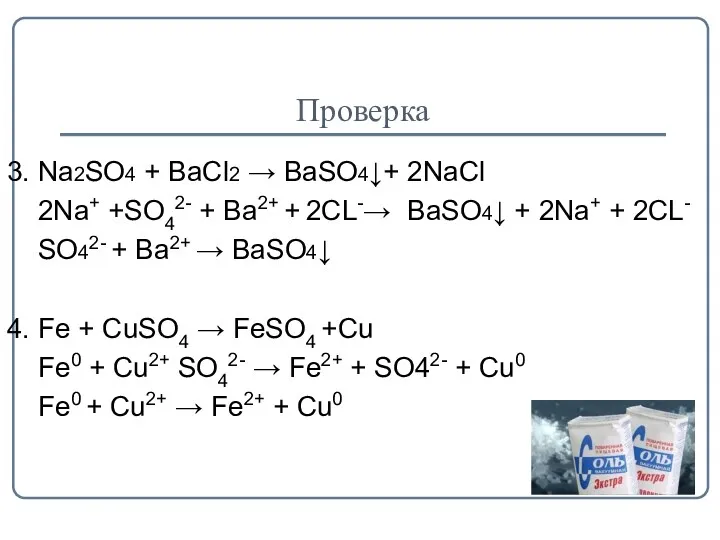
- 16. Проверка 3. Na2SO4 + BaCl2 → BaSO4↓+ 2NaCl 2Na+ +SO42- + Ba2+ + 2CL-→ BaSO4↓ +
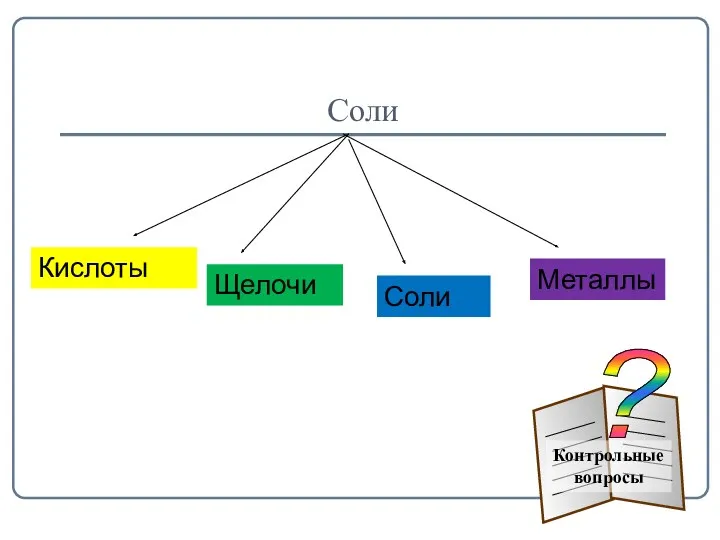
- 17. Соли Кислоты Щелочи Соли Металлы
- 18. Домашнее задание. § 41, упр. 2,4.
- 20. Скачать презентацию









 СОҢҒЫ СТ ДАЙЫНДЫҚ!
СОҢҒЫ СТ ДАЙЫНДЫҚ! Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Алюминий и его соединения
Алюминий и его соединения Строение атома. Тема 2
Строение атома. Тема 2 Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов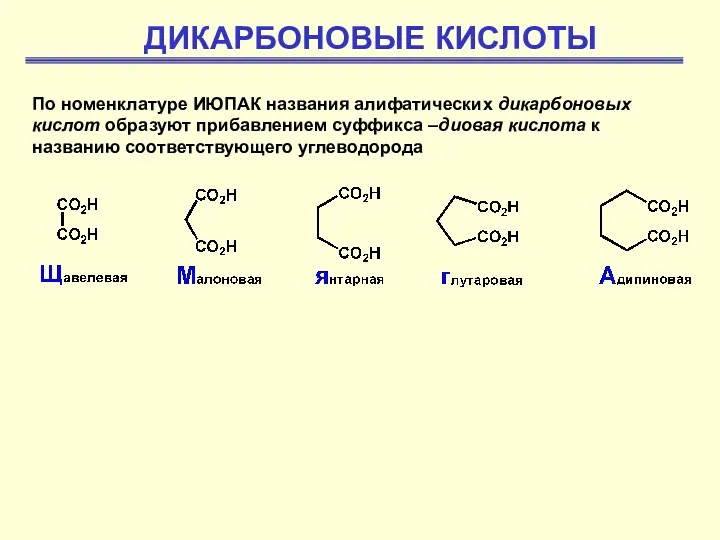 Дикарбоновые кислоты
Дикарбоновые кислоты Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Қоспаларды бөлу әдістері
Қоспаларды бөлу әдістері Углерод
Углерод Органическая химия
Органическая химия Амины. Номенклатура аминов
Амины. Номенклатура аминов Химическая промышленность Донецкой области
Химическая промышленность Донецкой области Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Химия нефти и газа
Химия нефти и газа Галогенопроизводные углеводородов (3)
Галогенопроизводные углеводородов (3) Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Соли, их классификация и свойства
Соли, их классификация и свойства Теория электролитической диссоциации
Теория электролитической диссоциации 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Основные понятия органической химии
Основные понятия органической химии Химия и пища». «Белок – основа жизни
Химия и пища». «Белок – основа жизни Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Галогены. Историческая справка
Галогены. Историческая справка