Содержание
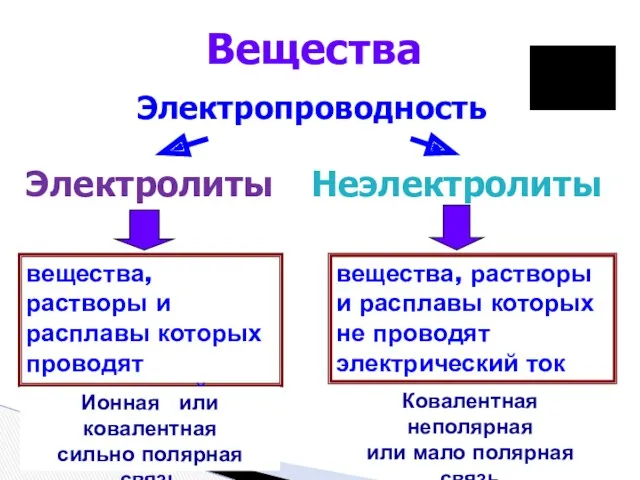
- 2. вещества, растворы и расплавы которых проводят электрический ток Вещества Электропроводность Электролиты Неэлектролиты вещества, растворы и расплавы
- 3. 1) При растворении в воде эл-ты диссоциируют (распадаются) на ⊕ и ⊖ ионы. Процесс распада эл-та
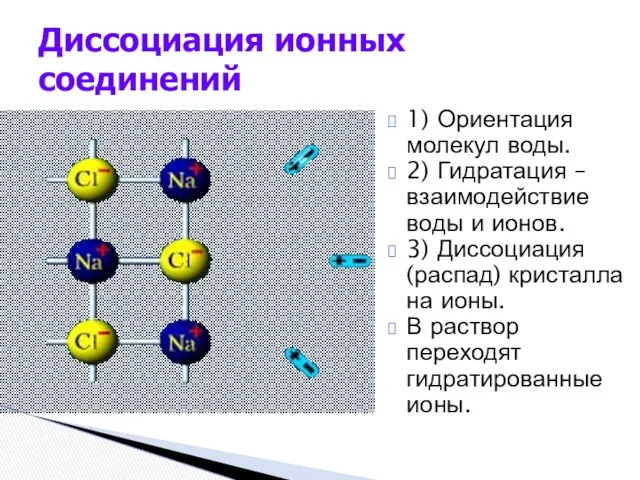
- 4. 1) Ориентация молекул воды. 2) Гидратация – взаимодействие воды и ионов. 3) Диссоциация (распад) кристалла на
- 5. 1) Ориентация молекул воды вокруг полюсов эл-та. 2) Гидратация – взаимодействие воды молекулы эл-та. 3) Ионизация
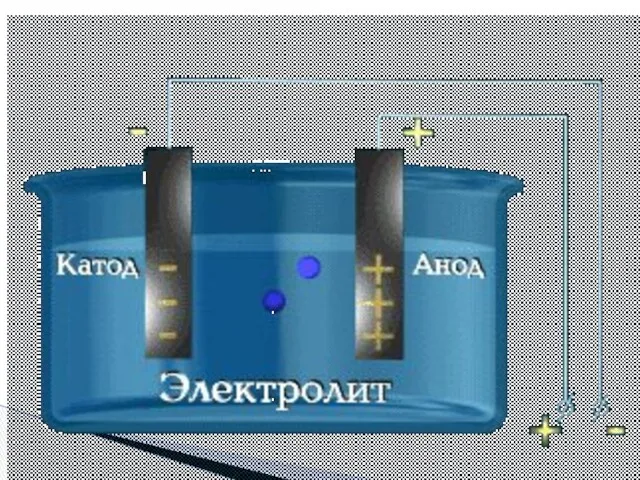
- 6. 2. Под действием электрического тока ⊕ заряженные ионы движутся к ⊖ заряженному полюсу – катоду, поэтому
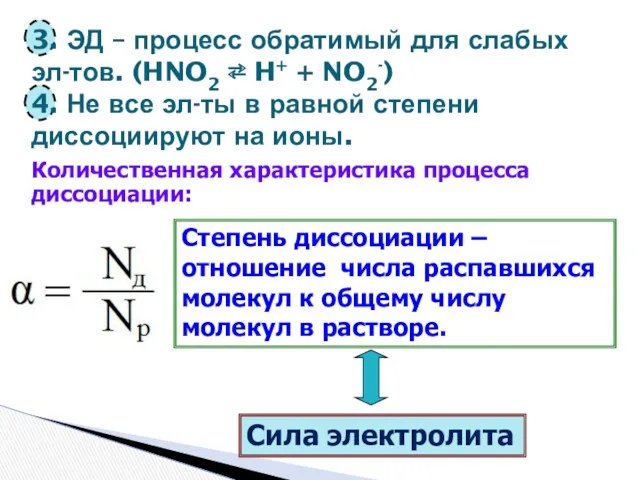
- 8. 3. ЭД – процесс обратимый для слабых эл-тов. (HNO2 ⇄ H+ + NO2-) 4. Не все
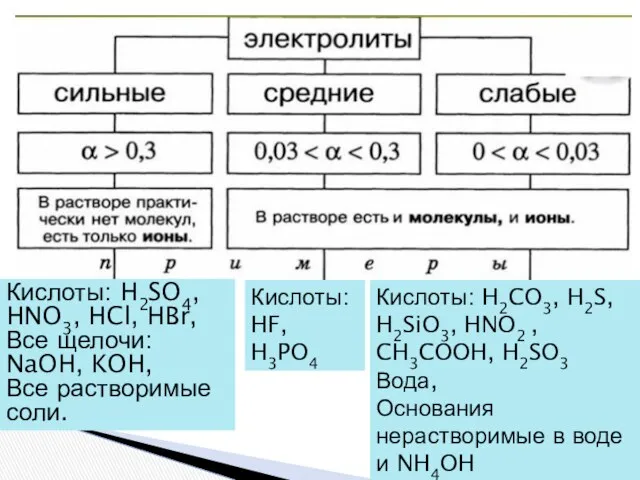
- 9. Кислоты: H2SO4, HNO3, HCl, HBr, Все щелочи: NaOH, KOH, Все растворимые соли. Кислоты:HF, H3PO4 Кислоты: H2CO3,
- 10. ∗ Кислотами называют эл-ты, которые при дис-ции образуют катионы водорода и анионы кислотного остатка: HCl →
- 12. Скачать презентацию




 Кислоты. Серная кислота-H₂SO₄
Кислоты. Серная кислота-H₂SO₄ Кристалічні ґратки. Залежність фізичних властивостей речовини від типів кристалічних ґраток
Кристалічні ґратки. Залежність фізичних властивостей речовини від типів кристалічних ґраток Решение расчетных задач по уравнениям реакций
Решение расчетных задач по уравнениям реакций Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Электролиз кезіндегі химиялық процестер
Электролиз кезіндегі химиялық процестер Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Хімічні властивості кислот
Хімічні властивості кислот Галогены. Элементы VII группы
Галогены. Элементы VII группы Взаимодействие кислоты с основанием (реакция нейтрализации)
Взаимодействие кислоты с основанием (реакция нейтрализации) Алкены, алкины, диены
Алкены, алкины, диены Матеріальний баланс процесу горіння. Основні поняття матеріального балансу горіння
Матеріальний баланс процесу горіння. Основні поняття матеріального балансу горіння Застосування алканів
Застосування алканів Экспертные системы распознавания химических веществ. Тест
Экспертные системы распознавания химических веществ. Тест Роль полимеров в нашей жизни
Роль полимеров в нашей жизни Кристаллические решетки
Кристаллические решетки Механизмы органических реакций
Механизмы органических реакций Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов Багатоядерні ароматичні сполуки
Багатоядерні ароматичні сполуки Полимерные материалы
Полимерные материалы Определение расхода воздуха на горение, количество и температуру продуктов
Определение расхода воздуха на горение, количество и температуру продуктов Disperse systems. True solution
Disperse systems. True solution Амфотерные соединения
Амфотерные соединения Chemical kinetics
Chemical kinetics Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Комплексные (или координационные) соединения
Комплексные (или координационные) соединения Методы оценки плотности и вязкости нефтей и нефтепродуктов
Методы оценки плотности и вязкости нефтей и нефтепродуктов Белки. 9 класс
Белки. 9 класс Минералы и Близнецы
Минералы и Близнецы