Слайд 2
![Образование и номенклатура Комплексные соединения («complex» - сложный) K2SO4+Al2(SO4)3=2KAl(SO4)2 Fe(CN)3+3KCN=K3[Fe(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/232814/slide-1.jpg)
Образование и номенклатура
Комплексные соединения («complex» - сложный)
K2SO4+Al2(SO4)3=2KAl(SO4)2
Fe(CN)3+3KCN=K3[Fe(CN)6]
К аналогичному типу относятся кристаллогидраты
и аммиакаты, содержащие в своих кристаллических решетках молекулы H2O и NH3.
AlCl3+6H2O=[Al(H2O)6]Cl3
CuSO4+4NH3=[Cu(NH3)4]SO4
Такие соединения называются молекулярными. Одни из них диссоциируют в водных растворах на простые ионы:
KAl(SO4)2=K++Al3++2SO42-
И называются двойными солями.
Другие диссоциируют на сложные – комплексные ионы
K3[Fe(CN)6]=3K++[Fe(CN)6]-3
Молекулярные соединения, образующие комплексные ионы, способные к самостоятельному существованию как в кристалле, так и в растворе называются комплексными.
Слайд 3

Координационная теория, предложенная швейцарским химиком, лауреатом Нобелевской премии Альфредом Вернером в
1893 г. ,основана на электростатических представлениях.
1. Центральное место в комплексе занимает комплексообразователь – обычно положительно заряженный ион. В качестве комплексообразователя может выступать практически любой элемент Периодической системы, играющий роль акцептора (кислоты Льюиса).
2. Вокруг комплексообразователя расположены (или координированы) лиганды, т.е. ионы противоположного знака или нейтральные молекулы, обладающие постоянным дипольным моментом ( и т.д.).
Слайд 4

3. Комплексообразователь и лиганды за счет сил электростатического притяжения образуют внутреннюю
сферу (комплексный ион), обязательно выделяемую квадратными скобками.
4. Число лигандов вокруг комплексообразователя называют координационным числом к.ч..
5. Ионы, находящиеся за внутренней сферой, образуют внешнюю сферу комплекса и связаны с ним в основном силами электростатического взаимодействия.
Слайд 5

Лиганды отталкиваются друг от друга и энергия отталкивания будет тем больше,
чем больше лигандов окружают центральный ион. С увеличением числа лигандов комплекс становится все менее и менее устойчивым. Следствием этого являются определенные значения координационных чисел. К.ч. для различных комплексообразователей могут принимать широкий спектр значений (обычно от 1 до 12). При этом многие центральные атомы образуют комплексы с переменным к.ч. Так, у редкоземельных элементов к.ч. может меняться от 6 до 12, для меди (II) известны комплексы с к.ч.=4,5,6 .
Слайд 6
![Состав комплексного соединения [Cu(NH3)4]SO4 следующий: Cu2+ - ион-комплексообразователь, NH3 -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/232814/slide-5.jpg)
Состав комплексного соединения [Cu(NH3)4]SO4 следующий:
Cu2+ - ион-комплексообразователь,
NH3 - лиганды, координационное
число равно 4,
SO42- - ион внешней сферы.
Слайд 7

Типичными комплексообразователями являются d и f элементы, которые образуют особенно разнообразные
комплексные соединения, ионы неметаллов в различной положительной степени окисления
B3+ - [BH4]-, Si4+ - [SiF6]2-, Sb5+ - [SbCl6]-, P5+ - [PF6]- и др.).
Слайд 8

Слайд 9
Слайд 10
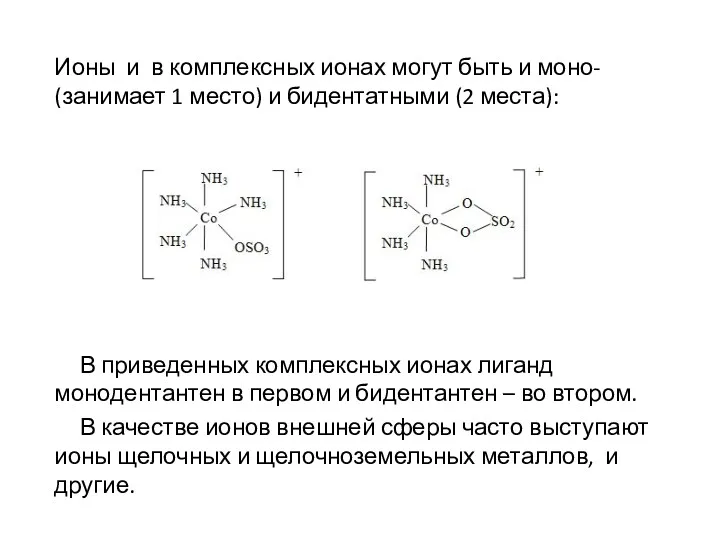
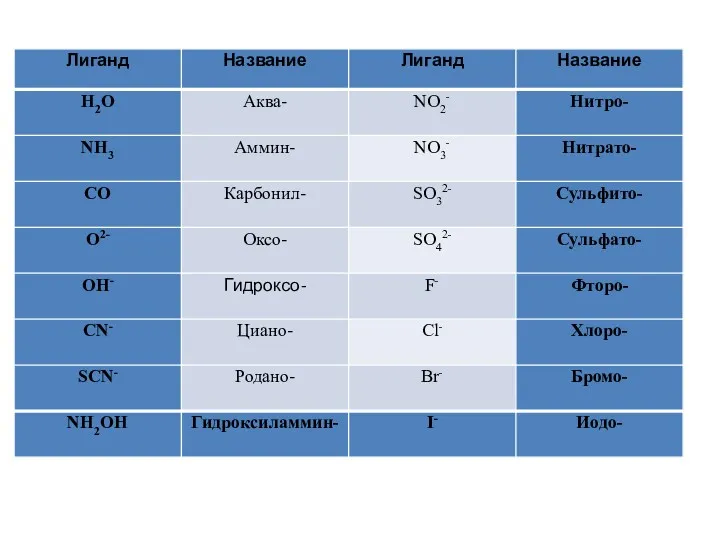
Ионы и в комплексных ионах могут быть и моно- (занимает 1
место) и бидентатными (2 места):
В приведенных комплексных ионах лиганд монодентантен в первом и бидентантен – во втором.
В качестве ионов внешней сферы часто выступают ионы щелочных и щелочноземельных металлов, и другие.
Слайд 11

При вычислении заряда комплексообразователя следует исходить из правила, что алгебраическая сумма
зарядов частиц, образующих комплексное соединение, равна нулю; при этом заряд комплексообразователя принимается равным его степени окисления.
Заряд комплексного иона равен алгебраической сумме заряда иона-комплексообразователя и лигандов
Слайд 12

Слайд 13

Названия комплексных соединений образуются в соответствии с зарядами их комплексных ионов.
а)
Если в соединение входит комплексный катион, то сначала называют ион внешней сферы, затем лиганды. Причем, если лигандов несколько, то сначала называют число их с использованием греческих числительных: ди , три , тетра , пента , гекса , гепта , окта и названия отрицательно заряженных лигандов с окончанием –о-; затем указывают числа и названия нейтральных лигандов; последним называют комплексообразователь с указанием его степени окисления римскими цифрами в круглых скобках после названия.
Например: [Co(NH3)5Br]SO4 сульфат бромопентаамминкобальта II
б) Если в соединение входит комплексный анион, то сначала называют число лигандов, далее называют элемент комплексообразователь, используя его латинское название с добавлением суффикса (феррат, хромат, платинат) и указанием его степени окисления также в круглых скобках; последним называют элемент внешней сферы.
Ba[Cr(NH3)2(SCN)4] 2 тетрароданодиамминхромат (3) бария;
(NH4)2[Pt(OH)2Cl4] тетрахлородигидроксоплатинат (4) аммония.
Слайд 14

ксав) Название нейтральных комплексов составляют из названий лигандов (справа налево во
внутренней сфере). затем называют комплексообразователь в именительном падеже без указания степени его окисления, так как она однозначно определяется, исходя из электронейтральности комплекса.
дихлородиамминплатина;итные, электрические и т.д.).
Слайд 15

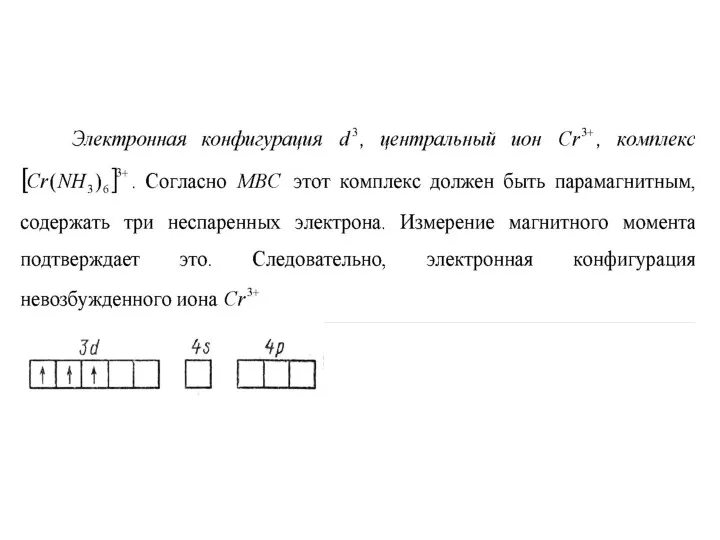
Метод валентных связей
Теория валентный связей развита Лайнусом Полингом в 30-е
гг. прошлого столетия. Ее достоинством является большая наглядность. Согласно этой теории каждый лиганд является донором электронов. Он размещает свои электронные пары на свободных орбиталях центрального иона металла. Если это октаэдрический комплекс, свободные орбитали центрального иона (или атома) металла направлены к вершинам октаэдра, если тетраэдрический комплекс — к вершинам тетраэдра, плоский квадрат — к вершинам квадрата.
Слайд 16
Слайд 17

Слайд 18

Слайд 19

Слайд 20

Слайд 21

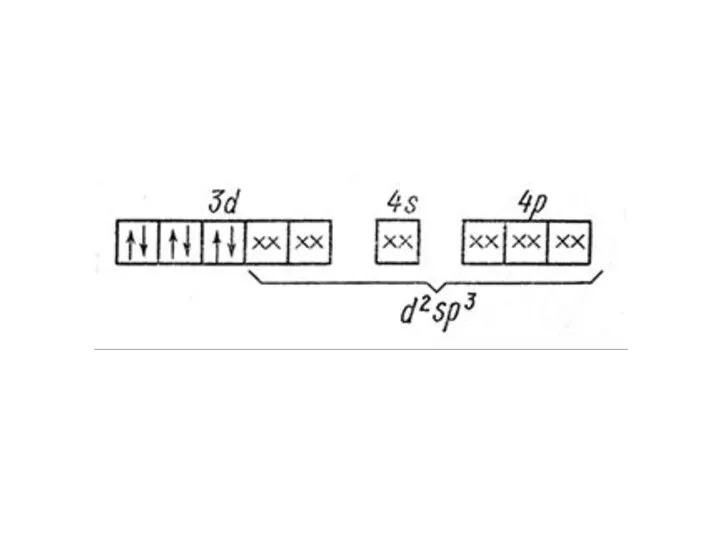
1. спарить электроны на подуровне;
2. распределить их в соответствии с правилом
Гунда на более высоколежащие в энергетическом отношении орбитали, т.е. на следующий энергетический уровень. Ясно, что энергетически более выгоден первый вариант:
Слайд 22

Слайд 23
Слайд 24

Слайд 25

Слайд 26

И те и другие образуются за счет донорно-акцепторных связей. Во внутриорбитальных
комплексах электронные пары лиганда размещаются на свободных внутренних орбиталях иона-комплексообразователя, а во внешнеорбитальных комплексах — на внешних орбиталях, обладающих более высокой энергией; чем внутренние.
Слайд 27

Слайд 28

Слайд 29
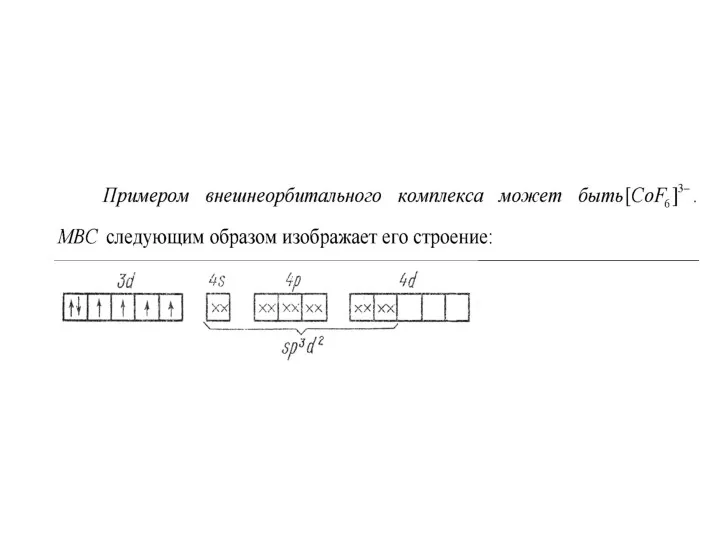
Слайд 30

Слайд 31

Слайд 32

Слайд 33

Теория кристаллического поля
Теория кристаллического поля является развитием простой электростатической теории образования
комплексов. Она лучше всего применима к соединениям элементов и позволила достаточно полно объяснить их свойства. Суть этой теории состоит в следующем: химическая связь в комплексе осуществляется за счет электростатического взаимодействия между положительно заряженным центральным атомом и лигандами, которые рассматриваются как точечные отрицательные заряды или диполи, располагающиеся в пространстве так, чтобы достигалась минимальная энергия отталкивания этих зарядов
Слайд 34

Таким образом, в это условие выполняется, если лиганды располагаются в вершинах
октаэдра (при координационном числе центрального иона равном 6 ) или в вершинах тетраэдра (при координационном числе 4 ), т.е. рассматривается влияние лигандов на d- орбитали комплексообразователя.
Слайд 35
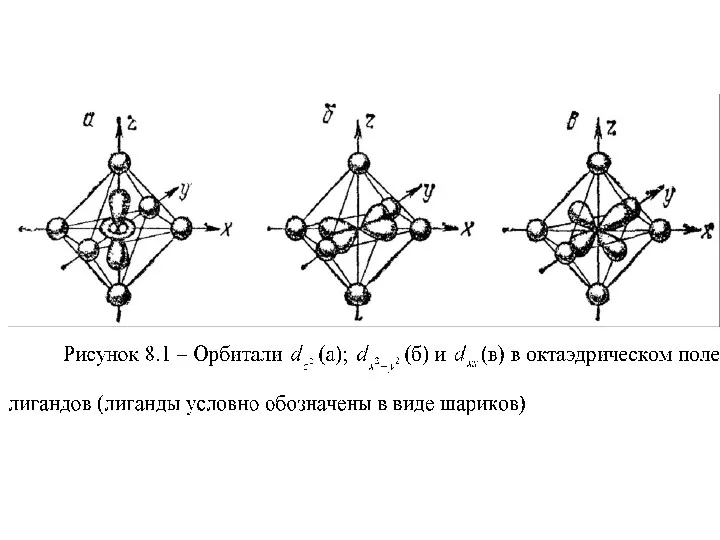
Слайд 36

Слайд 37

Слайд 38

Слайд 39

Слайд 40
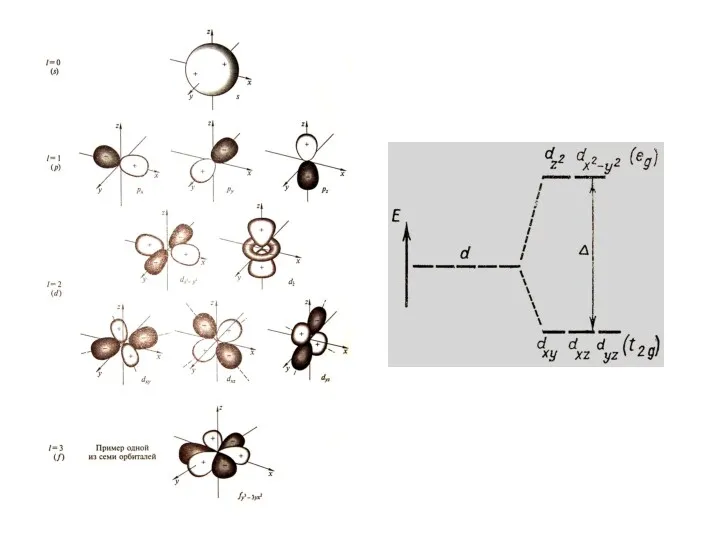
Слайд 41

Слайд 42
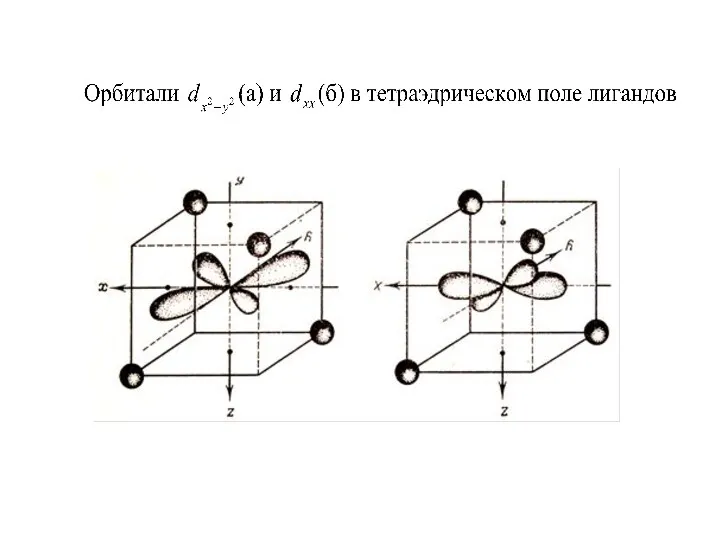
Слайд 43

Слайд 44

Слайд 45
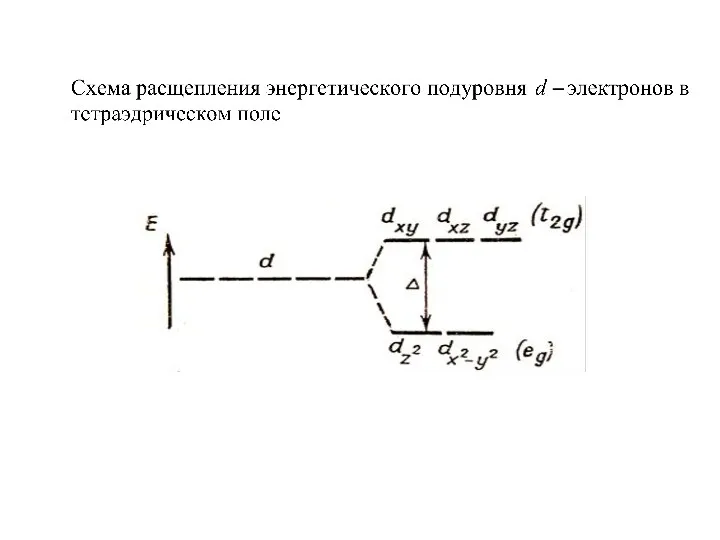
Слайд 46

Слайд 47
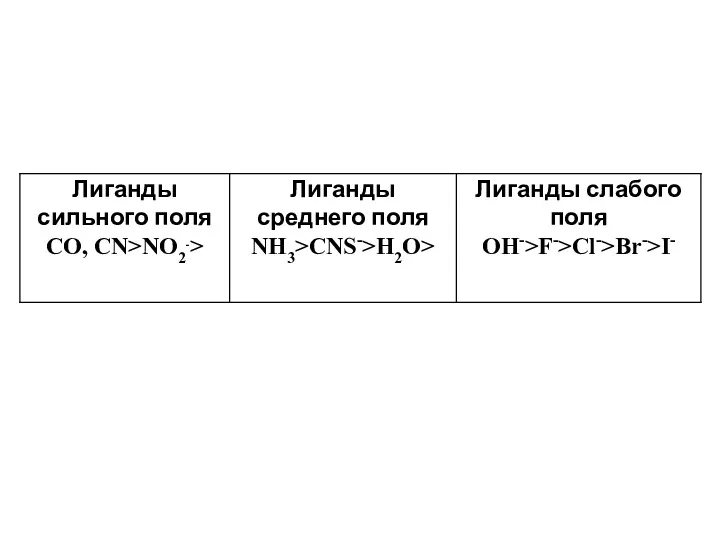
Слайд 48

Этот ряд, называемый спектрохимическим, был найден в результате экспериментального исследования комплексов.
Однако не в состоянии объяснить такое расположение лигандов, связанное с их электронной структурой, поскольку данная теория не принимает ее во внимание. Так как параметр расщепления зависит от типа координации центрального атома, его заряда, электронной конфигурации и природы лиганда, то кратко рассмотрим влияние каждого из них.
Слайд 49

Слайд 50

Слайд 51

Слайд 52

Слайд 53

Слайд 54

Слайд 55

Слайд 56

Слайд 57
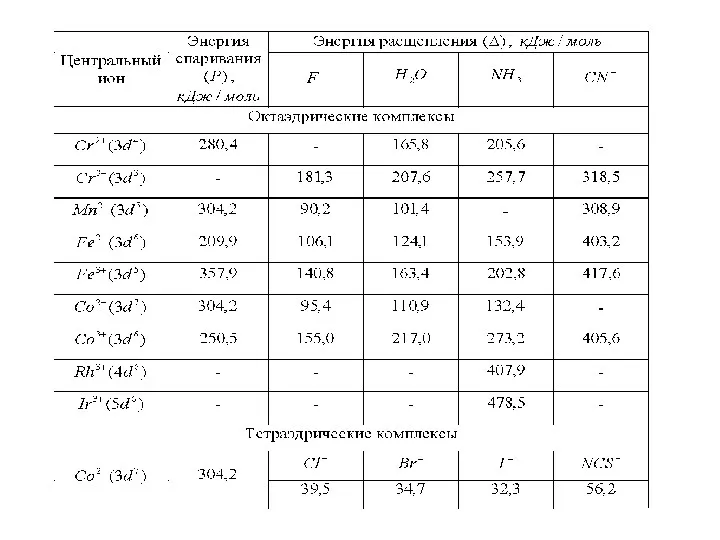
Слайд 58

Слайд 59

Слайд 60

Слайд 61
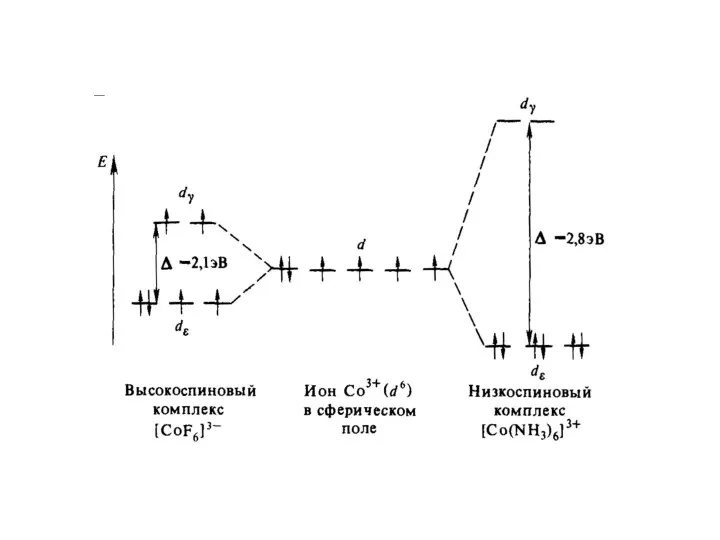
Слайд 62

Слайд 63

Слайд 64

Изомерия комплексных соединений
Изомеры – вещества, имеющие одинаковый количественный и качественный состав,
но различное строение, а, следовательно, и различные свойства.
Слайд 65

Слайд 66
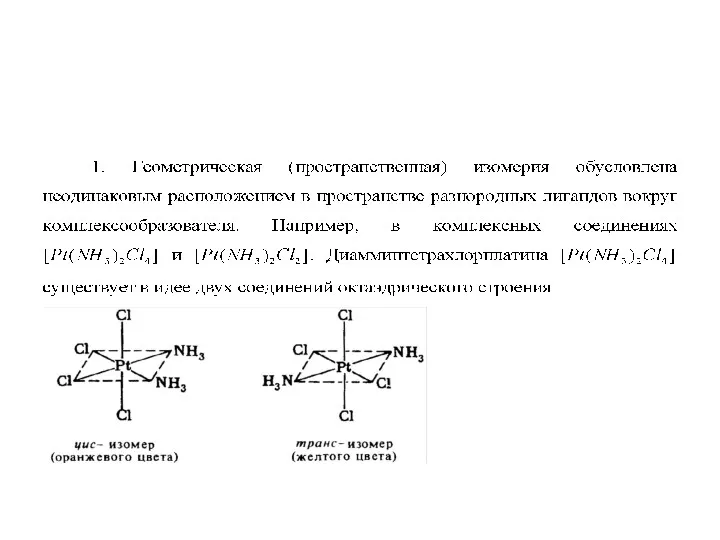
Слайд 67

Слайд 68

Слайд 69

Слайд 70
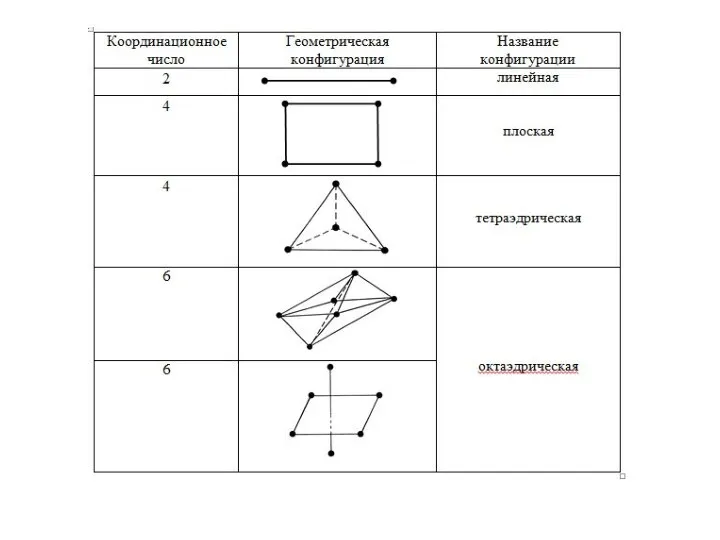
Слайд 71

Слайд 72

Слайд 73

![Образование и номенклатура Комплексные соединения («complex» - сложный) K2SO4+Al2(SO4)3=2KAl(SO4)2 Fe(CN)3+3KCN=K3[Fe(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/232814/slide-1.jpg)



![Состав комплексного соединения [Cu(NH3)4]SO4 следующий: Cu2+ - ион-комплексообразователь, NH3 -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/232814/slide-5.jpg)



































































 Химические свойства кислот в свете теории электролитической диссоциации
Химические свойства кислот в свете теории электролитической диссоциации Расчет материального и теплового баланса процесса пиролиза гексана
Расчет материального и теплового баланса процесса пиролиза гексана Активационный анализ
Активационный анализ Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде
Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде Непредельные углеводороды
Непредельные углеводороды Моноядерні арени
Моноядерні арени Титриметрический метод анализа
Титриметрический метод анализа Основы коррозии и защиты металлов
Основы коррозии и защиты металлов Особенности дисперсных систем
Особенности дисперсных систем Решение задачи №4. Старость - на радость. Команда Карбораны
Решение задачи №4. Старость - на радость. Команда Карбораны Сплавы и коррозия металлов
Сплавы и коррозия металлов Основания. Значение оснований
Основания. Значение оснований Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Дослідження методів очищення висококольорових поверхневих вод
Дослідження методів очищення висококольорових поверхневих вод Изменения, происходящие с белками в процессах технологической переработки сырья
Изменения, происходящие с белками в процессах технологической переработки сырья Свинец
Свинец Separation amp confirmation
Separation amp confirmation Количественная характеристика растворов, растворение, растворимость
Количественная характеристика растворов, растворение, растворимость Тепловой эффект химической реакции
Тепловой эффект химической реакции Вода з точки зору хімії
Вода з точки зору хімії Циклоалкандар
Циклоалкандар Основи. Хімія
Основи. Хімія Металлы. Определения. Положение в периодической системе. Металлы в алхимии
Металлы. Определения. Положение в периодической системе. Металлы в алхимии Соли (12 класс)
Соли (12 класс) Крахмал. Строение вещества. Физические и химические свойства
Крахмал. Строение вещества. Физические и химические свойства Гидрокарбонат натрия NaHCO₃
Гидрокарбонат натрия NaHCO₃ Натуральный каучук
Натуральный каучук Требования к осадителю
Требования к осадителю