Содержание
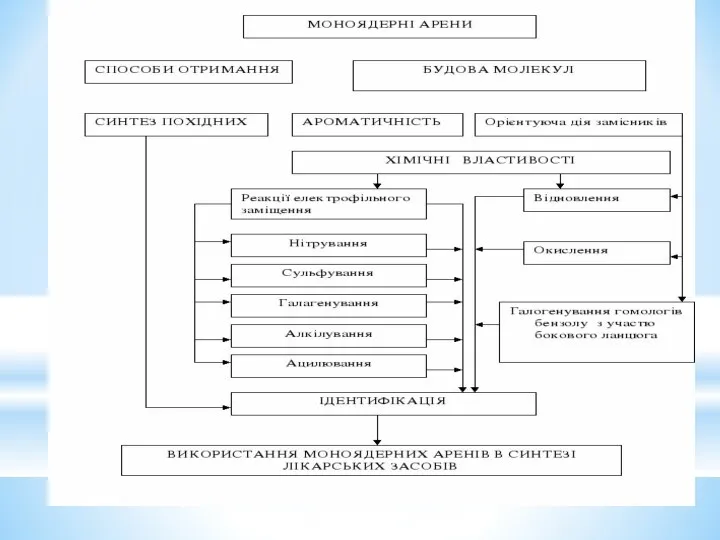
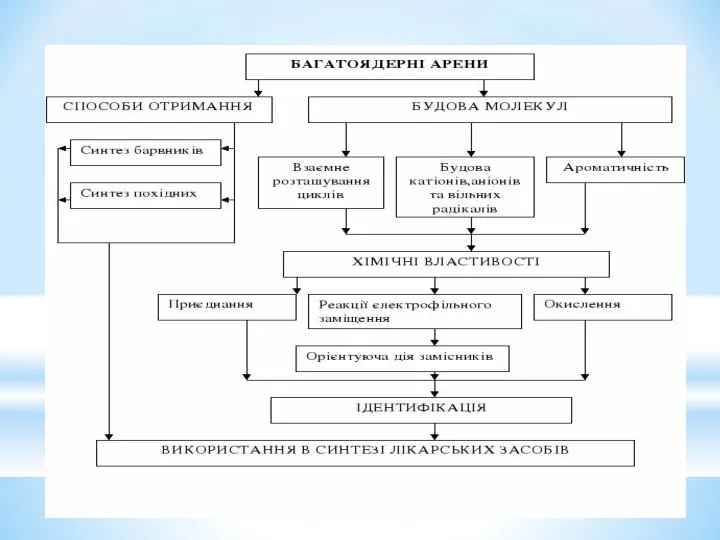
- 2. 1. Електронна будова бензолу. Ароматичні властивості. Загальні критерії ароматичності. 2. Номенклатура та ізомерія моноядерних аренів. 3.
- 5. Вуглеводні: ароматичні Назва класу вуглеводню Загальна формула Тип гібридизації атома Карбону Основний тип реакції Особливості будови,
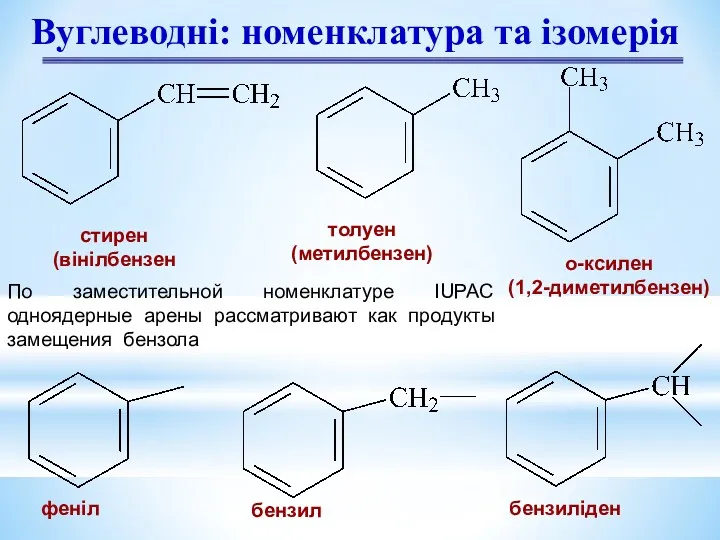
- 6. Вуглеводні: номенклатура та ізомерія стирен (вінілбензен толуен (метилбензен) о-ксилен (1,2-диметилбензен) феніл бензил бензиліден По заместительной номенклатуре
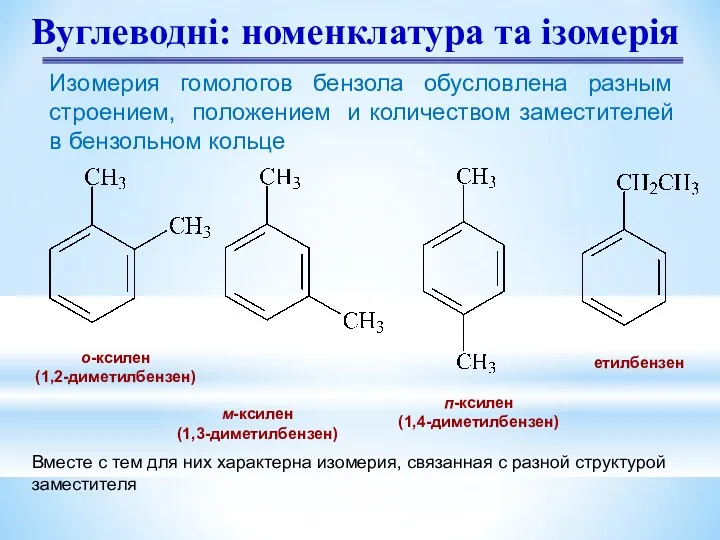
- 7. Вуглеводні: номенклатура та ізомерія о-ксилен (1,2-диметилбензен) м-ксилен (1,3-диметилбензен) п-ксилен (1,4-диметилбензен) етилбензен Изомерия гомологов бензола обусловлена разным
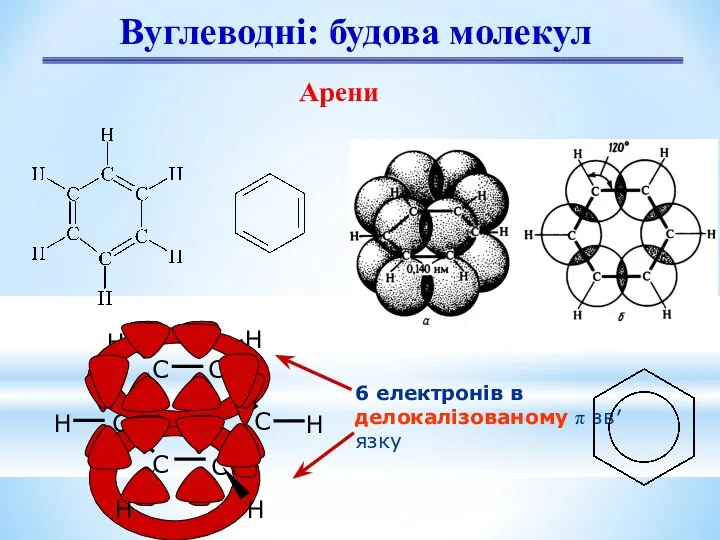
- 8. Вуглеводні: будова молекул Арени 6 електронів в делокалізованому π зв′язку
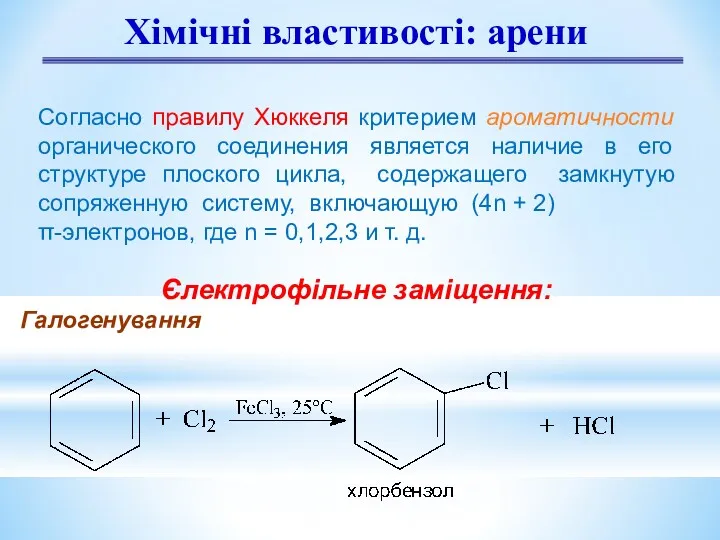
- 9. Хімічні властивості: арени Єлектрофільне заміщення: Галогенування Согласно правилу Хюккеля критерием ароматичности органического соединения является наличие в
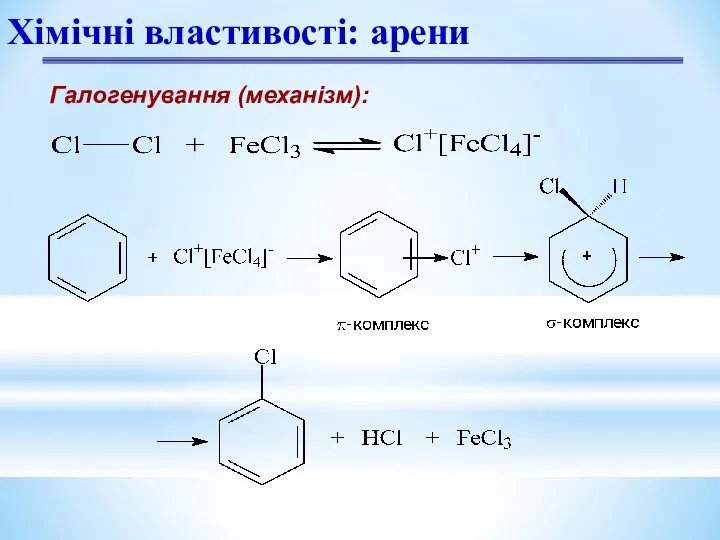
- 10. Галогенування (механізм): Хімічні властивості: арени
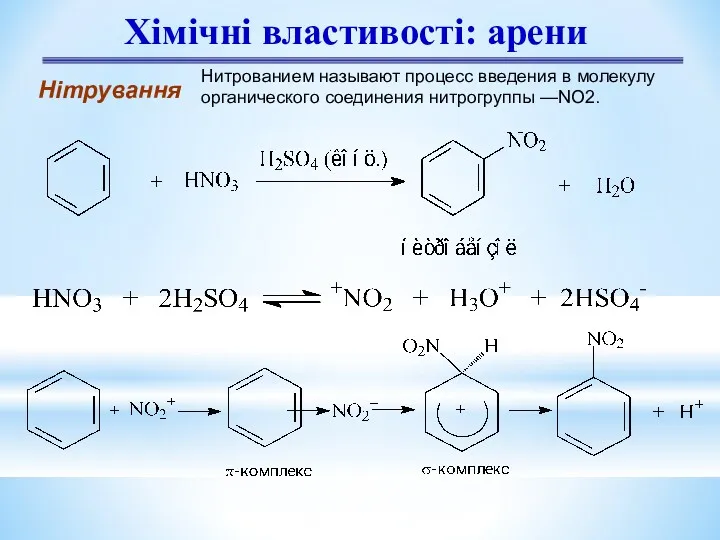
- 11. Хімічні властивості: арени Нітрування Нитрованием называют процесс введения в молекулу органического соединения нитрогруппы —NO2.
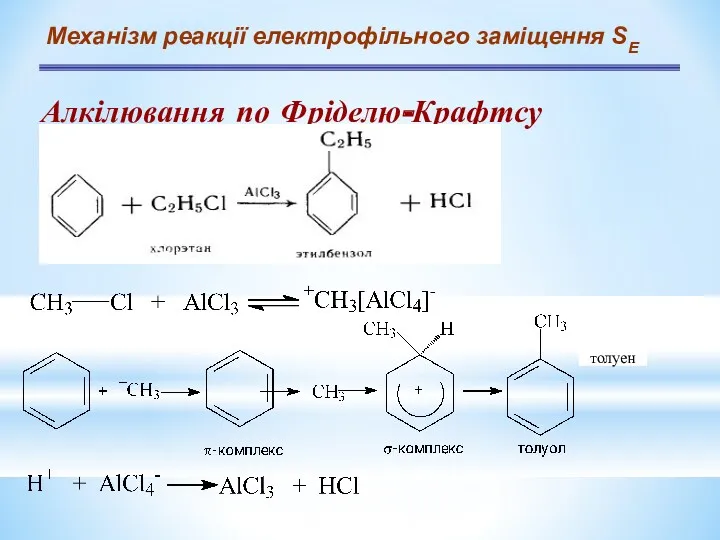
- 12. Механізм реакції електрофільного заміщення SЕ Алкілювання по Фріделю-Крафтсу толуен
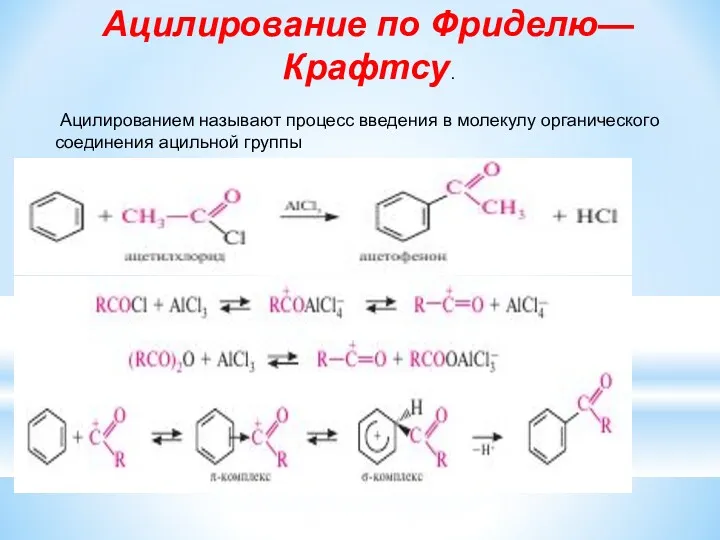
- 13. Ацилирование по Фриделю—Крафтсу. Ацилированием называют процесс введения в молекулу органического соединения ацильной группы
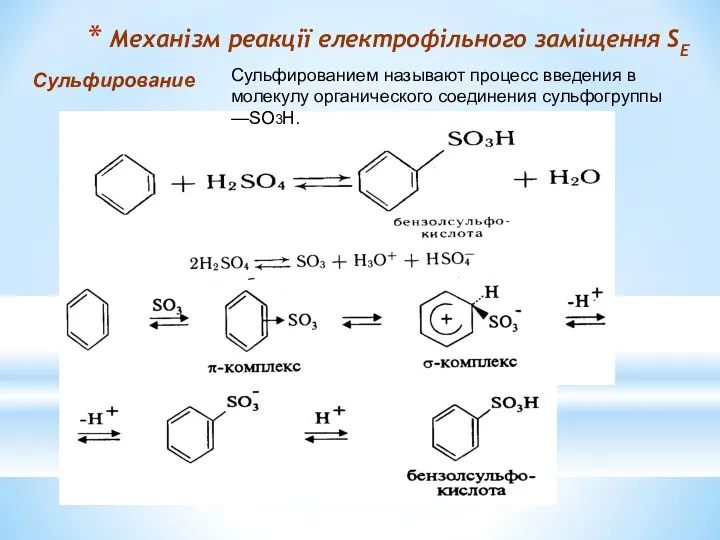
- 14. Механізм реакції електрофільного заміщення SЕ Сульфирование Сульфированием называют процесс введения в молекулу органического соединения сульфогруппы —SO3H.
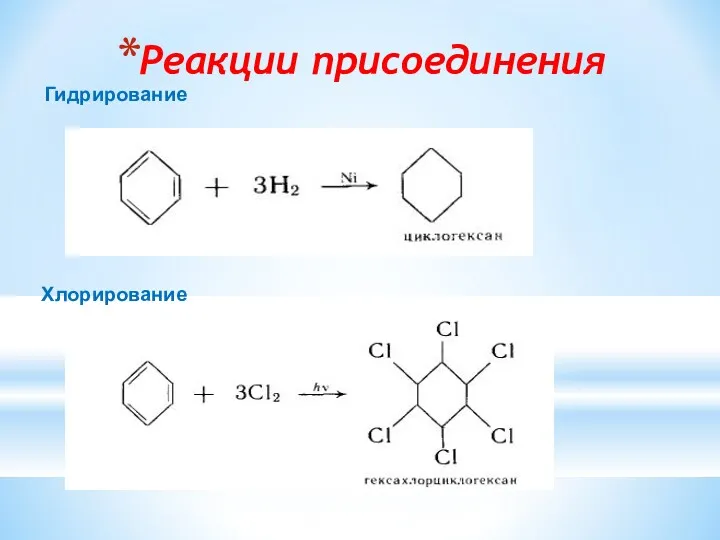
- 15. Реакции присоединения Гидрирование Хлорирование
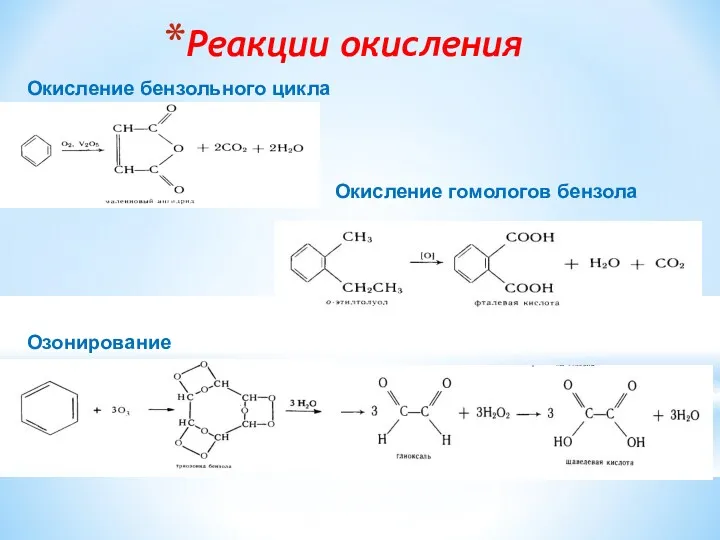
- 16. Реакции окисления Окисление бензольного цикла Окисление гомологов бензола Озонирование
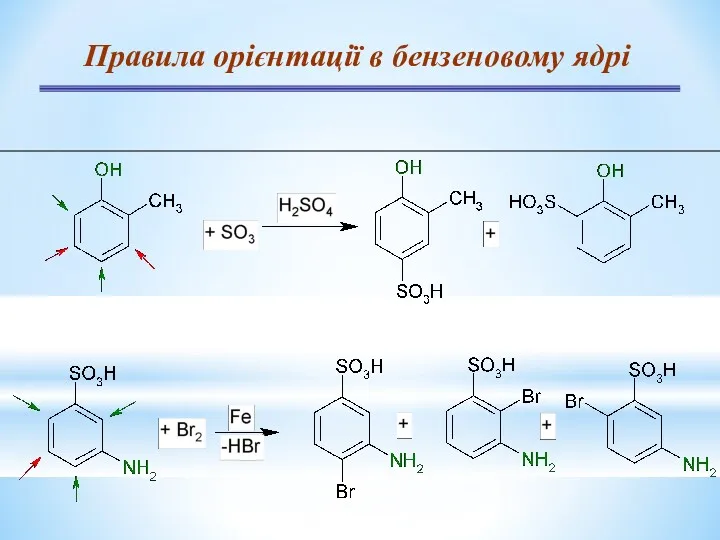
- 17. Правила орієнтації – замісники І роду Замісники (орієнтанти) І роду – орто- і пара-положення: Активуючі, електронодонорні
- 18. Правила орієнтації – замісники ІІ роду Замісники (орієнтанти) ІІ роду – замісники мета-положення: —CN, —СООН, —SO3H,
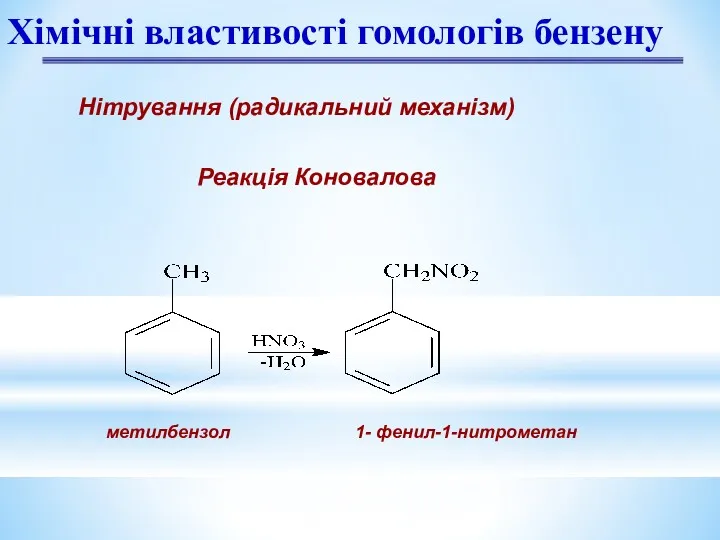
- 19. Нітрування (радикальний механізм) Реакція Коновалова Хімічні властивості гомологів бензену метилбензол 1- фенил-1-нитрометан
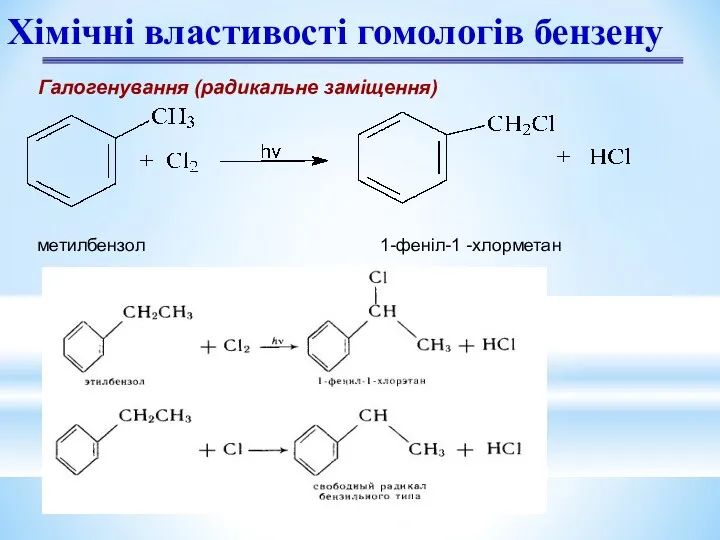
- 20. Хімічні властивості гомологів бензену Галогенування (радикальне заміщення) метилбензол 1-феніл-1 -хлорметан
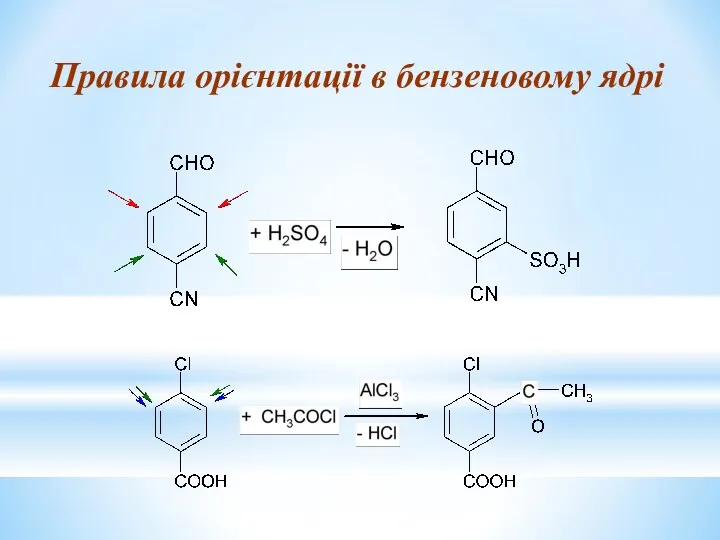
- 21. При согласованной ориентации оба имеющихся заместителя направляют новую группу в одни и те же положения бензольного
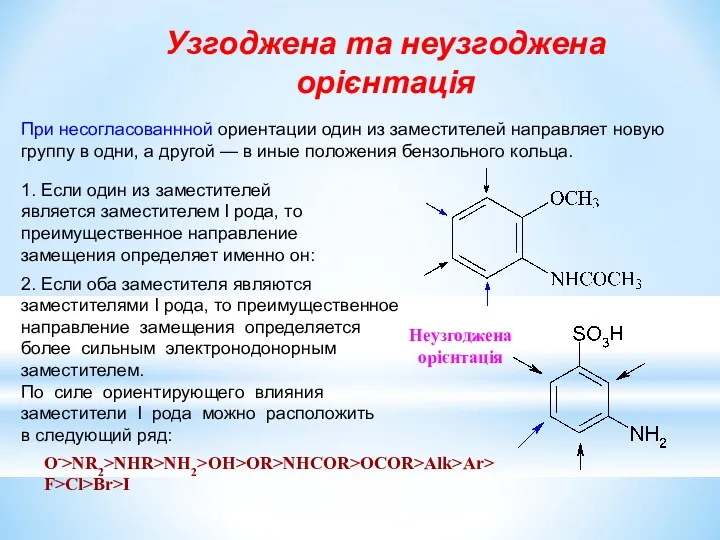
- 22. При несогласованнной ориентации один из заместителей направляет новую группу в одни, а другой — в иные
- 23. 3. Если оба заместителя являются заместителями II рода, электрофильное замещение осуществляется с большим трудом, а преимущественное
- 24. Правила орієнтації в бензеновому ядрі
- 25. Правила орієнтації в бензеновому ядрі
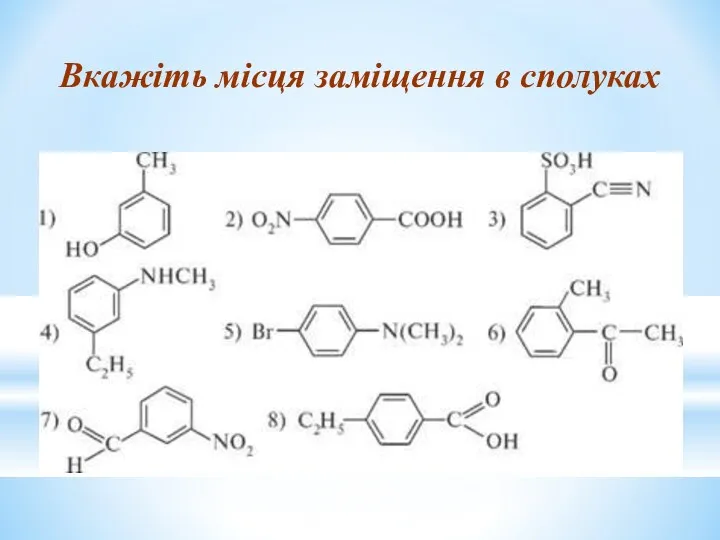
- 26. Вкажіть місця заміщення в сполуках
- 28. Дякую за увагу!
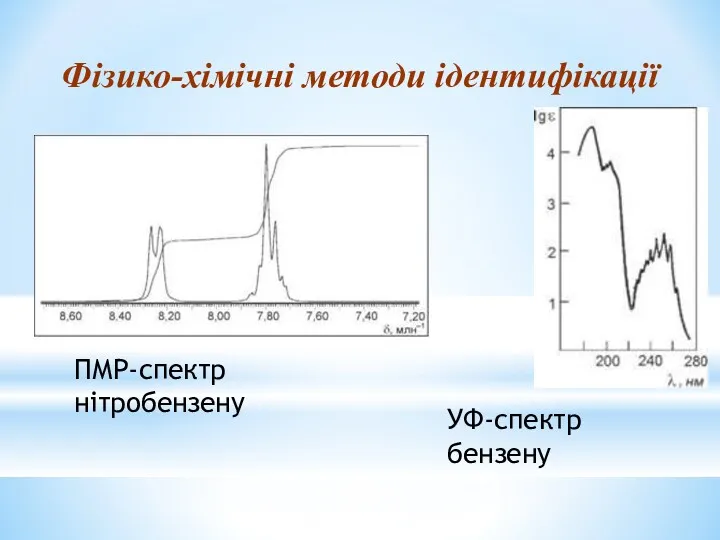
- 29. Фізико-хімічні методи ідентифікації ПМР-спектр нітробензену УФ-спектр бензену
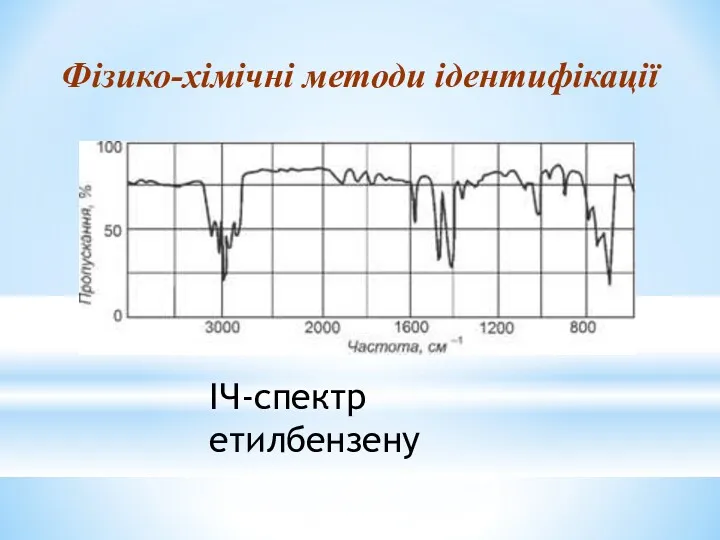
- 30. ІЧ-спектр етилбензену Фізико-хімічні методи ідентифікації
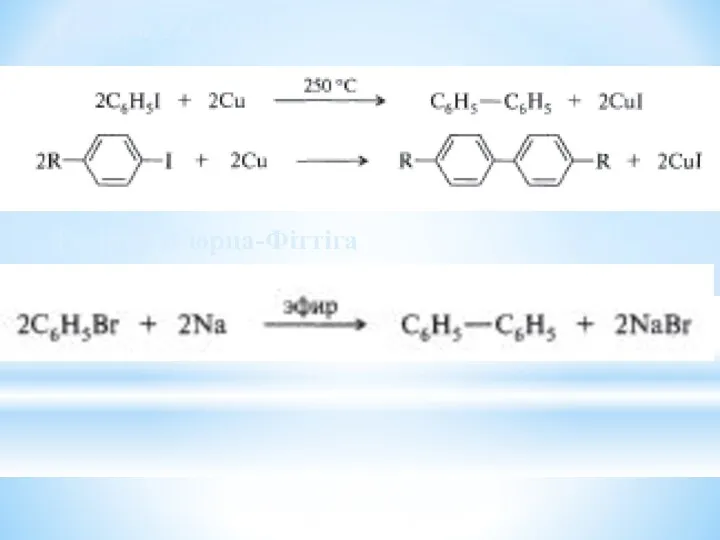
- 31. Реакція Ульмана Реакція В´юрца-Фіттіга
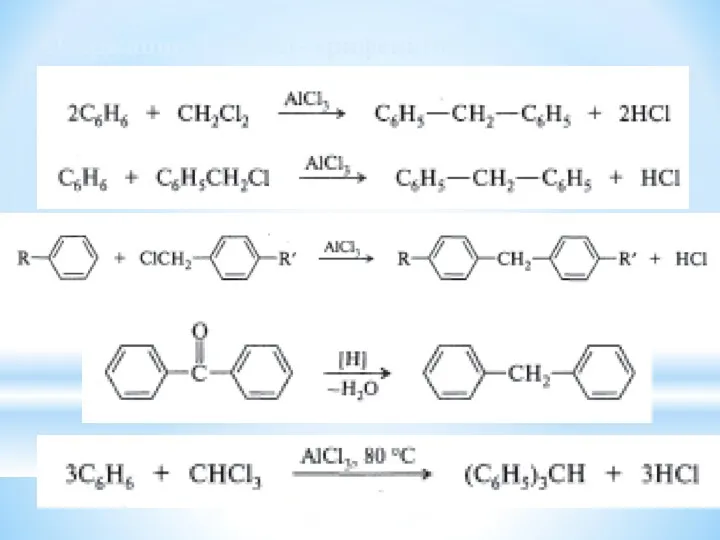
- 32. Одержання дифеніл- трифенілметану
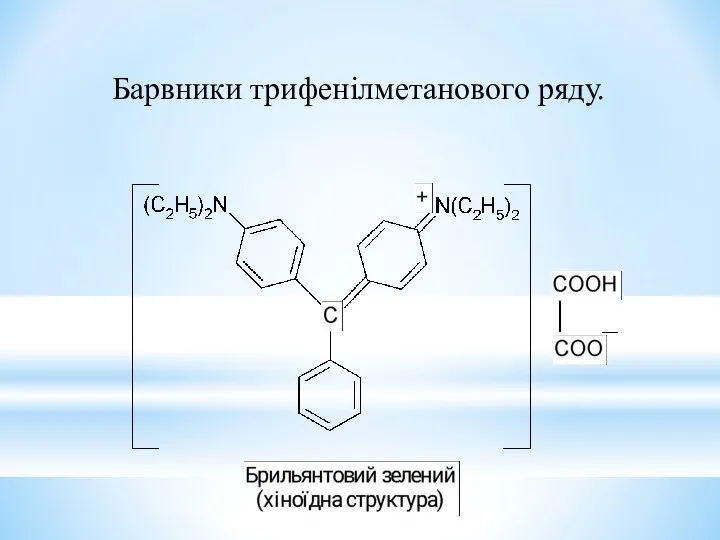
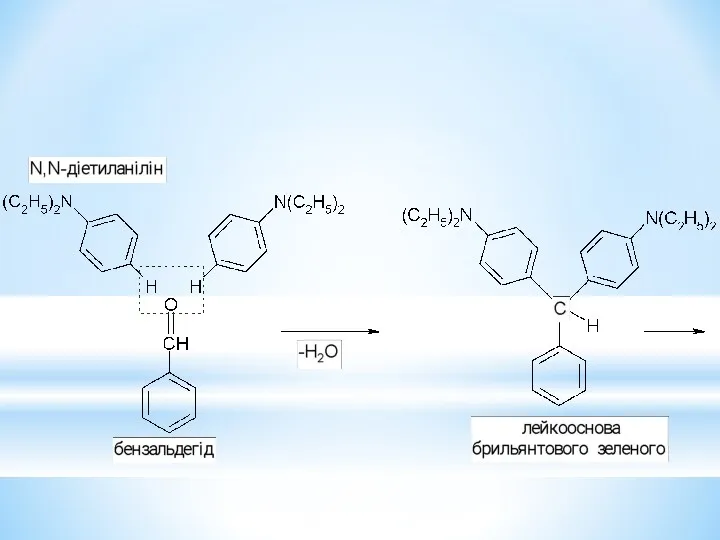
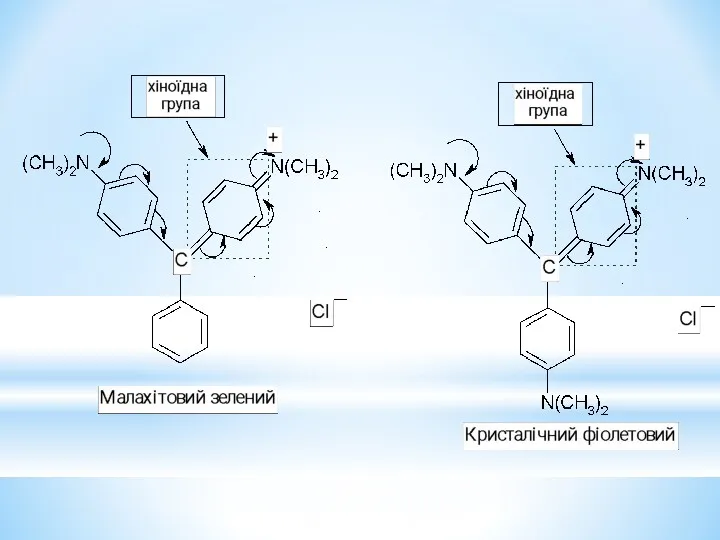
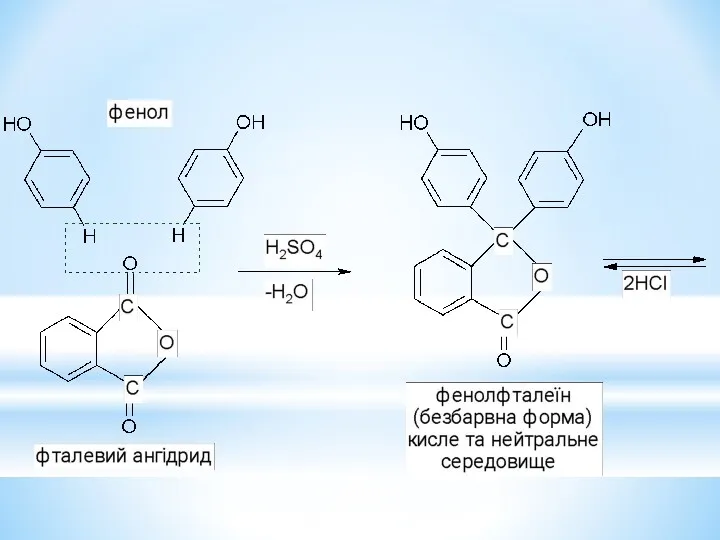
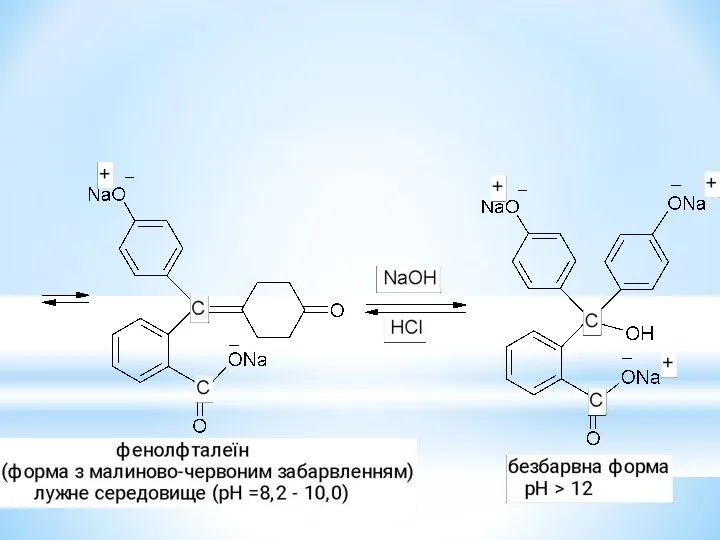
- 33. Барвники трифенілметанового ряду.
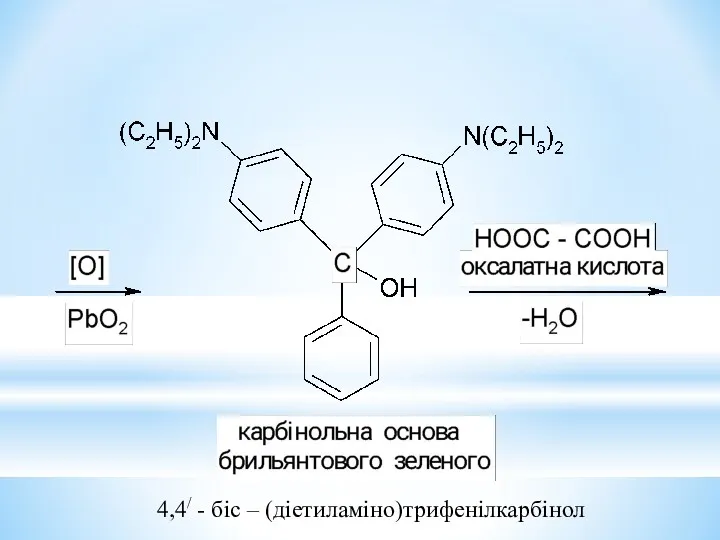
- 35. 4,4/ - біс – (діетиламіно)трифенілкарбінол
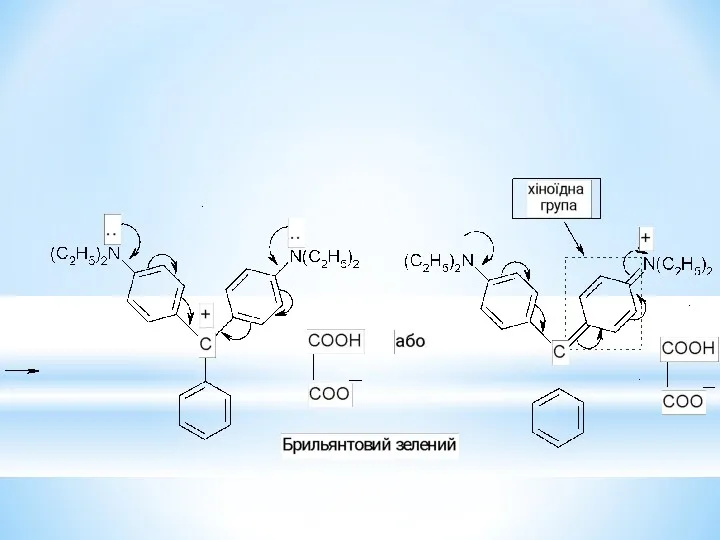
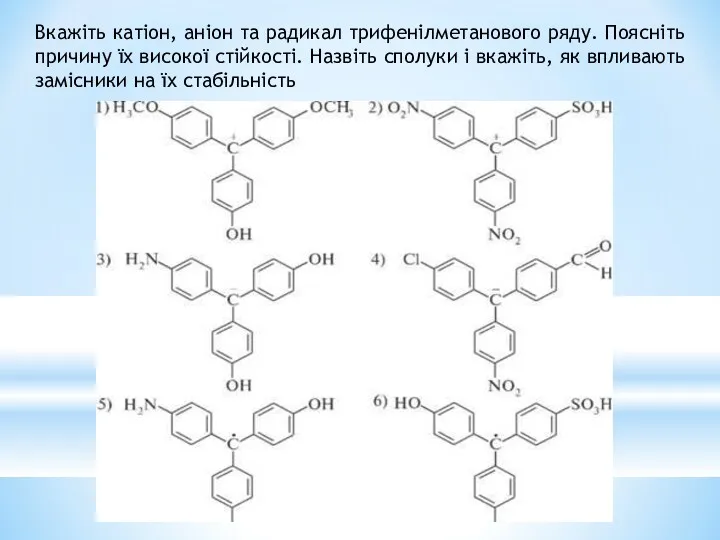
- 40. Вкажіть катіон, аніон та радикал трифенілметанового ряду. Поясніть причину їх високої стійкості. Назвіть сполуки і вкажіть,
- 42. Скачать презентацию







 Фазовые равновесия. Физическая и коллоидная химия
Фазовые равновесия. Физическая и коллоидная химия
 Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Получение и распознавание водорода
Получение и распознавание водорода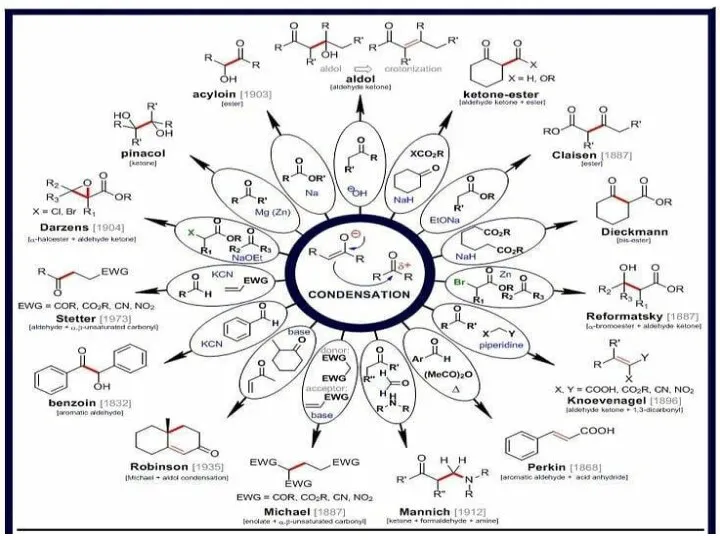 Альдольные реакции енолятов
Альдольные реакции енолятов Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Вода – это жизнь!
Вода – это жизнь! Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды)
Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды) Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Металлические сплавы
Металлические сплавы Химическая кинетика
Химическая кинетика Ненасыщенные (непредельные) алифатические углеводороды. Алкены
Ненасыщенные (непредельные) алифатические углеводороды. Алкены Получение галогенов. Биологическое значение и применение галогенов
Получение галогенов. Биологическое значение и применение галогенов Равновесия в растворах электролитов
Равновесия в растворах электролитов Электроотрицательность. Степень окисления. Валентность
Электроотрицательность. Степень окисления. Валентность Первичная переработка нефти
Первичная переработка нефти Оксиды. Названия оксидов
Оксиды. Названия оксидов Свойства смесей ПАВ
Свойства смесей ПАВ Типы химических реакций
Типы химических реакций Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Химическая кинетика. Раздел 2
Химическая кинетика. Раздел 2 Фармацевтический анализ лекарственных средств группы алкилуреидов сульфокислот
Фармацевтический анализ лекарственных средств группы алкилуреидов сульфокислот Основы общей химии. Тема 1
Основы общей химии. Тема 1 Водно-химический режим ТЭС. Основные задачи, организация и виды ВХР. Предотвращение коррозии, борьба с отложениями
Водно-химический режим ТЭС. Основные задачи, организация и виды ВХР. Предотвращение коррозии, борьба с отложениями Олово и свинец
Олово и свинец