Содержание
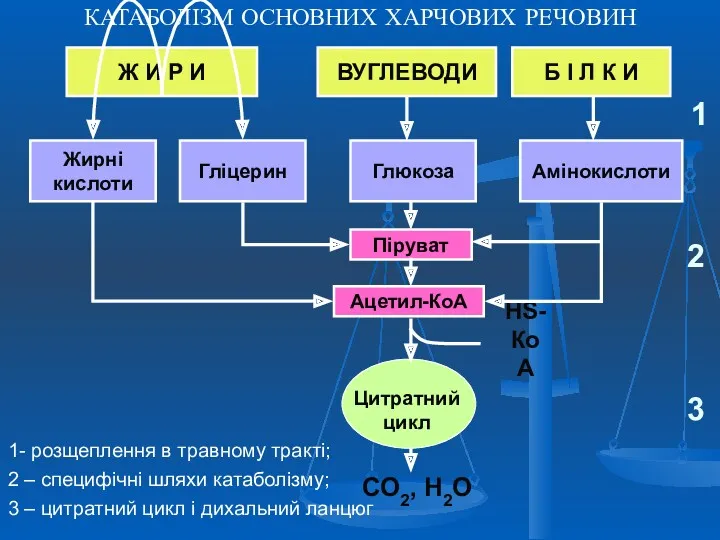
- 3. ОСНОВНІ ФУНКЦІЇ БІЛКІВ Основні структурні компоненти органів і тканин, а також усіх клітинних органел. Енергетична функція
- 4. ОСНОВНІ ФУНКЦІЇ БІЛКІВ
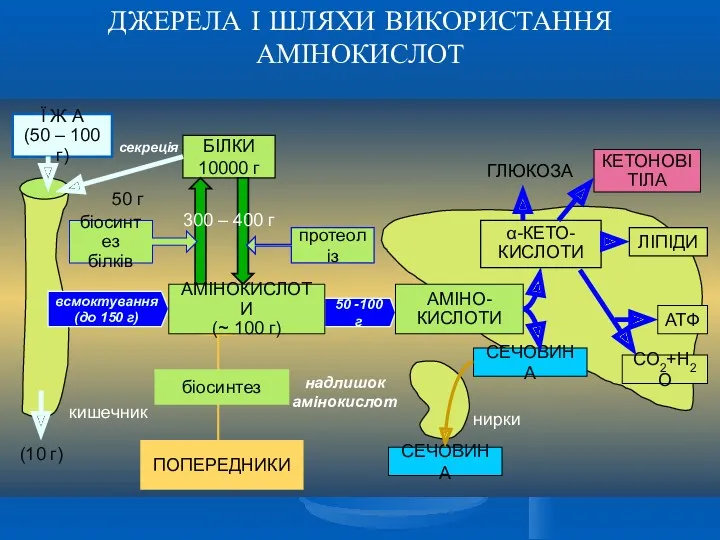
- 5. ДЖЕРЕЛА І ШЛЯХИ ВИКОРИСТАННЯ АМІНОКИСЛОТ
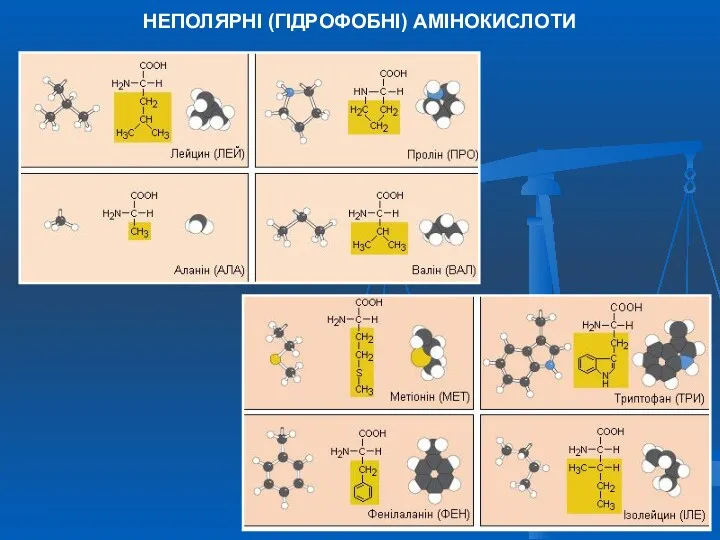
- 6. НЕПОЛЯРНІ (ГІДРОФОБНІ) АМІНОКИСЛОТИ
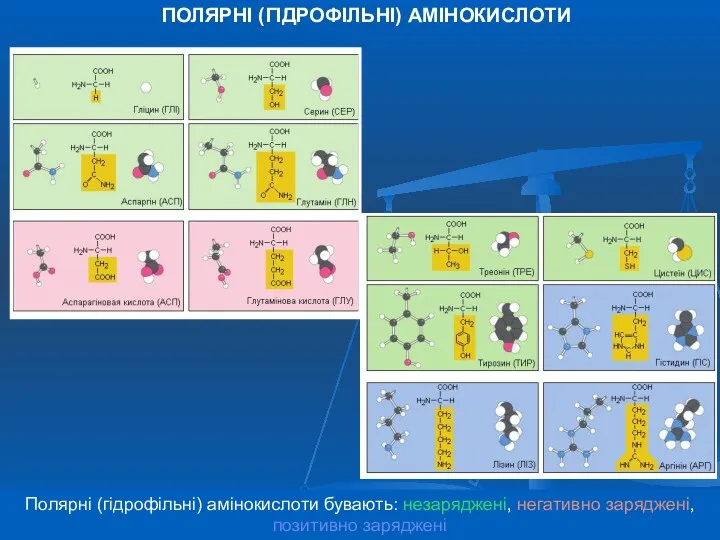
- 7. Полярні (гідрофільні) амінокислоти бувають: незаряджені, негативно заряджені, позитивно заряджені ПОЛЯРНІ (ГІДРОФІЛЬНІ) АМІНОКИСЛОТИ
- 8. НЕОБХІДНІ АМІНОКИСЛОТИ
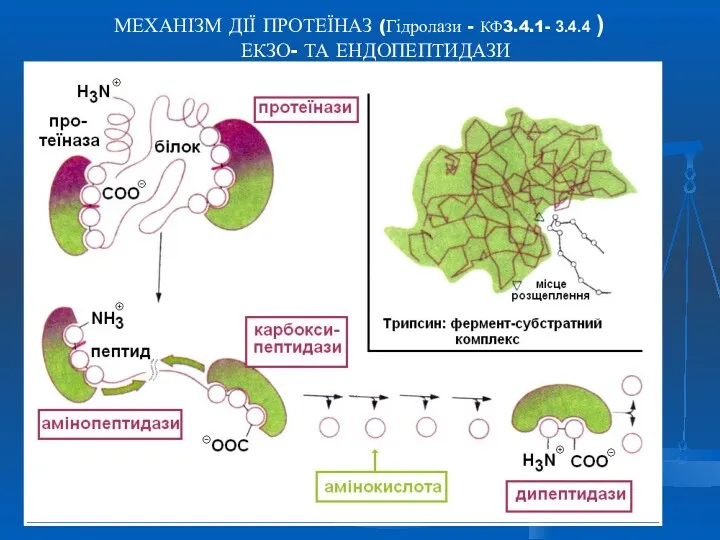
- 9. МЕХАНІЗМ ДІЇ ПРОТЕЇНАЗ (Гідролази - КФ3.4.1- 3.4.4 ) ЕКЗО- ТА ЕНДОПЕПТИДАЗИ
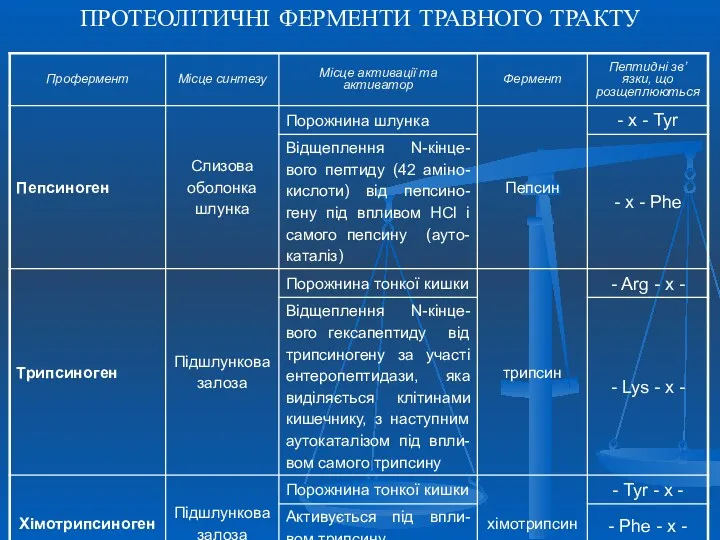
- 10. ПРОТЕОЛІТИЧНІ ФЕРМЕНТИ ТРАВНОГО ТРАКТУ
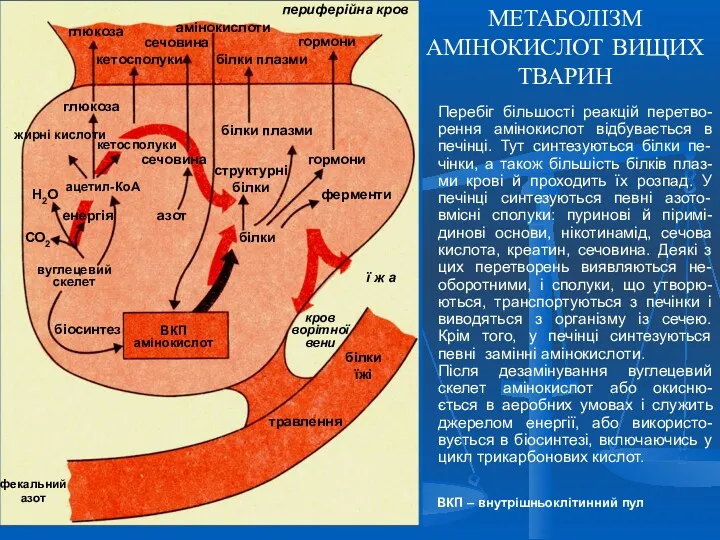
- 11. МЕТАБОЛІЗМ АМІНОКИСЛОТ ВИЩИХ ТВАРИН Перебіг більшості реакцій перетво-рення амінокислот відбувається в печінці. Тут синтезуються білки пе-чінки,
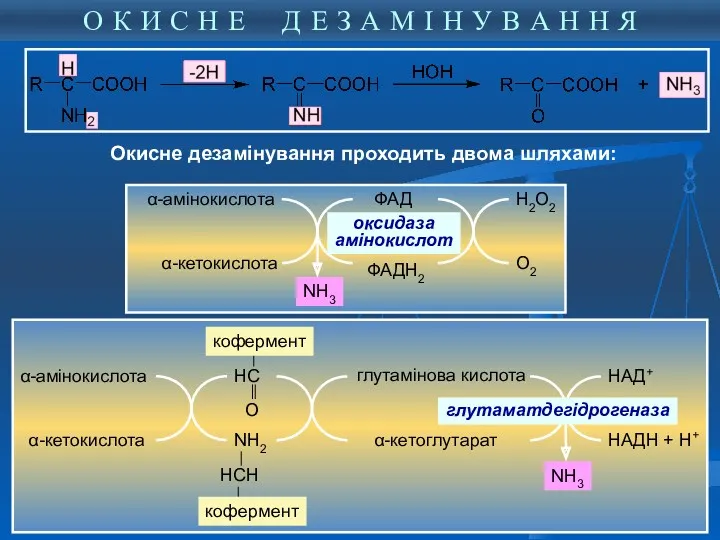
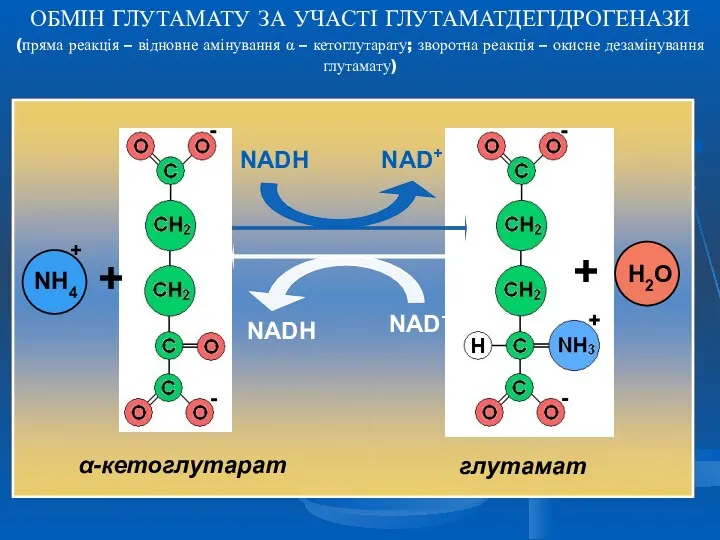
- 12. П’ЯТЬ НАЙВАЖЛИВІШИХ МЕТАБОЛІЧНИХ ПЕРЕТВОРЕНЬ АМІНОКИСЛОТ, а також… 1. ДЕКАРБОКСИЛЮВАННЯ 2. ОКИСНЕ ДЕЗАМІНУВАННЯ (крім того – відновне,
- 13. П’ЯТЬ НАЙВАЖЛИВІШИХ МЕТАБОЛІЧНИХ ПЕРЕТВОРЕНЬ АМІНОКИСЛОТ Амінокислоти підлягають декарбоксилюванню за участі декарбоксилаз (як кофермент - піридоксальфосфат). У
- 14. α-амінокислота α-кетокислота ФАД ФАДН2 оксидаза амінокислот Н2О2 О2 NH3 НС О NН2 α-амінокислота α-кетокислота кофермент НСН
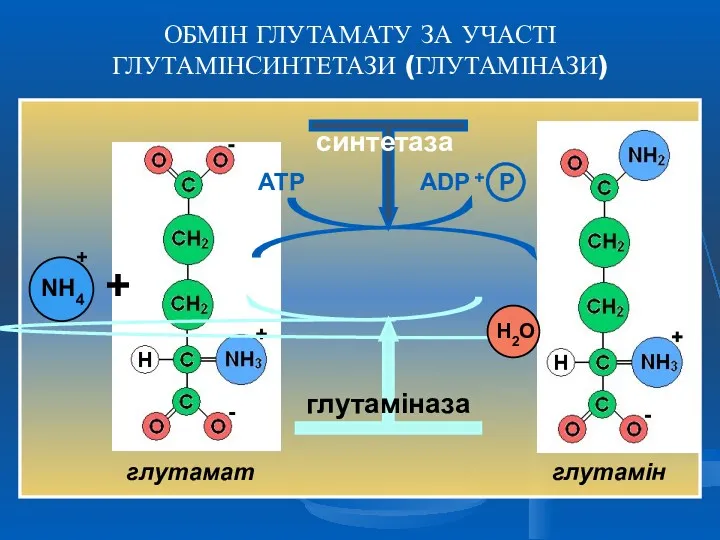
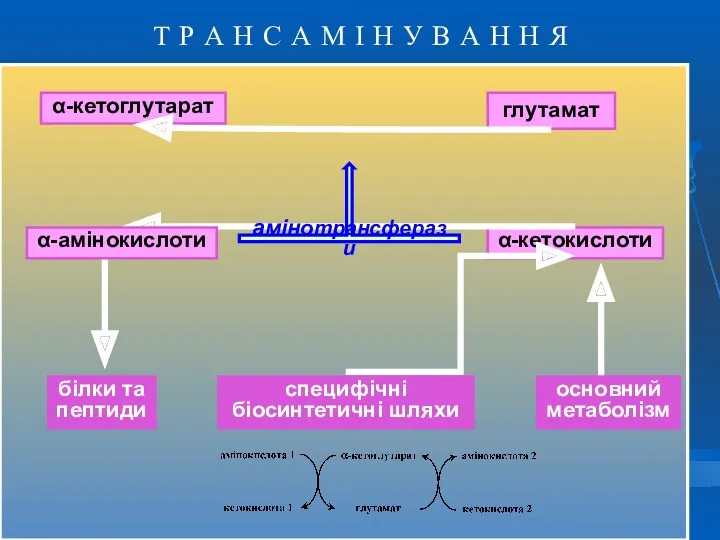
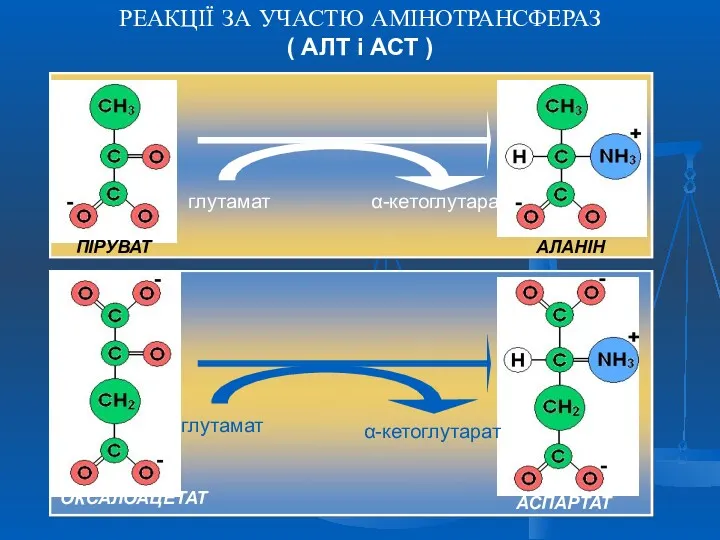
- 15. ТРАНСАМІНУВАННЯ ( ПЕРЕАМІНУВАННЯ ) Трансамінування – це основна біосинтетична реакція замінних амінокислот за участі амінотрансфераз (трансаміназ)
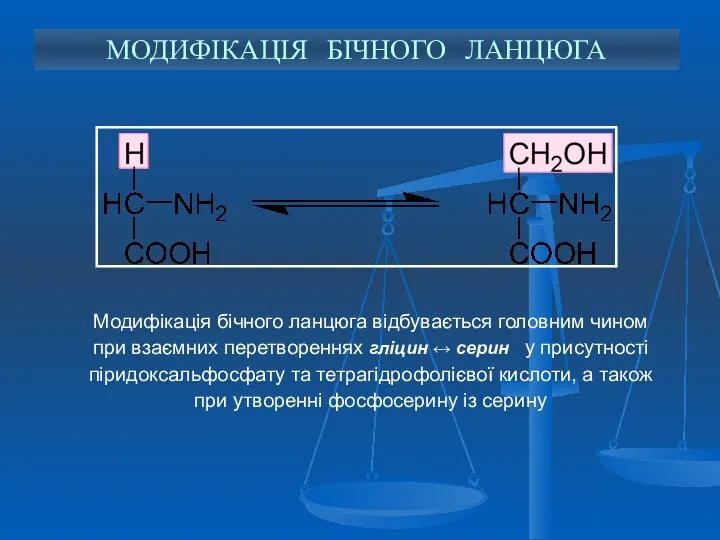
- 16. Модифікація бічного ланцюга відбувається головним чином при взаємних перетвореннях гліцин ↔ серин у присутності піридоксальфосфату та
- 17. Пептидні ланцюги (три-, тетра-, пента-, оліго- та поліпептиди) виникають за рахунок полімеризації амінокислот
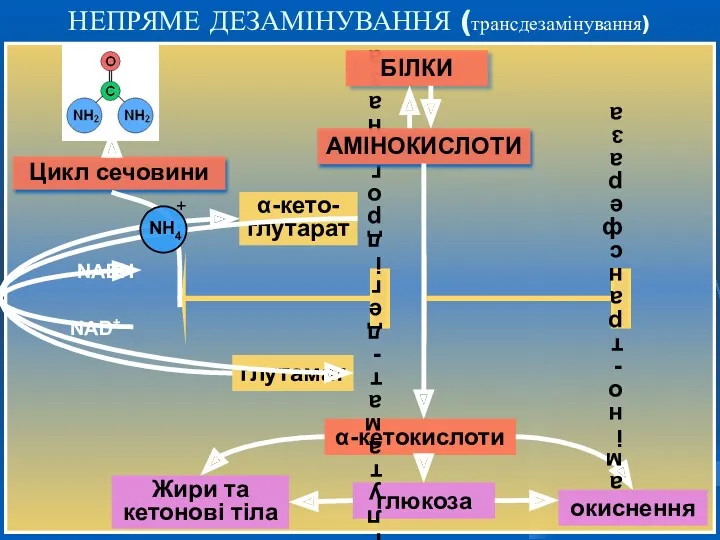
- 18. НЕПРЯМЕ ДЕЗАМІНУВАННЯ (трансдезамінування) Більшість амінокислот не здатні дезамінуватись в одну стадію, подібно глутамату. Аміногрупи таких амінокислот
- 20. Біосинтез амінокислот Важливе місце в біосинтезі азотовмісних сполук є процес фіксації азоту з подальшою первинною асиміляцією
- 23. Біосинтез окремих амінокислот Функціонування біосинтетичних процесів пов'язано з так званими родинами (5). Родина глутамату – синтез
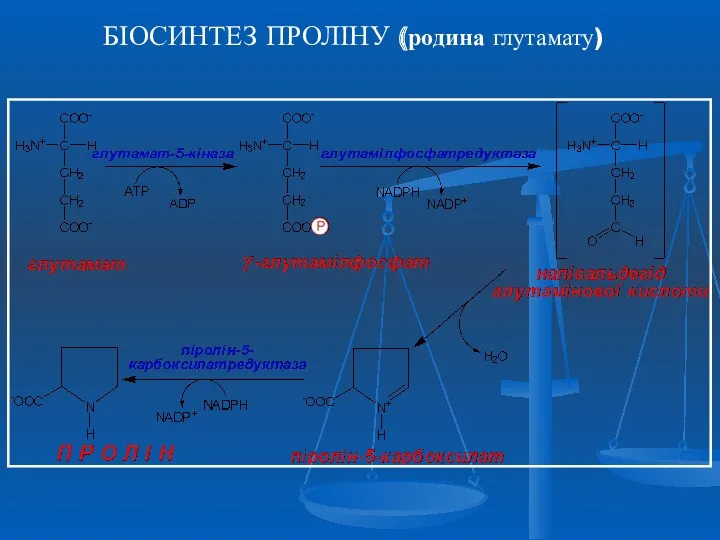
- 24. БІОСИНТЕЗ ПРОЛІНУ (родина глутамату)
- 25. БІОСИНТЕЗ АРГІНІНУ (родина глутамату) КГ - α-кетоглутарат ГЛУ - глутамат
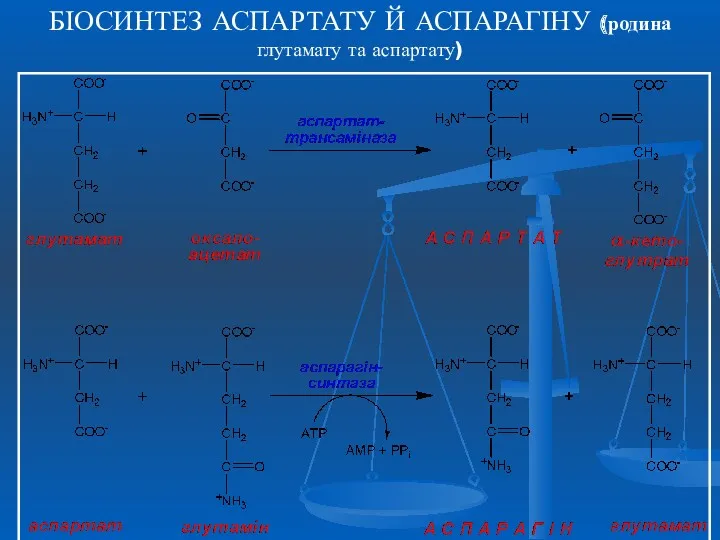
- 26. БІОСИНТЕЗ АСПАРТАТУ Й АСПАРАГІНУ (родина глутамату та аспартату)
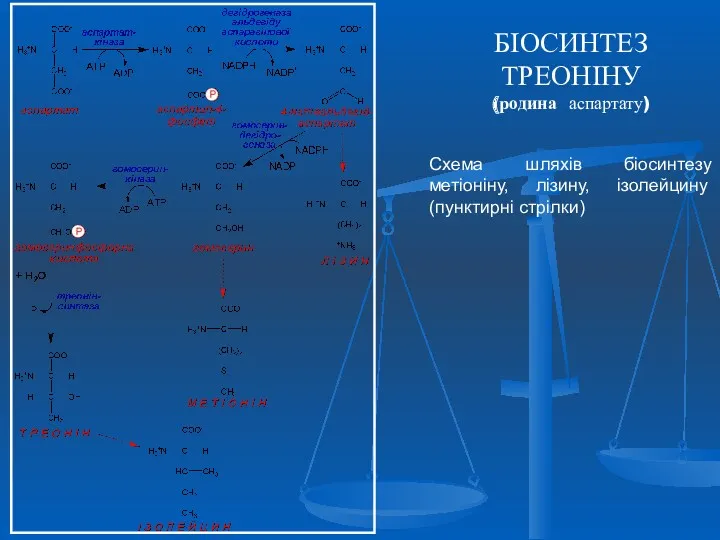
- 27. БІОСИНТЕЗ ТРЕОНІНУ (родина аспартату) Схема шляхів біосинтезу метіоніну, лізину, ізолейцину (пунктирні стрілки)
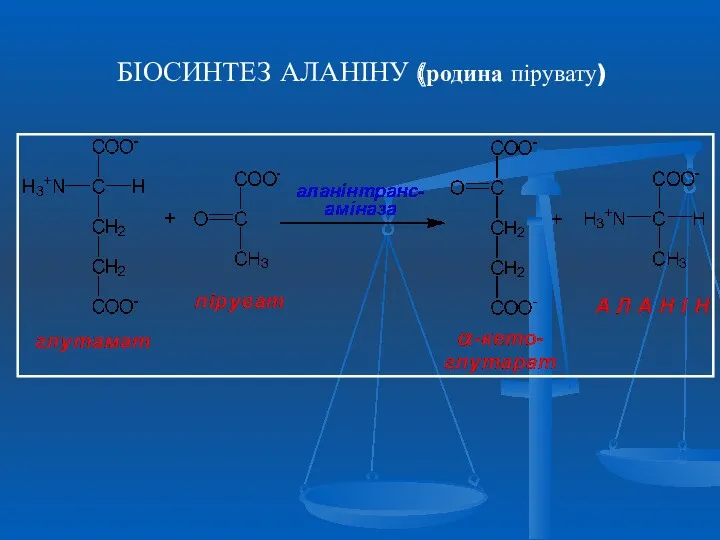
- 28. БІОСИНТЕЗ АЛАНІНУ (родина пірувату)
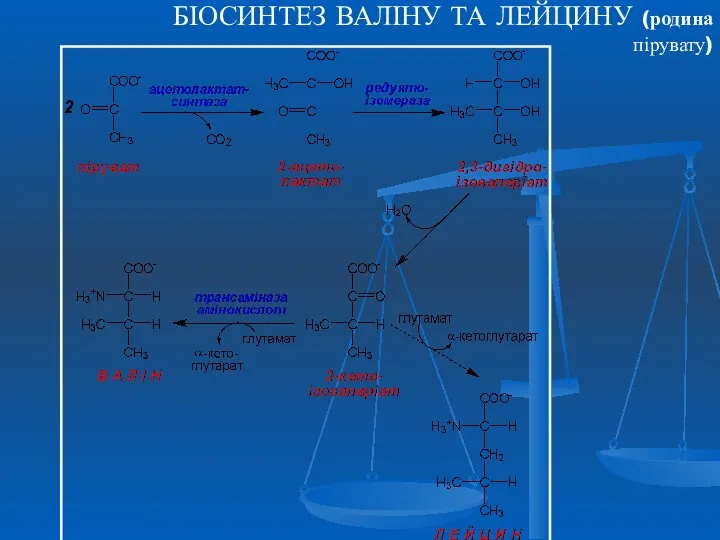
- 29. БІОСИНТЕЗ ВАЛІНУ ТА ЛЕЙЦИНУ (родина пірувату)
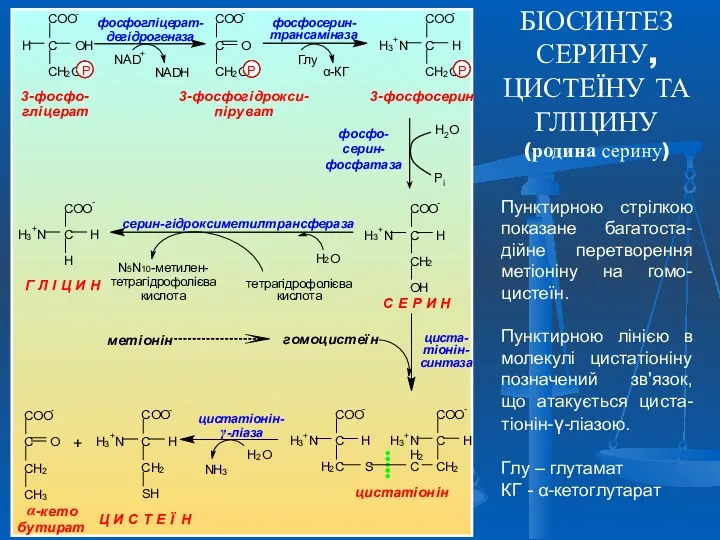
- 30. БІОСИНТЕЗ СЕРИНУ, ЦИСТЕЇНУ ТА ГЛІЦИНУ (родина серину) Пунктирною стрілкою показане багатоста-дійне перетворення метіоніну на гомо-цистеїн. Пунктирною
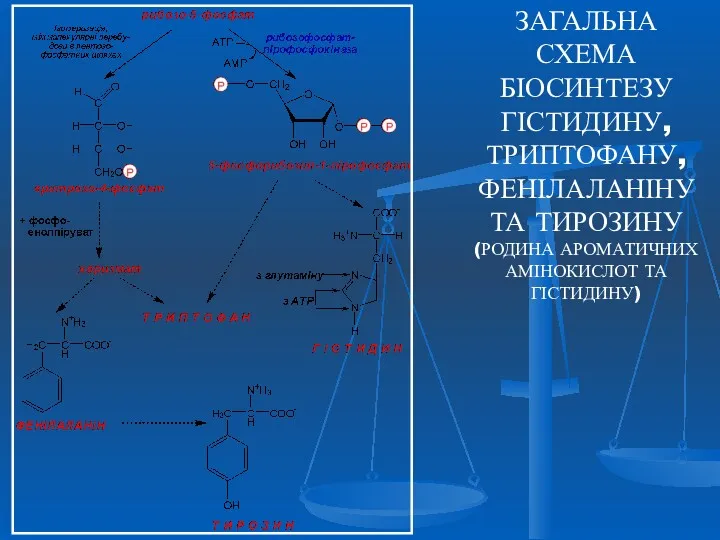
- 31. ЗАГАЛЬНА СХЕМА БІОСИНТЕЗУ ГІСТИДИНУ, ТРИПТОФАНУ, ФЕНІЛАЛАНІНУ ТА ТИРОЗИНУ (РОДИНА АРОМАТИЧНИХ АМІНОКИСЛОТ ТА ГІСТИДИНУ)
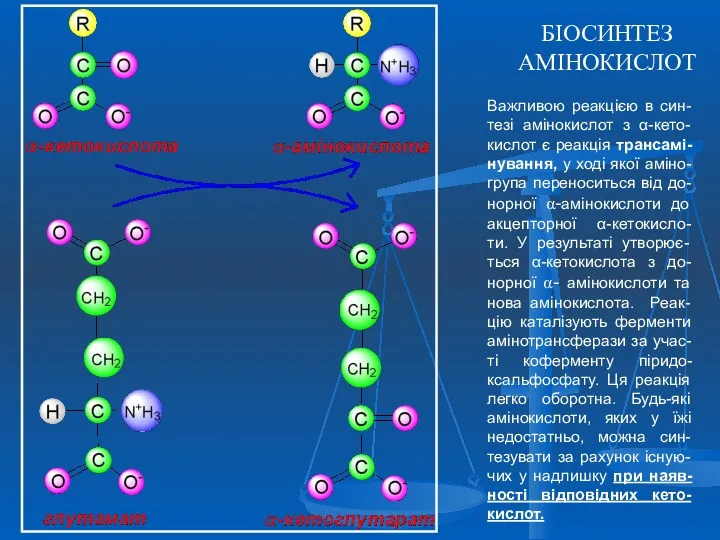
- 32. БІОСИНТЕЗ АМІНОКИСЛОТ Важливою реакцією в син-тезі амінокислот з α-кето-кислот є реакція трансамі-нування, у ході якої аміно-група
- 33. Т Р А Н С А М І Н У В А Н Н Я α-кетоглутарат
- 34. РЕАКЦІЇ ЗА УЧАСТЮ АМІНОТРАНСФЕРАЗ ( АЛТ і АСТ )
- 35. Біологічне значення трансамінування Реакції трансамінування відіграють значну роль в обміні амінокислот. Оскільки цей процес зворотний, ферменти
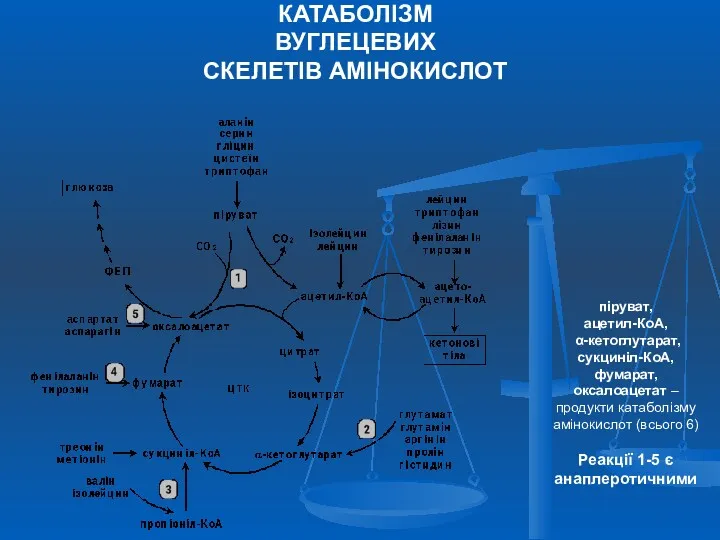
- 36. КАТАБОЛІЗМ ВУГЛЕЦЕВИХ СКЕЛЕТІВ АМІНОКИСЛОТ піруват, ацетил-КоА, α-кетоглутарат, сукциніл-КоА, фумарат, оксалоацетат – продукти катаболізму амінокислот (всього 6)
- 37. Амінокислоти, які перетворюються в піруват та проміжні продукти ЦТК (α-Кетоглутарат, сукциніл-КоА, фумарат) і утворюють в кінці
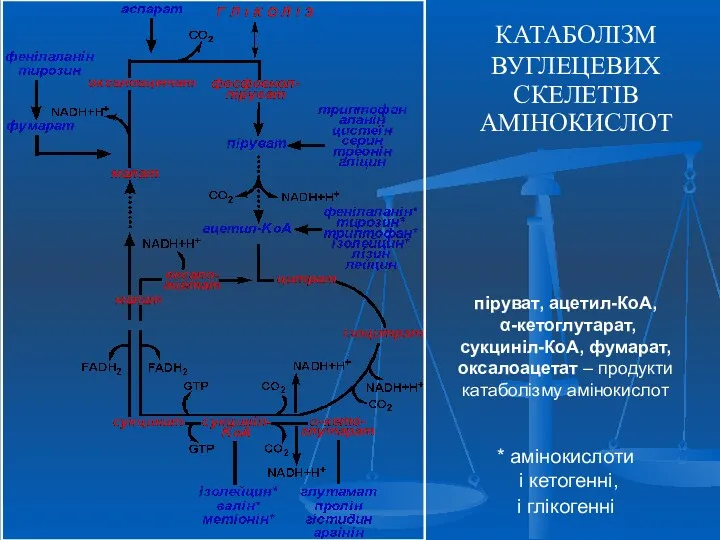
- 38. КАТАБОЛІЗМ ВУГЛЕЦЕВИХ СКЕЛЕТІВ АМІНОКИСЛОТ піруват, ацетил-КоА, α-кетоглутарат, сукциніл-КоА, фумарат, оксалоацетат – продукти катаболізму амінокислот * амінокислоти
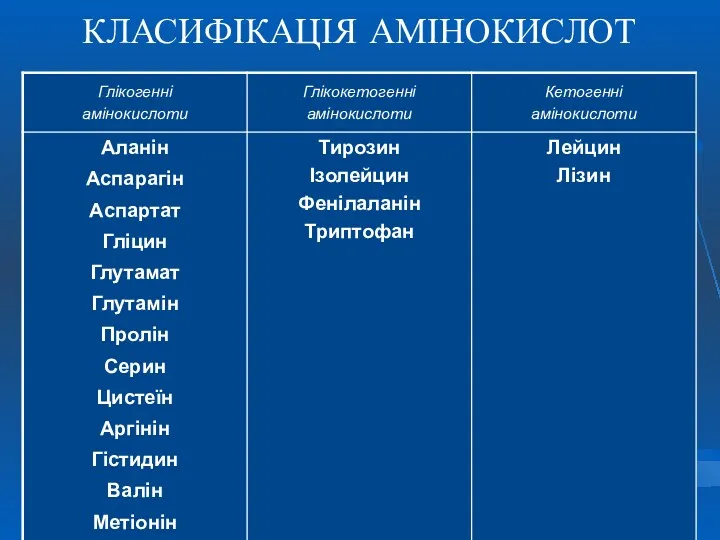
- 39. КЛАСИФІКАЦІЯ АМІНОКИСЛОТ
- 40. Спадкові порушення катаболізму амінокислот Фенілкетонурія. Тирозиноз. Алкаптонурія. Альбінізм. Хвороба Паркінсона.
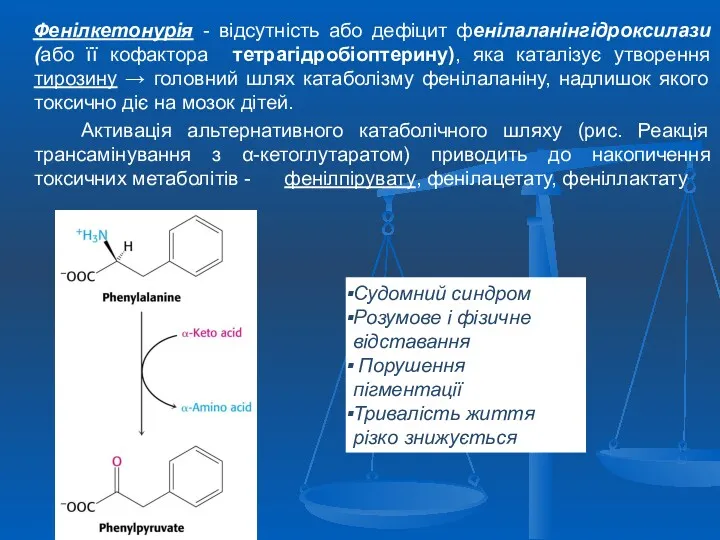
- 41. Фенілкетонурія - відсутність або дефіцит фенілаланінгідроксилази (або її кофактора тетрагідробіоптерину), яка каталізує утворення тирозину → головний
- 42. Тирозиноз (тирозинемія I типу) Причиною захворювання є, вірогідно, дефект ферменту фумарилацетоацетатгідролази, що каталізує розщеплення фумарилацетоацетату (проміжний
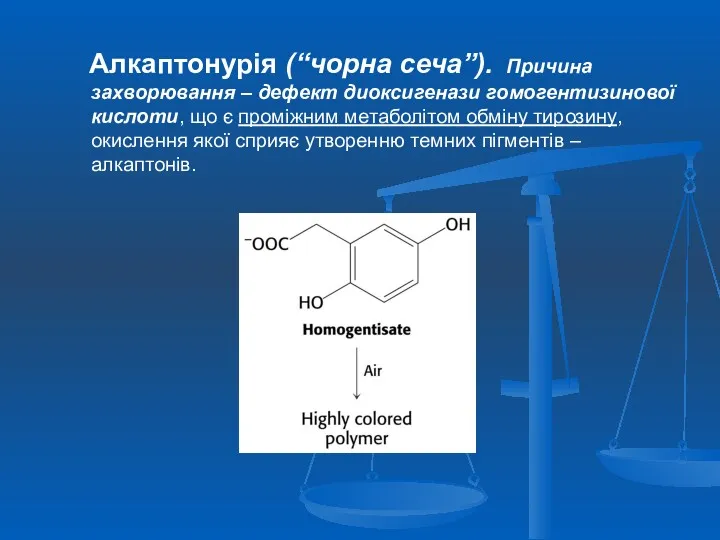
- 43. Алкаптонурія (“чорна сеча”). Причина захворювання – дефект диоксигенази гомогентизинової кислоти, що є проміжним метаболітом обміну тирозину,
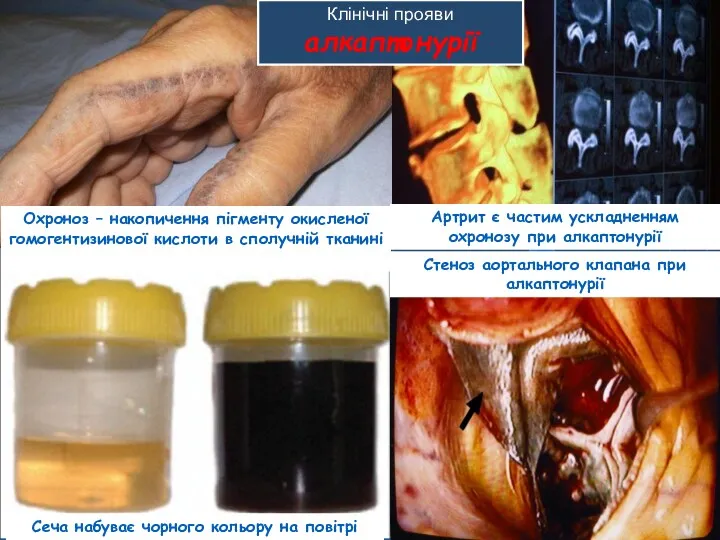
- 44. Сеча набуває чорного кольору на повітрі Клінічні прояви алкаптонурії Стеноз аортального клапана при алкаптонурії Охроноз –
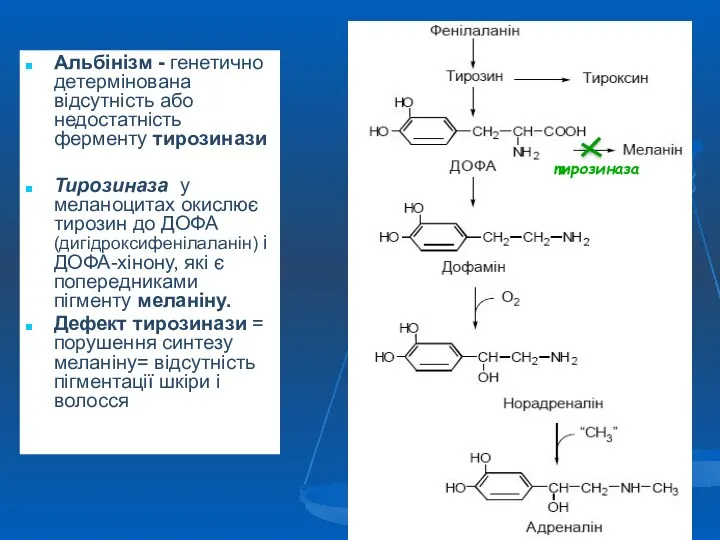
- 45. Альбінізм - генетично детермінована відсутність або недостатність ферменту тирозинази Тирозиназа у меланоцитах окислює тирозин до ДОФА
- 46. Симптоми альбінізму: відсутність пігментації шкіри і волосся за рахунок зниження продукції або відсутність меланіну висока чутливість
- 47. Хвороба Паркінсона. Захворювання розвивається внаслідок нестачі дофаміну в чорній субстанції мозку за рахунок зниження активності тирозингідроксилази(1),
- 48. Залежно від форми виведення амінного азоту різні види тварин можна розділити на три групи : амоніотелічні
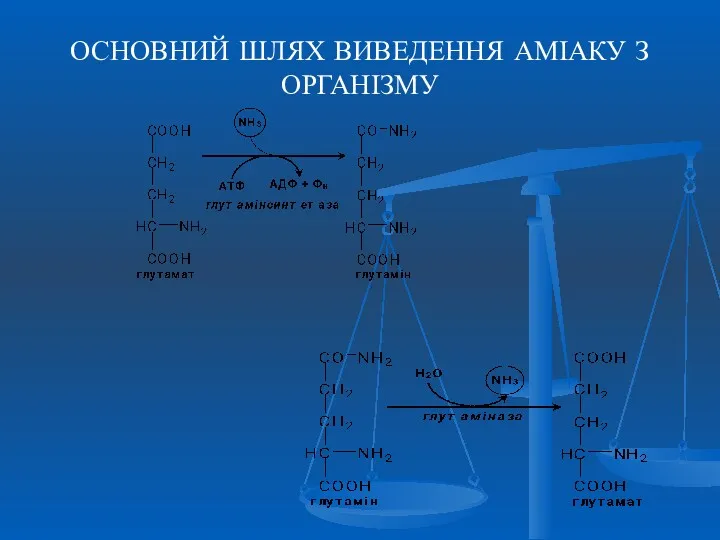
- 49. ОСНОВНИЙ ШЛЯХ ВИВЕДЕННЯ АМІАКУ З ОРГАНІЗМУ
- 51. Скачать презентацию


















 Гемобластозы
Гемобластозы Медична гельмінтологія. Круглі та плоскі черви –паразити людини. Лекція 9
Медична гельмінтологія. Круглі та плоскі черви –паразити людини. Лекція 9 Этапы изготовления частичного съемного пластинчатого протеза
Этапы изготовления частичного съемного пластинчатого протеза Изменения в организме женщины при беременности
Изменения в организме женщины при беременности Эректильная дисфункция. Консервативное и хирургическое лечение
Эректильная дисфункция. Консервативное и хирургическое лечение Эпидемиология инфекций, связанных с оказанием медицинской помощи
Эпидемиология инфекций, связанных с оказанием медицинской помощи Основы трансфузиологии. Осложнения при переливании крови
Основы трансфузиологии. Осложнения при переливании крови Корь. Первая экзантема/болезнь
Корь. Первая экзантема/болезнь Осложнения варикозной болезни нижних конечностей
Осложнения варикозной болезни нижних конечностей Әйелдердің жүктілік мерзімі
Әйелдердің жүктілік мерзімі Нейроофтальмология при сахарном диабете
Нейроофтальмология при сахарном диабете Патогенді және шарттыпатогенді микобактериялар. Туберкулез және микобактериоздың микробиологиялық диагностикасы. Алапес
Патогенді және шарттыпатогенді микобактериялар. Туберкулез және микобактериоздың микробиологиялық диагностикасы. Алапес Мектептегі оқу жұмысының кейбір түрлеріне қойылатын гигиеналық талаптар
Мектептегі оқу жұмысының кейбір түрлеріне қойылатын гигиеналық талаптар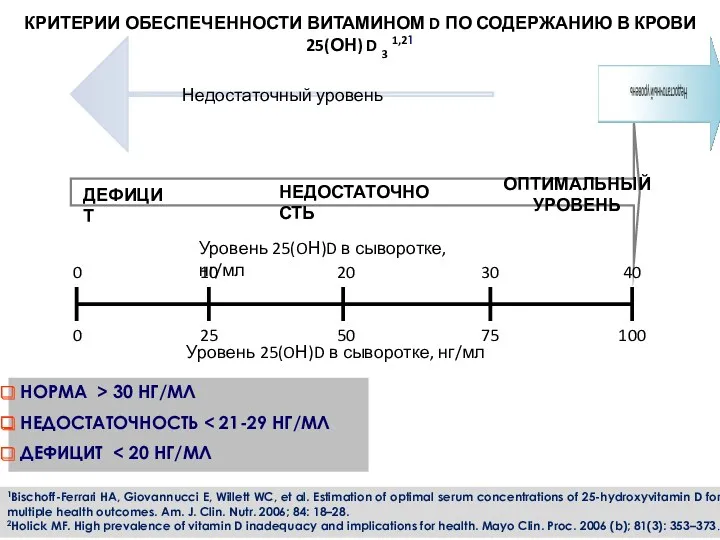 Критерии обеспеченности витамином d по содержанию в крови
Критерии обеспеченности витамином d по содержанию в крови Цереброваскулярные заболевания. Причины роста сосудистых заболеваний
Цереброваскулярные заболевания. Причины роста сосудистых заболеваний Возбудители пищевых интоксикаций
Возбудители пищевых интоксикаций Защита от Солнца
Защита от Солнца Дыхательная недостаточность
Дыхательная недостаточность Стадії серцево-легеневої та церебральної реанімації. Лекция 2
Стадії серцево-легеневої та церебральної реанімації. Лекция 2 Программа подготовки медицинского персонала по вопросам проведения медицинских осмотров водителей транспортных средств
Программа подготовки медицинского персонала по вопросам проведения медицинских осмотров водителей транспортных средств Ожирение
Ожирение Понятие об инкретинах.агпп1 Шундеева ЮВ
Понятие об инкретинах.агпп1 Шундеева ЮВ Отравление барбитуратами и транквилизаторами
Отравление барбитуратами и транквилизаторами Нарушения гемодинамики глаза. Возрастная макулярная дегенерация
Нарушения гемодинамики глаза. Возрастная макулярная дегенерация ЖРВИ. Жедел респираторлы вирусты инфекция
ЖРВИ. Жедел респираторлы вирусты инфекция Репродуктивное здоровье и профилактика репродуктивных нарушений
Репродуктивное здоровье и профилактика репродуктивных нарушений Основы и принципы доказательной медицины Evidence-Based Medicine (EBM)
Основы и принципы доказательной медицины Evidence-Based Medicine (EBM) Бас миының он екі жұп жүйкелерінің және олардың жасқа сай ерекшеліктері туралы түсінік. (Тақырыбы 4)
Бас миының он екі жұп жүйкелерінің және олардың жасқа сай ерекшеліктері туралы түсінік. (Тақырыбы 4)