Содержание
- 2. 1. *Фазовые равновесия и переходы. Правило фаз Гиббса. т/д система может состоять из нескольких фаз и
- 3. Ф – число фаз (газ, ж, тв; + жидкости разного состава, алл. модификации) Фаза – гомогенна,
- 4. Правило фаз Гиббса n – число внешних факторов, влияющих на систему. влияют Р и T: n=2
- 5. 2. *Однокомпонентные системы. Фазовая диаграмма воды. *Уравнение Клапейрона – Клаузиуса. К = 1 на равновесие влияет
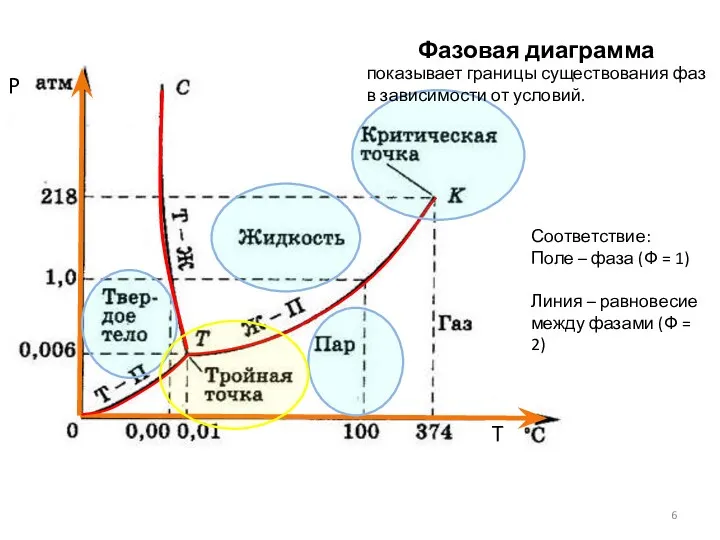
- 6. Фазовая диаграмма воды P T показывает границы существования фаз в зависимости от условий. Соответствие: Поле –
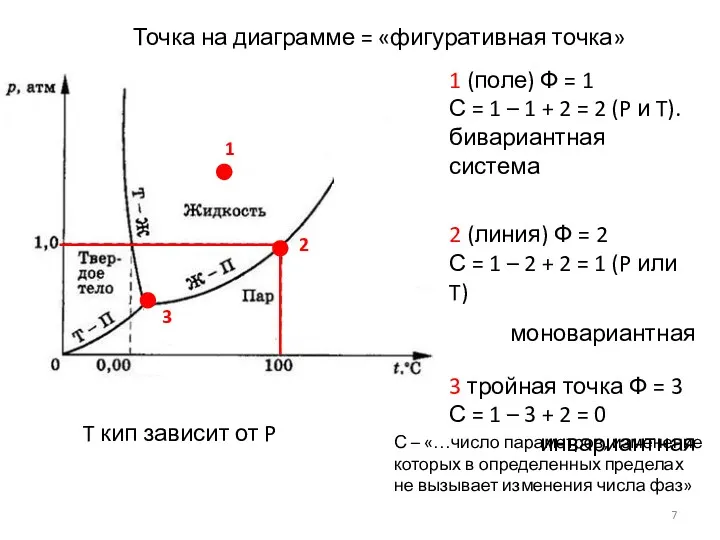
- 7. 1 (поле) Ф = 1 С = 1 – 1 + 2 = 2 (P и
- 8. Связь двух параметров Т и Р уравнение Клапейрона – Клаузиуса для определения Т кип при P,
- 9. Пример: Давление паров воды при 97°С (370 К) равно P1 = 90919,9 Па, теплота испарения ΔНисп
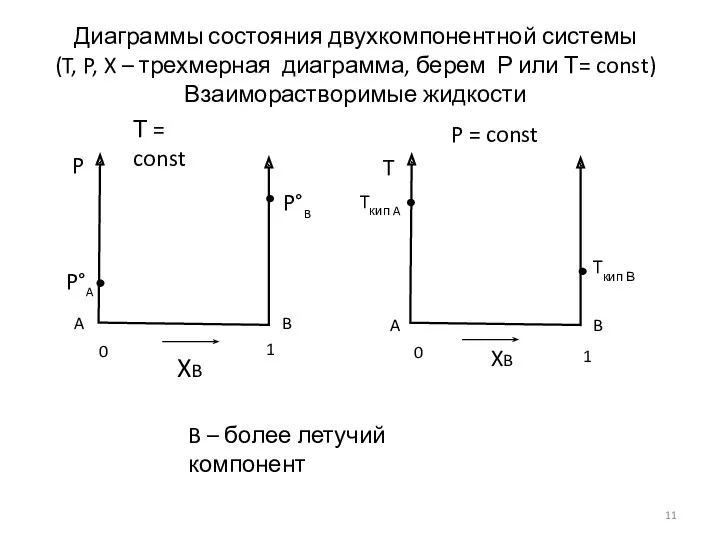
- 10. компоненты А и В: состояние зависит не только от P и T, но и от состава
- 11. Т = const P = const B – более летучий компонент P P°B XB B A
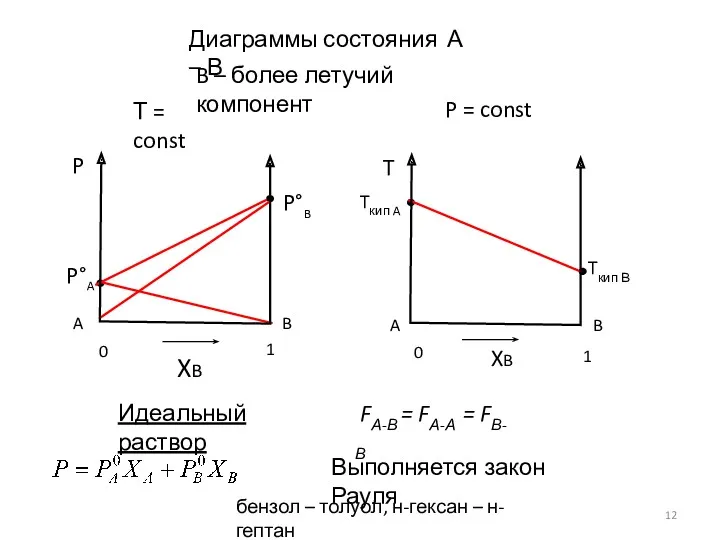
- 12. Диаграммы состояния А – В Т = const P = const B – более летучий компонент
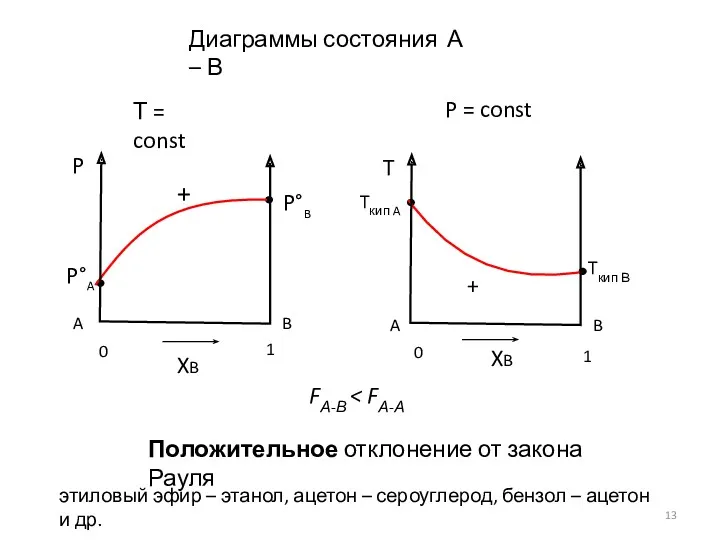
- 13. Диаграммы состояния А – В Т = const P = const Положительное отклонение от закона Рауля
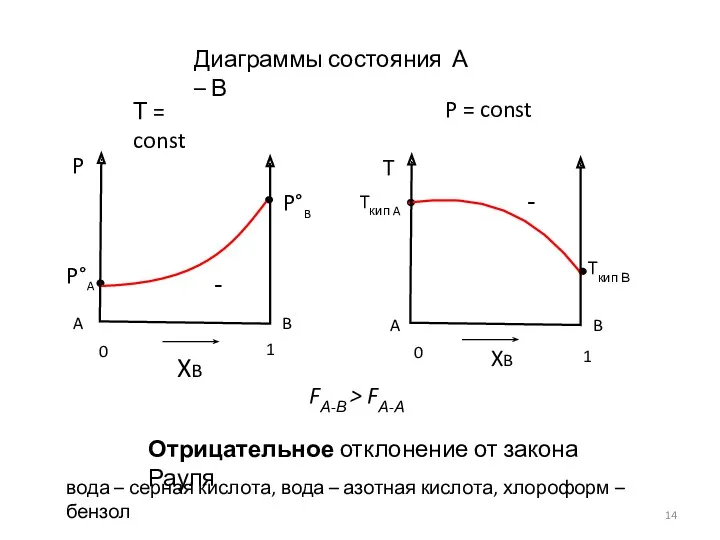
- 14. Диаграммы состояния А – В Т = const P = const Отрицательное отклонение от закона Рауля
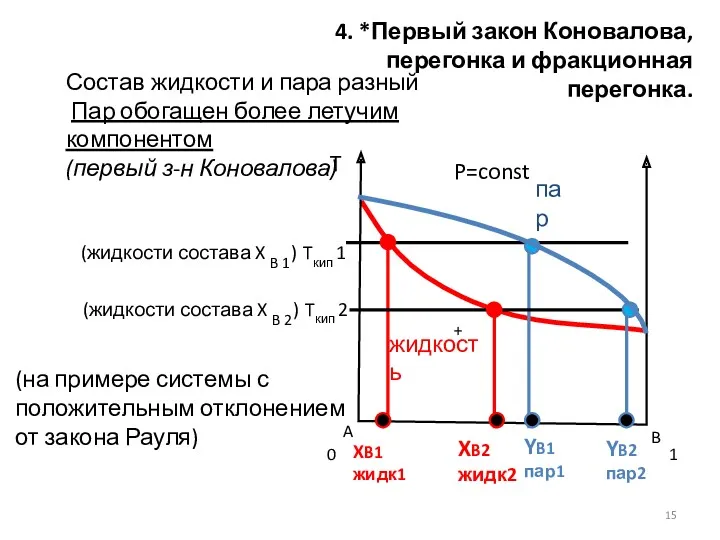
- 15. 4. *Первый закон Коновалова, перегонка и фракционная перегонка. P=const Состав жидкости и пара разный Пар обогащен
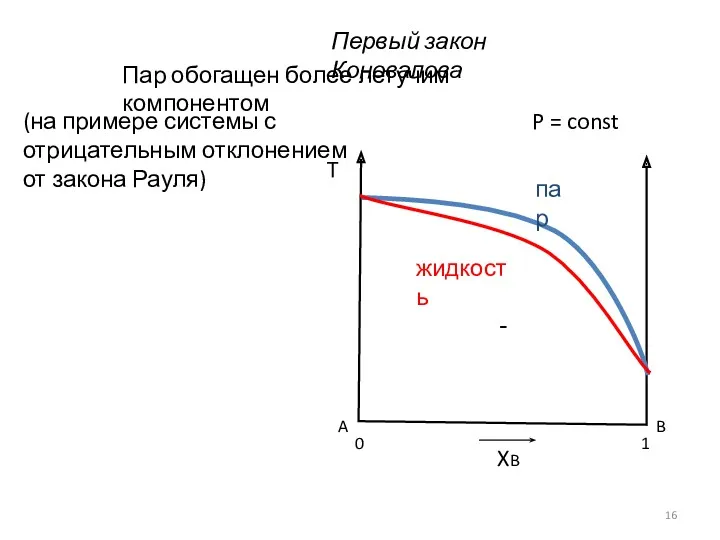
- 16. Первый закон Коновалова P = const Пар обогащен более летучим компонентом (на примере системы с отрицательным
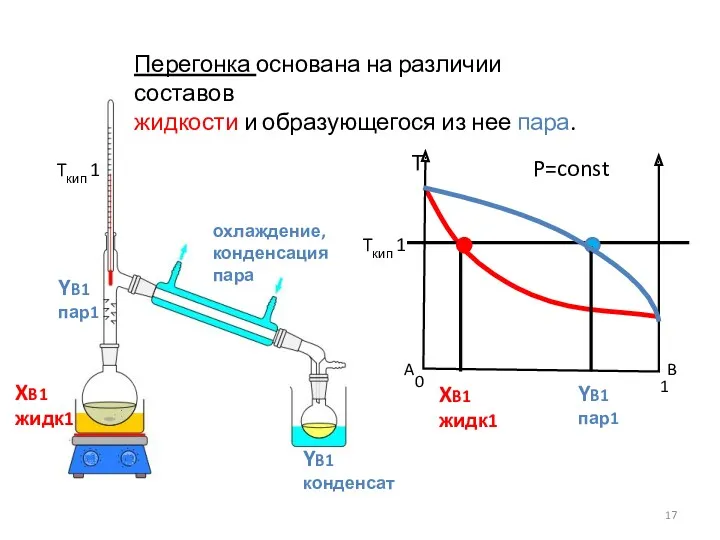
- 17. P=const Перегонка основана на различии составов жидкости и образующегося из нее пара. YB1 пар1 XB1 жидк1
- 18. Простая перегонка – однократное частичное испарение жидкой смеси с отводом и конденсацией образовавшихся паров в холодильнике.
- 19. Фракционная перегонка — разделение на несколько фракций (по содержанию более летучего компонента). Отличие – частичная конденсация
- 20. частичная конденсация – дефлегматор (2) или ректификационная колонна
- 21. Ректификация – одновременное и многократное испарение / конденсация. Пар барботирует через слой жидкости, охлаждается, частично конденсируется
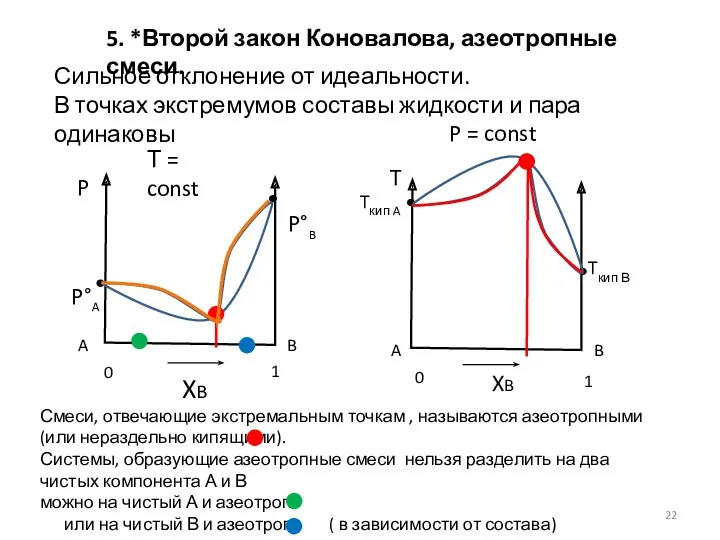
- 22. 5. *Второй закон Коновалова, азеотропные смеси. Т = const P = const Tкип В Tкип A
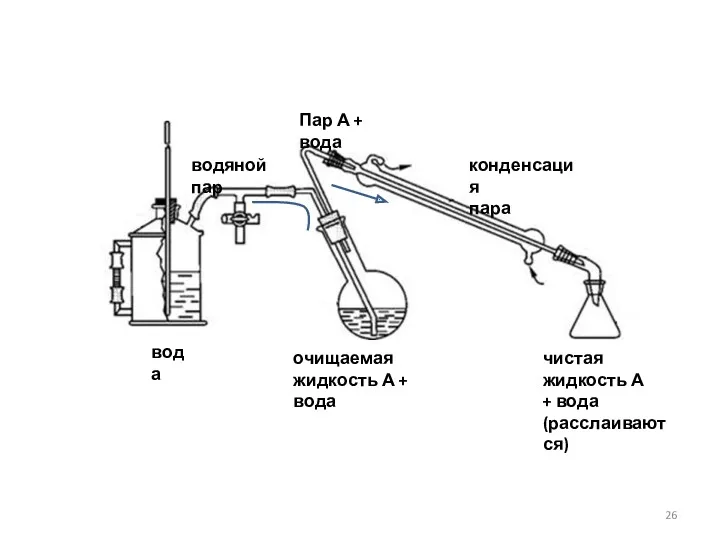
- 23. Взаимонерастворимые жидкости. Перегонка с водяным паром
- 24. Если систему нагреть до Tкип, то в пар одновременно будут переходить оба компонента. Состав пара Состав
- 25. Перегонка с водяным паром Если В – вода, то смесь кипит при Т «анилин – вода»
- 26. очищаемая жидкость А + вода вода водяной пар Пар А + вода конденсация пара чистая жидкость
- 27. откуда соотношение масс компонентов в паре (и в конденсате): расходный коэффициент (масса водяного пара, необходимая для
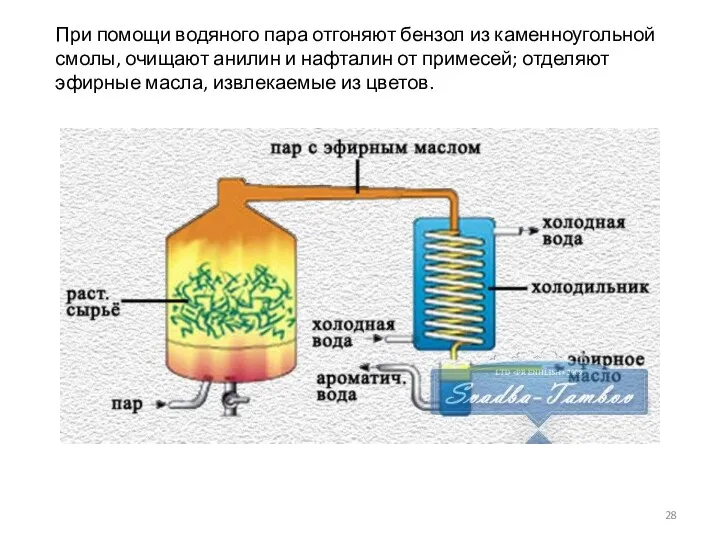
- 28. При помощи водяного пара отгоняют бензол из каменноугольной смолы, очищают анилин и нафталин от примесей; отделяют
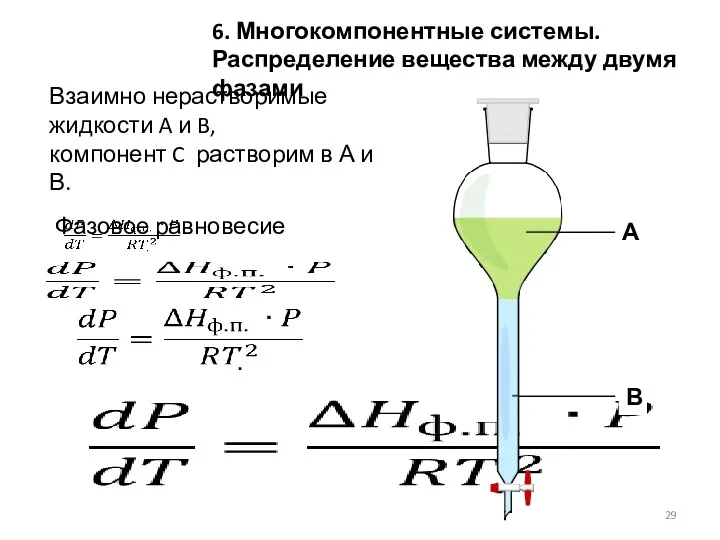
- 29. Взаимно нерастворимые жидкости A и B, компонент C растворим в А и В. Фазовое равновесие 6.
- 30. Распределение растворенного вещества между двумя жидкими фазами определяется k, зависящим от температуры и не зависящим от
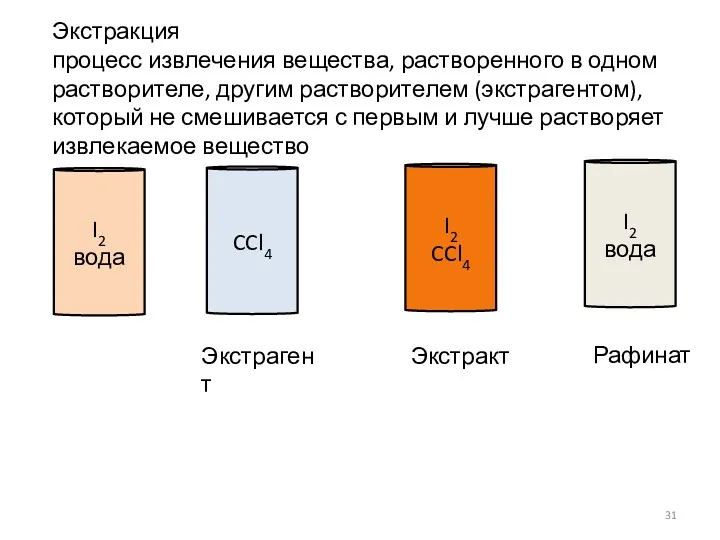
- 31. I2 вода CCl4 I2 CCl4 I2 вода Экстрагент Экстракт Рафинат Экстракция процесс извлечения вещества, растворенного в
- 32. ,, k =
- 34. Скачать презентацию
















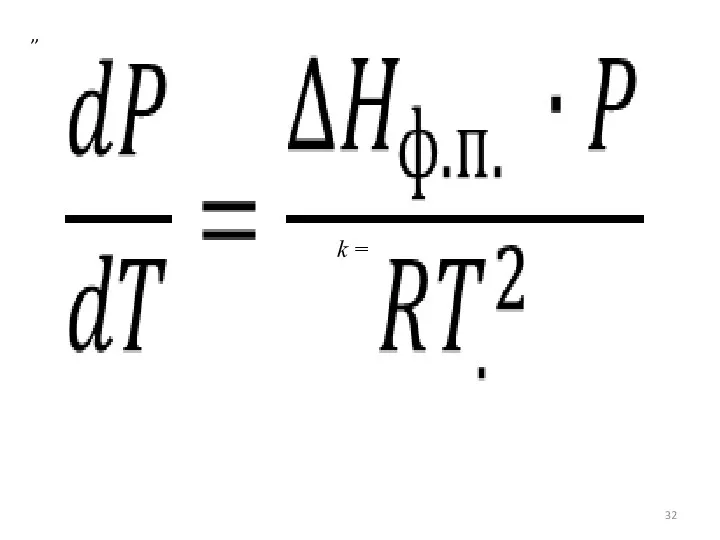
 Тепловой эффект химической реакции. Топливо. Водород. 8 класс
Тепловой эффект химической реакции. Топливо. Водород. 8 класс Бериллий, магний и щелочноземельные металлы. Главная подгруппа II группы
Бериллий, магний и щелочноземельные металлы. Главная подгруппа II группы Минералы и их основные морфологические характеристики
Минералы и их основные морфологические характеристики Алканы
Алканы Основные классы неорганических соединений
Основные классы неорганических соединений Химические уравнения Закон сохранения массы веществ
Химические уравнения Закон сохранения массы веществ Обмен липидов
Обмен липидов Степень окисления
Степень окисления Генетическая связь между классами веществ
Генетическая связь между классами веществ Химическая связь
Химическая связь Процессы и аппараты химических производств
Процессы и аппараты химических производств Электронные конфигурации атомов
Электронные конфигурации атомов Алканы. Получение, свойства и применение
Алканы. Получение, свойства и применение Хімічні формули речовин. Урок №14
Хімічні формули речовин. Урок №14 Петрография магматических пород
Петрография магматических пород Лекция 2 Периодический закон
Лекция 2 Периодический закон Подготовка к ВПР по химии. 11 класс
Подготовка к ВПР по химии. 11 класс Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Атыраудағы химиялық өндіріс кәсіп орындары
Атыраудағы химиялық өндіріс кәсіп орындары Химия и пища». «Белок – основа жизни
Химия и пища». «Белок – основа жизни Кто хочет стать химиком
Кто хочет стать химиком Степень окисления ОВР
Степень окисления ОВР Особенности строения твердых тел
Особенности строения твердых тел Силіцій
Силіцій Химическая стойкость тугоплавких металлов в различных реагентах
Химическая стойкость тугоплавких металлов в различных реагентах Введение в органическую химию
Введение в органическую химию Синтетичні високомолекулярні речовини. Полімери. Реакції полімеризації і поліконденсації
Синтетичні високомолекулярні речовини. Полімери. Реакції полімеризації і поліконденсації Геохимия
Геохимия