Содержание
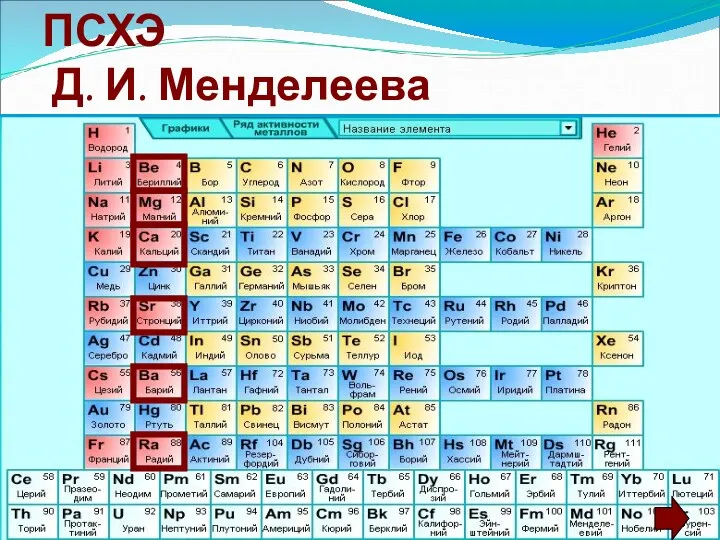
- 2. Положение элементов в ПСХЭ Д. И. Менделеева
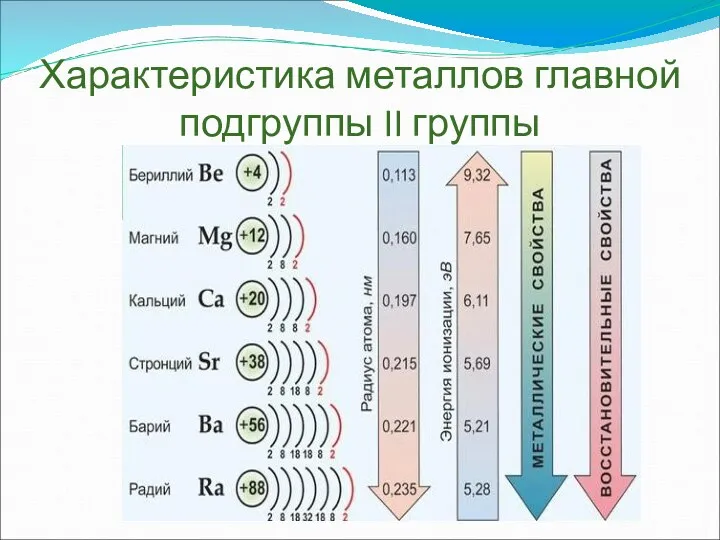
- 3. Характеристика металлов главной подгруппы II группы
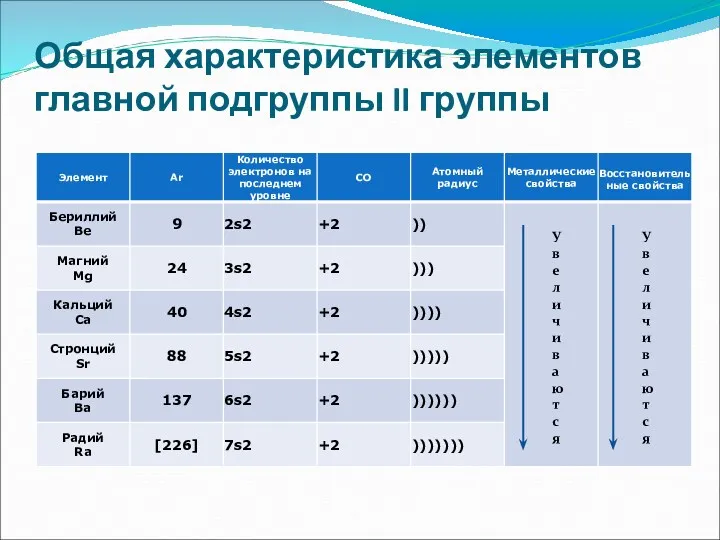
- 4. Общая характеристика элементов главной подгруппы II группы У в е л и ч и в а
- 5. Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя Элементы проявляют С.О. +2
- 6. Ве - амфотерный металл, Mg – металл, Сa, Sr,Ba - щёлочноземельные металлы Ra –радиоактивный элемент
- 7. Be – светло-серый, твердый, хрупкий Ca – твердый, пластичный Mg – относительно мягкий, пластичный, ковкий Sr
- 8. Получение щелочноземельных металлов Термическое восстановление их соединений: Be Cl2 + Mg = Be + MgCl2 MgO
- 9. Электролиз расплавов и рстворов галогенидов CuSO4 ⇄ Cu2+ + SO42- K(-): Cu2+ + 2e → Cu0
- 10. Химические свойства Щелочноземельные элементы - химически активные металлы. Они являются сильными восстановителями. Из металлов этой подгруппы
- 11. Взаимодействие с простыми веществами Все легко взаимодействуют с кислородом и серой: 2Be + O2 = 2BeO
- 12. Химические свойства элементов II группы главной подгруппы
- 13. Взаимодействие с водой Бериллий с водой не реагирует, магний реагирует медленно, остальные металлы реагируют с водой,
- 14. Взаимодействие кальция с водой https://yandex.ru/video/search?text=Взаимодействие кальция с водой
- 15. Взаимодействие с кислотами Все взаимодействуют с хлороводородной и разбавленной серной кислотами с выделением водорода: Be +
- 16. Взаимодействие со щелочами Бериллий взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода:
- 17. Соединения бериллия, магния и щелочноземельных металлов
- 18. Кислородные соединения - оксиды BeO – амфотерный оксид MgO CaO SrO Основные оксиды BaO Оксид кальция
- 19. ВеО В природе оксид бериллия встречается в виде минерала бромеллита. Получают оксид бериллия термическим разложение гидроксида
- 20. Химические свойства ВеО Реакционная способность оксида бериллия зависит от способа его получения. Прокаленный при температуре не
- 21. MgO белые кристаллы, нерастворимые в воде, На этом свойстве основано его применение в спортивной гимнастике, нанесенный
- 22. Химические свойства Реагирует с разбавленными кислотами с образованием солей MgO + 2HCl → MgCl2 + H2O
- 23. Взаимодействие оксида кальция с водой ( гашение извести) CaO + H2O → Ca(OH)2 + Q https://goo.gl/B0P1xN
- 24. Взаимодействие основных оксидов с водой https://goo.gl/Z6jPsC Взаимодействие оксидов металлов с кислотами https://goo.gl/r3zZiJ
- 25. Химические свойства гидроксидов Ве(ОН)2 – амфотерный гидроксид Mg(OH)2 – нерастворимое основание Ca(OH)2 Sr(OH)2 Ba(OH)2 Растворимые основания
- 26. Химические свойства Be(OH)2 Взаимодействие с щелочами с образованием соли: Be(OH)2 + 2NaOH ⟶ Na2Be(OH)4 Взаимодействие с
- 27. Взаимодействие гидроксидов с кислотами Ca(OH)2+2HCl=CaCl2+2H2O Mg(OH)2+2HCl=MgCl2+2H2O https://goo.gl/mhngzl
- 28. Окраска пламени солями металлов https://www.youtube.com/watch?v=nMptepCx0Jw https://www.youtube.com/watch?v=rccFLDrWMxc&t=4s
- 29. Жесткость воды Карбонатная, или временная Некарбонатная, или постоянная Общая жесткость Общая жесткость воды – это сумма
- 30. Карбонатная, или временная жесткость Обусловлена присутствием гидрокарбонатов кальция и магния. Её можно устранить: 1. Кипячением Ca(HCO3)2
- 31. Некарбонатная, или постоянная жесткость Обусловлена присутствием сульфатов и хлоридов кальция и магния. Её можно устранить действием
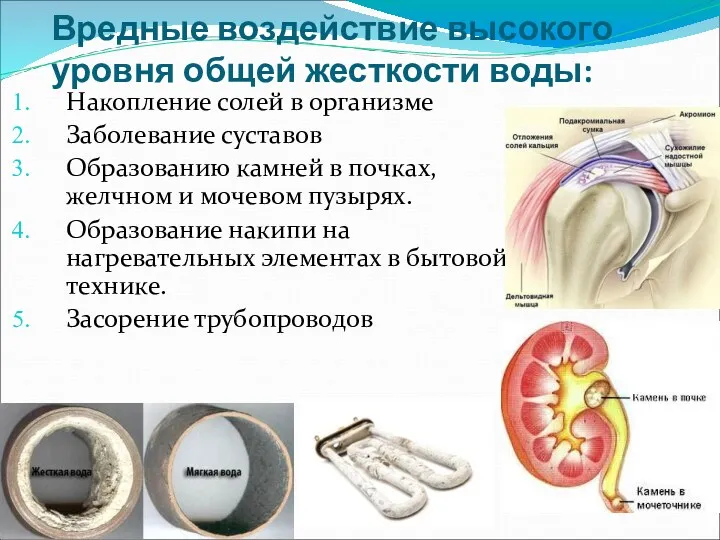
- 32. Вредные воздействие высокого уровня общей жесткости воды: Накопление солей в организме Заболевание суставов Образованию камней в
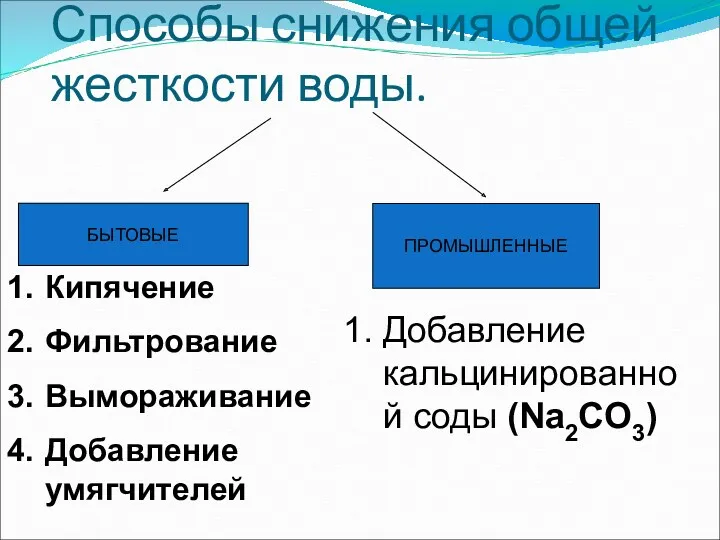
- 33. Способы снижения общей жесткости воды. БЫТОВЫЕ ПРОМЫШЛЕННЫЕ Кипячение Фильтрование Вымораживание Добавление умягчителей Добавление кальцинированной соды (Na2CO3)
- 34. Кипячение Снижение жесткости примерно на 30 - 40%
- 35. Вымораживание Вымораживание снижает общую жесткость на 70-80%
- 36. Фильтрование Фильтрование воды бытовым фильтром «Барьер-6» снижает общую жесткость до 80%.
- 39. Практическое значение соединений магния и щелочноземельных металлов MgCO – карбонат магния. Используется в производстве стекла, цемента,
- 40. Практическое значение соединений магния MgSO –cульфат магния. Содержится в морской воде и придает ей горький вкус.
- 41. Практическое значение соединений кальция фосфат кальция Входит в состав фосфоритов и апатитов, а также в состав
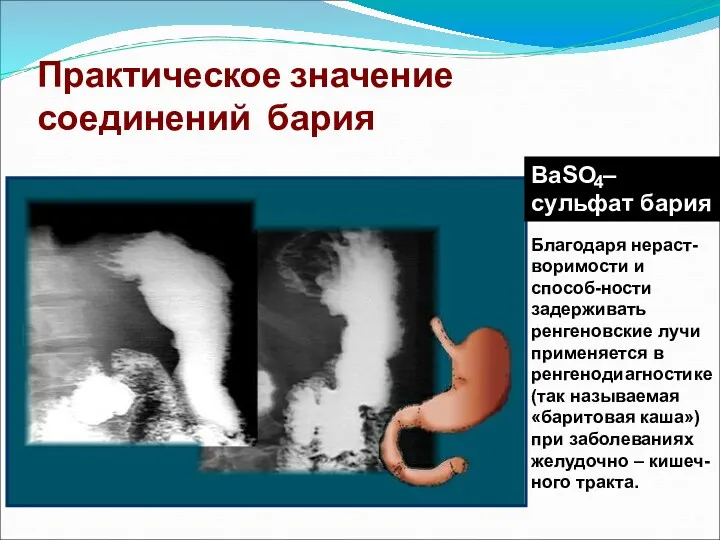
- 42. Практическое значение соединений бария BaSO – сульфат бария 4 Благодаря нераст-воримости и способ-ности задерживать ренгеновские лучи
- 43. Ca→CaH2→Ca(OH)2→ CaCO3→CaO→CaCl2→ Ca3(PO4)2
- 45. Скачать презентацию




































 Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Альдегиды и кетоны. 10 класс
Альдегиды и кетоны. 10 класс Углеводы, монозы, биозы. Лекция 15
Углеводы, монозы, биозы. Лекция 15 Безазотистые вторичные метаболиты минорных групп в фармации. Биохимия, функциональное значение в царстве растений
Безазотистые вторичные метаболиты минорных групп в фармации. Биохимия, функциональное значение в царстве растений ae2db93272ef42dba476a56bbc56b895
ae2db93272ef42dba476a56bbc56b895 S-элементтердің жалпы сипаттамасы
S-элементтердің жалпы сипаттамасы Степени окисления атомов и формулы веществ
Степени окисления атомов и формулы веществ Хімічний лабіринт
Хімічний лабіринт Аминокислоты. Классификация аминокислот
Аминокислоты. Классификация аминокислот Жесткость воды и способы её устранения
Жесткость воды и способы её устранения Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Главная подгруппа V группы..Азот
Главная подгруппа V группы..Азот Поделочные камни
Поделочные камни Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Кислород. 8 класс
Кислород. 8 класс Чисті речовини і суміші
Чисті речовини і суміші Электролиз
Электролиз Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз
Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Методы титрования. Перманганатометрия. (Лекция 24)
Методы титрования. Перманганатометрия. (Лекция 24) Химические свойства металлов
Химические свойства металлов Гидролиз солей
Гидролиз солей Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії
Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії Каменный уголь
Каменный уголь Электродные системы
Электродные системы Методы разделения белковых смесей. Электрофорез
Методы разделения белковых смесей. Электрофорез Анализ 3% раствора водорода пероксида
Анализ 3% раствора водорода пероксида Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования