Содержание
- 2. 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8, Ar =
- 3. 4. В земной коре его 49% по массе, в гидросфере – 89% по массе. 5. В
- 4. Газ - без цвета, вкуса и запаха; малорастворим ( в 100V H2O растворяется 3V O2 (н.у.));
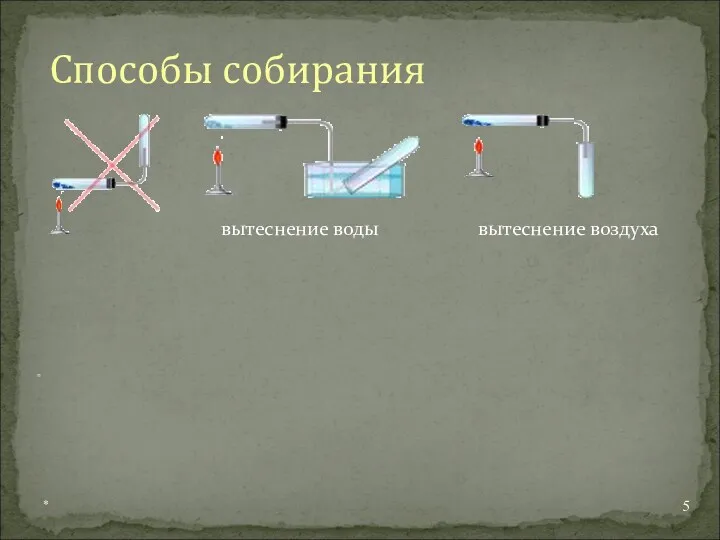
- 5. * Способы собирания вытеснение воды вытеснение воздуха =
- 6. Разложение кислородсодержащих веществ: - перманганата калия при нагревании: 2KMnO4 –t°→ K2MnO4 + MnO2 + O2↑ Разложение
- 7. - Хлората калия (бертолетова соль) 2KClO3 –t°;MnO2→ 2KCl + 3O2↑ - Пероксида водорода 2H2O2 –MnO2→ 2H2O
- 9. Скачать презентацию





 Поверхностные явления. Адсорбция. Изотерма Ленгмюра
Поверхностные явления. Адсорбция. Изотерма Ленгмюра Хімічне виробництво сталі
Хімічне виробництво сталі Взаимодействие ускоренных ионов с веществом (часть 1)
Взаимодействие ускоренных ионов с веществом (часть 1) Бұл суреттерді не біріктіреді деп ойлайсыздар?
Бұл суреттерді не біріктіреді деп ойлайсыздар? Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Почему нефть называют черным золотом
Почему нефть называют черным золотом Карбон
Карбон Массовая доля компонента вещества в смеси
Массовая доля компонента вещества в смеси Тірі ағзада жүретін процесстер – физика-химиялық интерпретация
Тірі ағзада жүретін процесстер – физика-химиялық интерпретация Эфирные масла
Эфирные масла Protein and amino acid metabolism
Protein and amino acid metabolism Chemical reactions and heat. (Chapter 1)
Chemical reactions and heat. (Chapter 1) Магний (Mg)
Магний (Mg) Своя игра. Химия. 7 класс
Своя игра. Химия. 7 класс Химические реакции
Химические реакции Школьное мероприятие Д. И. Менделеев в высказываниях
Школьное мероприятие Д. И. Менделеев в высказываниях Механизмы органических реакций
Механизмы органических реакций Р-элементы IV группы
Р-элементы IV группы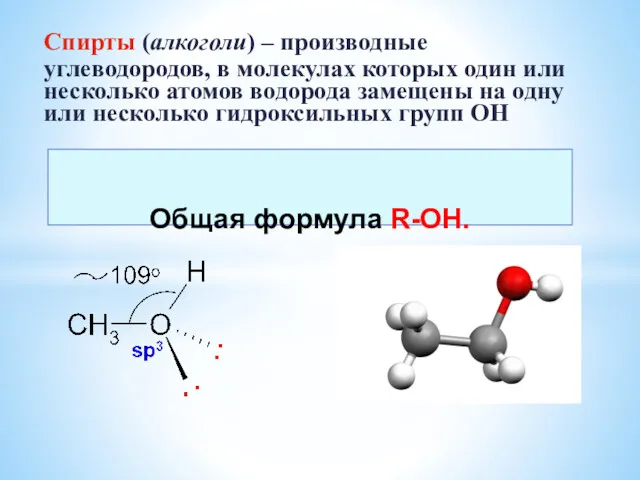 Спирты. Многоатомные спирты
Спирты. Многоатомные спирты Химия в строительстве
Химия в строительстве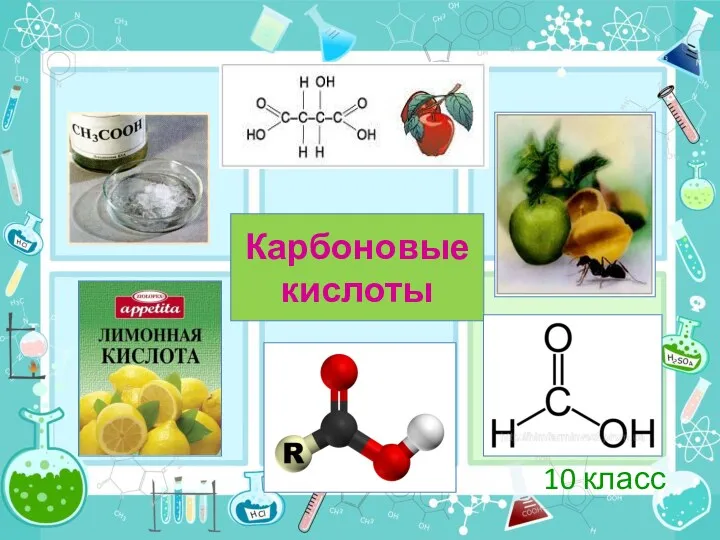 Карбоновые кислоты. (10 класс)
Карбоновые кислоты. (10 класс) 20230306_gidroliz
20230306_gidroliz Романенко
Романенко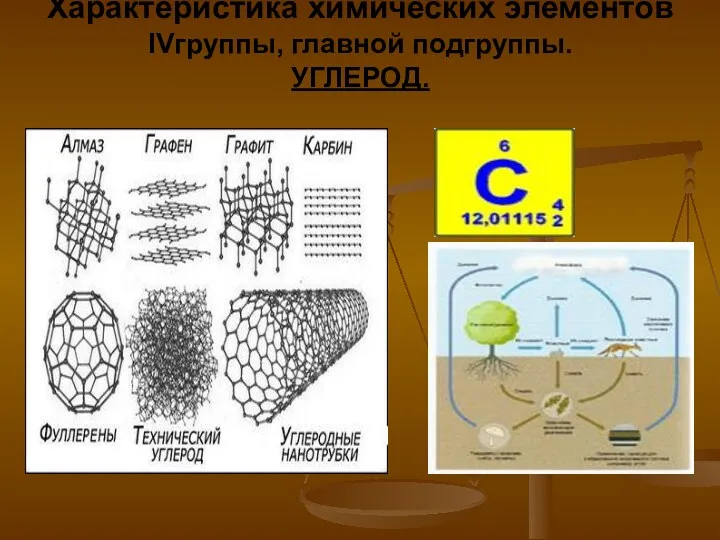 Характеристика химических элементов IV группы, главной подгруппы. Углерод
Характеристика химических элементов IV группы, главной подгруппы. Углерод Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Классификация и свойства кислот
Классификация и свойства кислот Виды мелиорации земель. Химическая реабилитация урбаноземов
Виды мелиорации земель. Химическая реабилитация урбаноземов Железо, его физические и химические свойства
Железо, его физические и химические свойства