Содержание
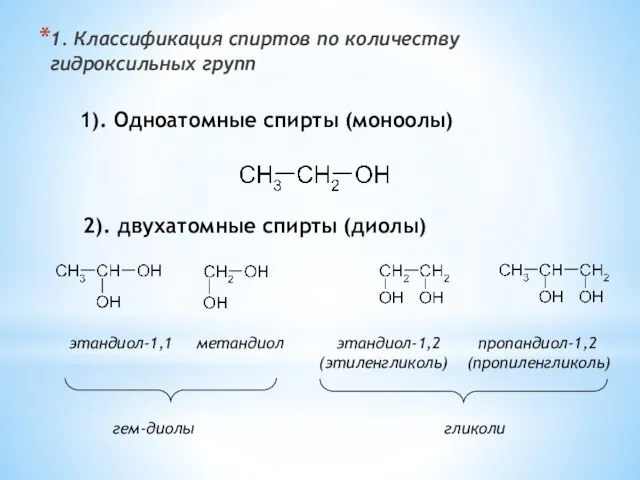
- 2. 1. Классификация спиртов по количеству гидроксильных групп 1). Одноатомные спирты (моноолы) 2). двухатомные спирты (диолы) этандиол-1,1
- 3. 3). Многоатомные спирты пропантриол-1,2,3 бутантетраол-1,2,3,4 (глицерин) (эритрит)
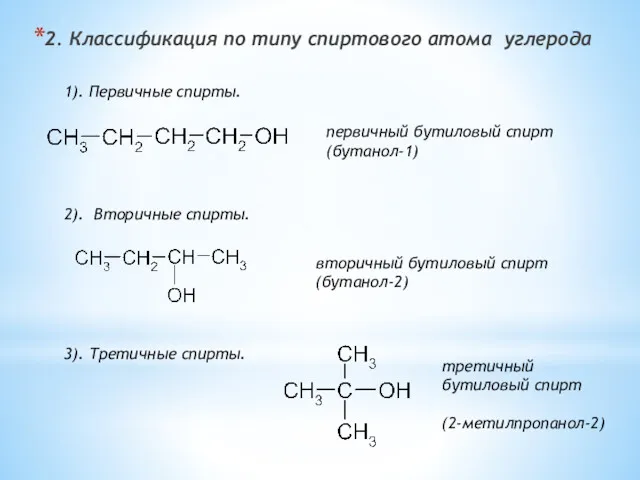
- 4. 2. Классификация по типу спиртового атома углерода 1). Первичные спирты. первичный бутиловый спирт (бутанол-1) 2). Вторичные
- 5. Номенклатура спиртов
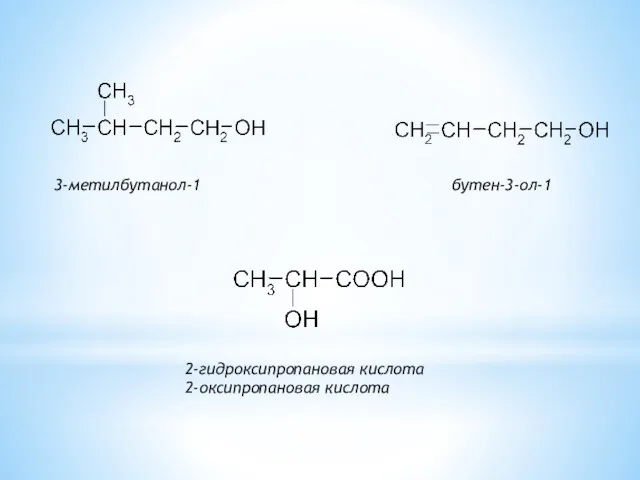
- 6. 3-метилбутанол-1 бутен-3-ол-1 2-гидроксипропановая кислота 2-оксипропановая кислота
- 7. 3. Изомерия 3.1. Cтруктурная изомерия 3.1. 1. Изомерия положения заместителей пентанол-1 пентанол-2 пентанол-3 3.1. 2. Изомерия
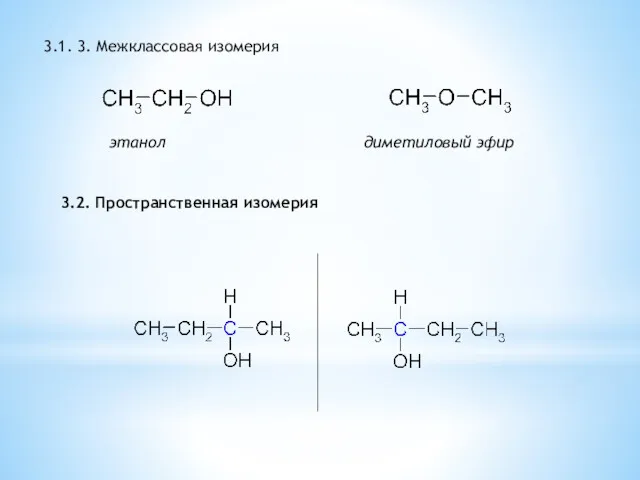
- 8. 3.1. 3. Межклассовая изомерия этанол диметиловый эфир 3.2. Пространственная изомерия
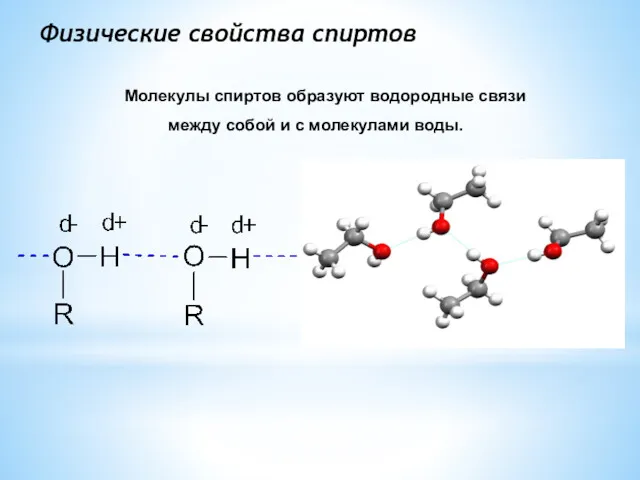
- 9. Физические свойства спиртов Молекулы спиртов образуют водородные связи между собой и с молекулами воды.
- 10. Гидроксигруппа является сильно полярной группой, поэтому низшие спирты растворяются в воде неограниченно: метанол, этанол, пропанол смешиваются
- 11. Химические свойства 1. Кислотные свойства спиртов Спирты являются очень слабыми кислотами, даже вода является более сильной
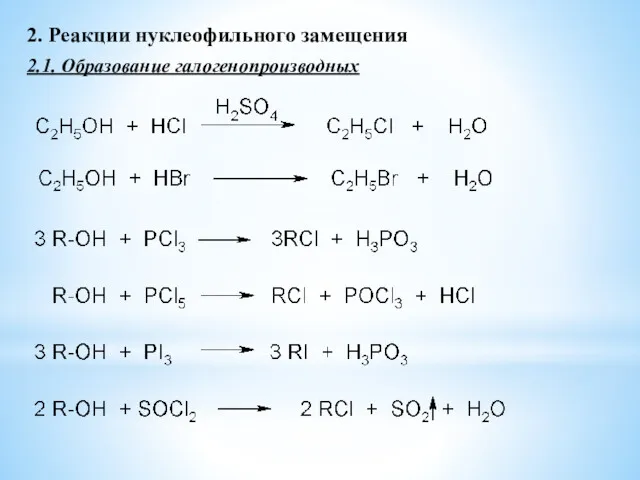
- 12. 2. Реакции нуклеофильного замещения 2.1. Образование галогенопроизводных
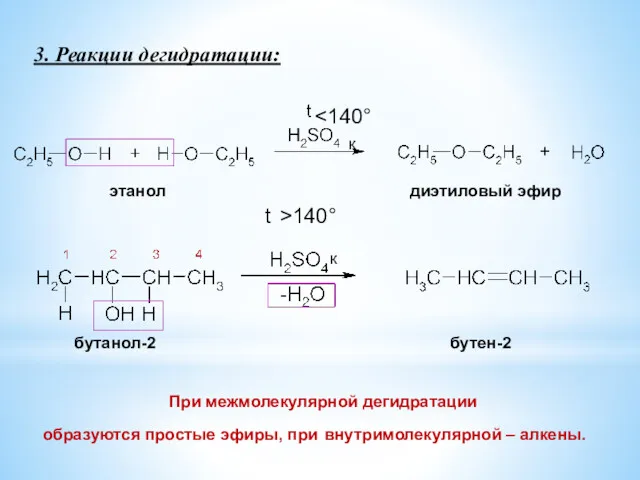
- 13. 3. Реакции дегидратации: При межмолекулярной дегидратации образуются простые эфиры, при внутримолекулярной – алкены. бутанол-2 бутен-2 этанол
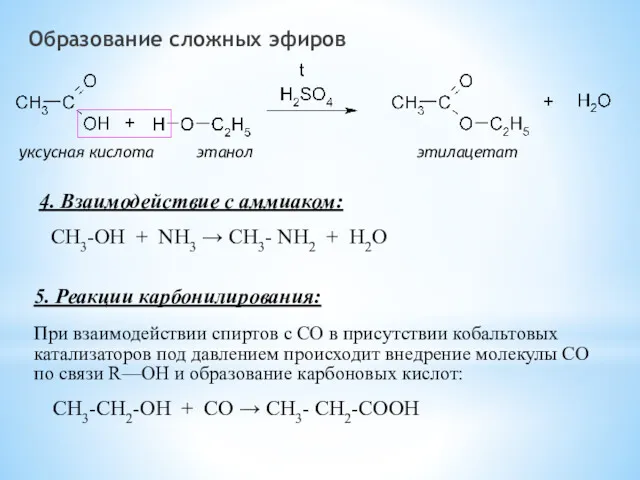
- 14. Образование сложных эфиров уксусная кислота этанол этилацетат 4. Взаимодействие с аммиаком: СН3-OH + NH3 → СН3-
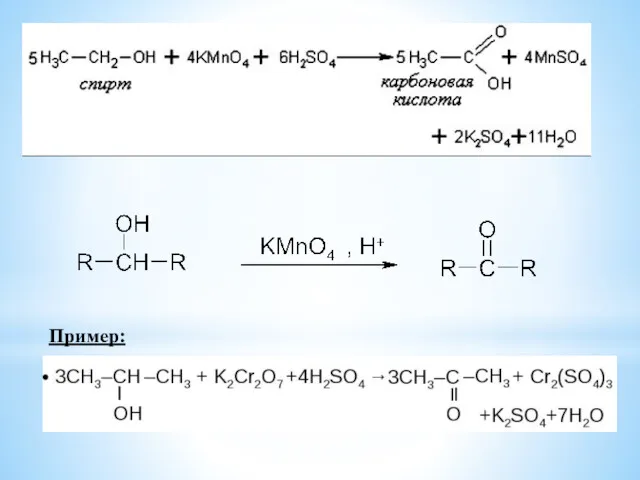
- 15. 6. Реакции окисления спиртов Мягкие окислители окисляют первичные спирты в альдегиды, а вторичные спирты в кетоны.
- 16. Пример:
- 17. Третичные спирты наиболее стойки к действию окислителей. Углеродный атом, связанный с гидроксилом, у третичных спиртов не
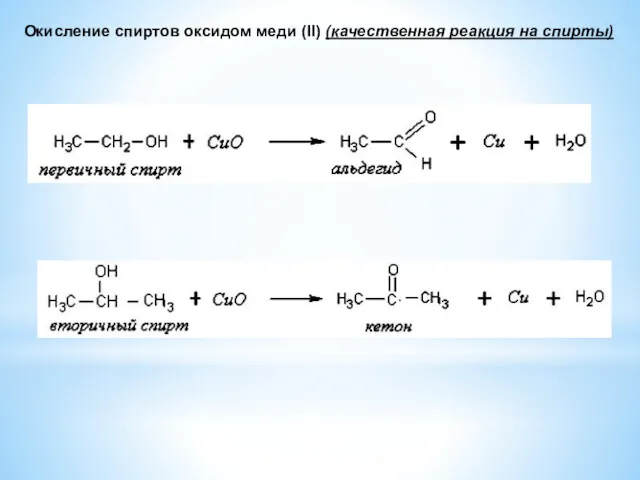
- 18. Окисление спиртов оксидом меди (II) (качественная реакция на спирты)
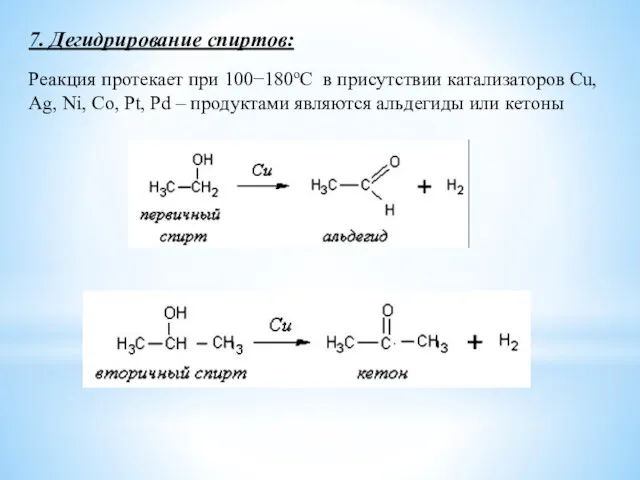
- 19. Реакция протекает при 100−180оС в присутствии катализаторов Cu, Ag, Ni, Co, Pt, Pd – продуктами являются
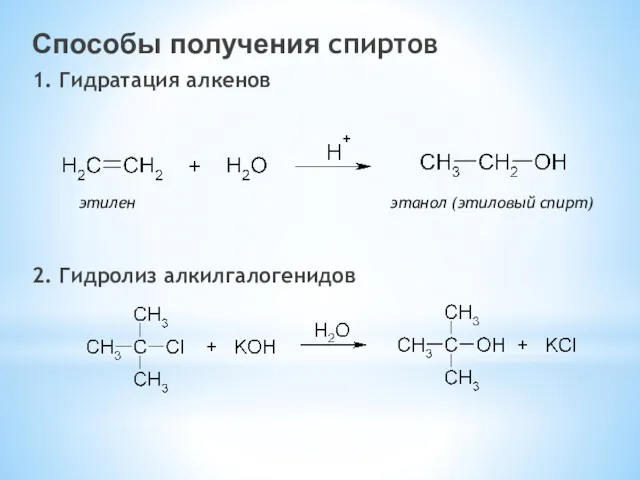
- 20. Способы получения спиртов 1. Гидратация алкенов 2. Гидролиз алкилгалогенидов этилен этанол (этиловый спирт)
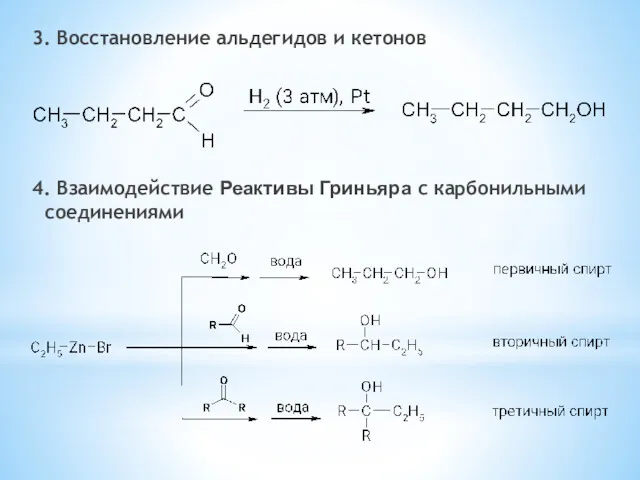
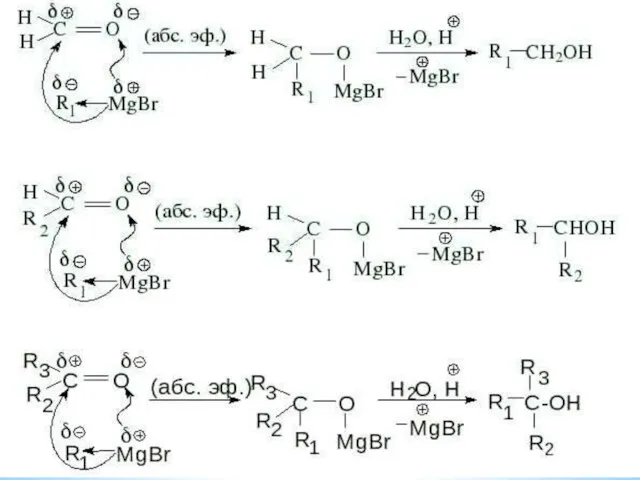
- 21. 3. Восстановление альдегидов и кетонов 4. Взаимодействие Реактивы Гриньяра с карбонильными соединениями
- 23. 5. Промышленное получение спиртов До 1925 года метанол получали пиролизом древесины. В настоящее время его получают
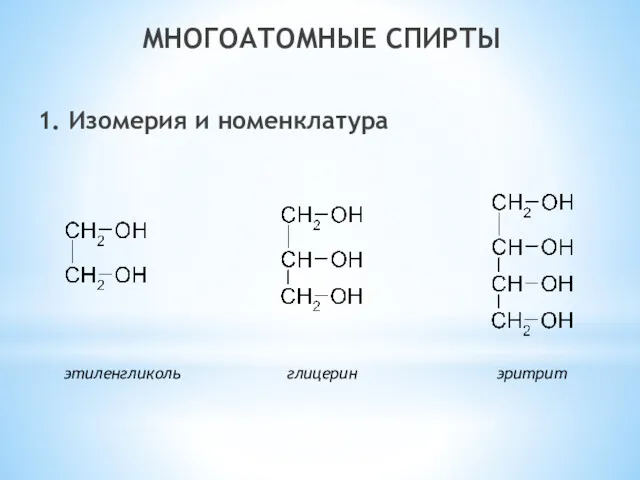
- 24. МНОГОАТОМНЫЕ СПИРТЫ 1. Изомерия и номенклатура этиленгликоль глицерин эритрит
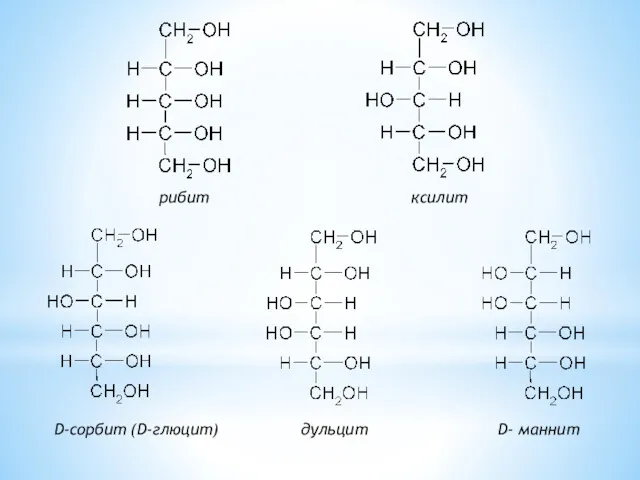
- 25. рибит ксилит D-сорбит (D-глюцит) дульцит D- маннит
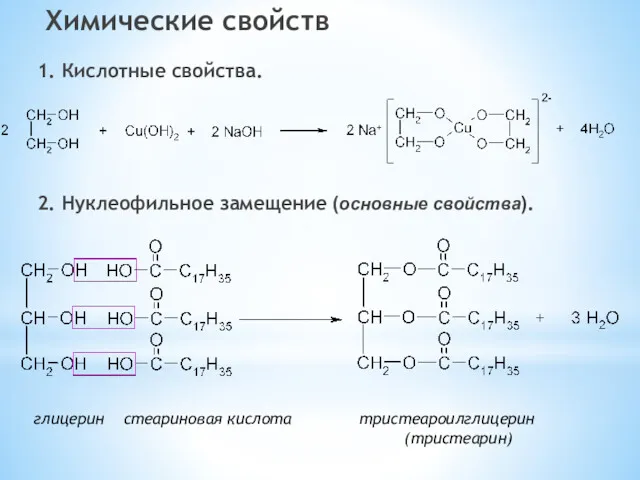
- 26. Химические свойств 1. Кислотные свойства. 2. Нуклеофильное замещение (основные свойства). глицерин стеариновая кислота тристеароилглицерин (тристеарин)
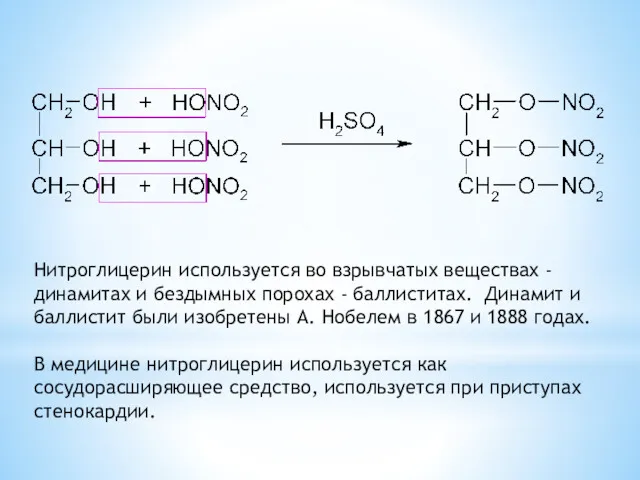
- 27. Нитроглицерин используется во взрывчатых веществах - динамитах и бездымных порохах - баллиститах. Динамит и баллистит были
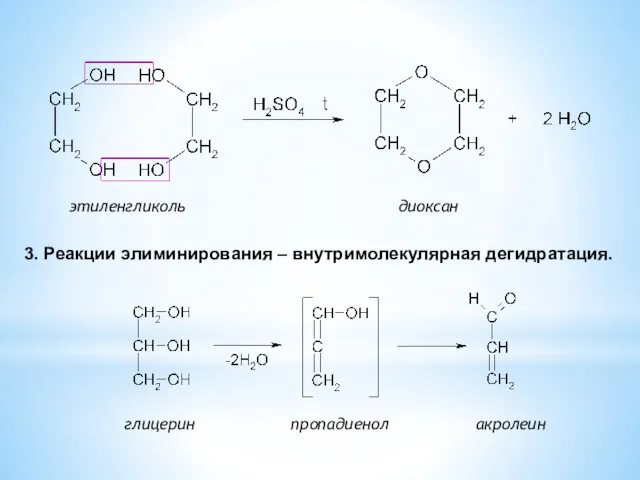
- 28. этиленгликоль диоксан 3. Реакции элиминирования – внутримолекулярная дегидратация. глицерин пропадиенол акролеин
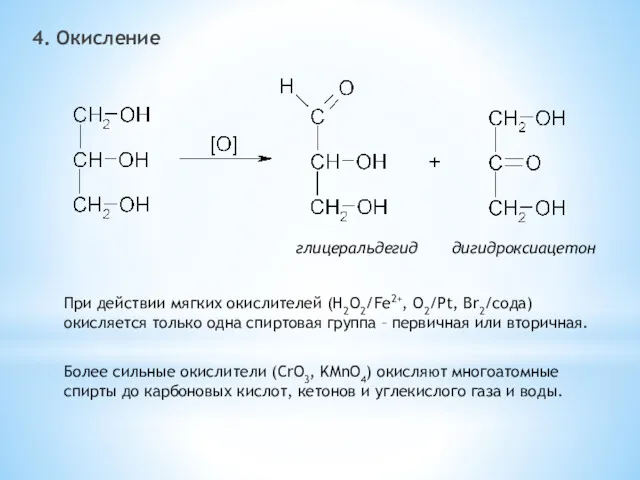
- 29. 4. Окисление глицеральдегид дигидроксиацетон При действии мягких окислителей (H2O2/Fe2+, O2/Pt, Br2/сода) окисляется только одна спиртовая группа
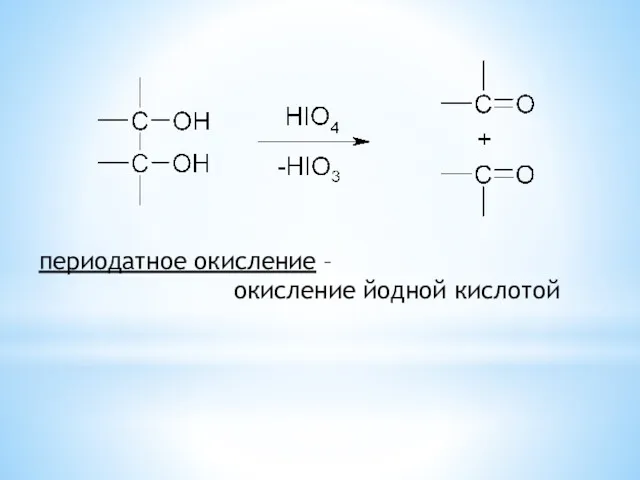
- 30. периодатное окисление – окисление йодной кислотой
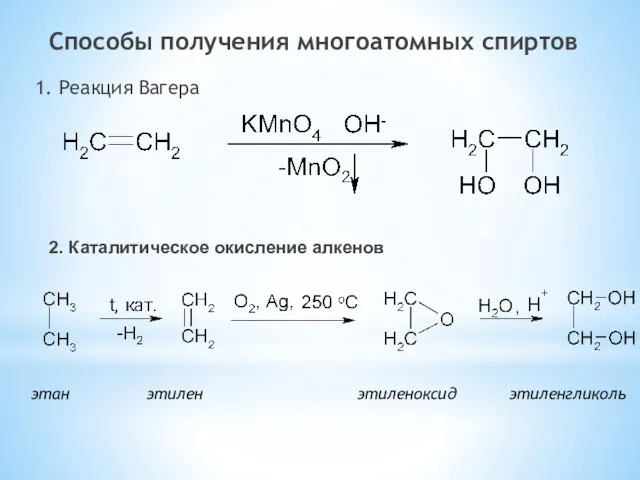
- 31. Способы получения многоатомных спиртов 1. Реакция Вагера этан этилен этиленоксид этиленгликоль 2. Каталитическое окисление алкенов
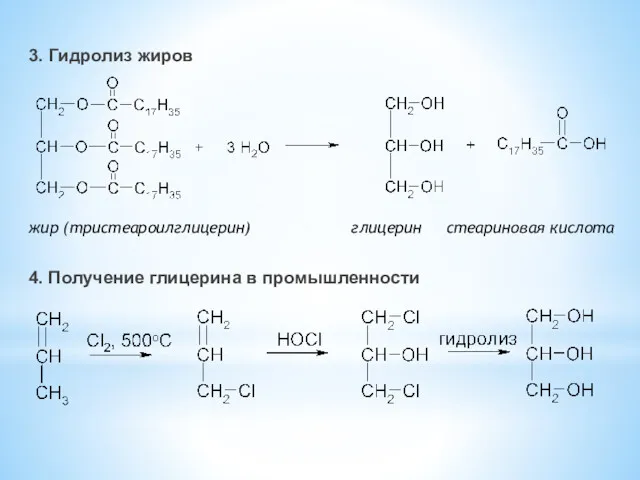
- 32. жир (тристеароилглицерин) глицерин стеариновая кислота 4. Получение глицерина в промышленности 3. Гидролиз жиров
- 34. Скачать презентацию








 Почему протекают химические реакции
Почему протекают химические реакции Свойства топлив. Марки бензинов и их характеристики
Свойства топлив. Марки бензинов и их характеристики An introduction to the chemistry of alkenes
An introduction to the chemistry of alkenes Реакции при участии катализатора
Реакции при участии катализатора Химическая связь
Химическая связь Observing change. Chemical reactions
Observing change. Chemical reactions Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Водород
Водород Водород. Урок химии
Водород. Урок химии Щелочные металлы
Щелочные металлы Знатоки химии. Викторина
Знатоки химии. Викторина Массовая доля вещества в растворе
Массовая доля вещества в растворе Радиоактивные элементы
Радиоактивные элементы Алкадиены. Диеновые углеводороды
Алкадиены. Диеновые углеводороды Карбоновые кислоты. Строение
Карбоновые кислоты. Строение Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Хлор. Состав. Строение
Хлор. Состав. Строение Водород. Распространенность в природе
Водород. Распространенность в природе Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп Электролиз расплавов и водных растворов солей
Электролиз расплавов и водных растворов солей Органические и неорганические вещества. Нуклеиновые кислоты
Органические и неорганические вещества. Нуклеиновые кислоты Физические свойства металлов
Физические свойства металлов Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов
Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева Алкадиены
Алкадиены Гідроліз солей
Гідроліз солей Получение водорода. Проверка Н2 на чистоту. Практическая работа
Получение водорода. Проверка Н2 на чистоту. Практическая работа Щелочные металлы
Щелочные металлы