Содержание
- 2. Положение в периодической системе химических элементов Д.И.Менделеева I группа главная подгруппа. Увеличивается радиус атомов , растет
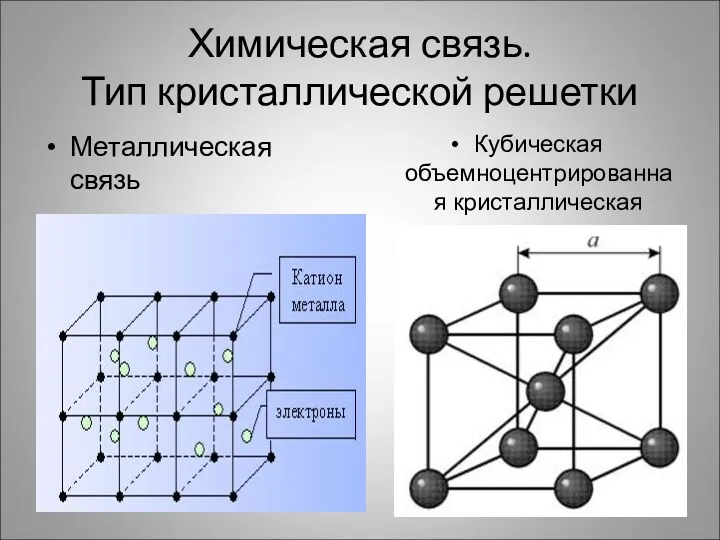
- 4. Химическая связь. Тип кристаллической решетки Металлическая связь Кубическая объемноцентрированная кристаллическая решетка
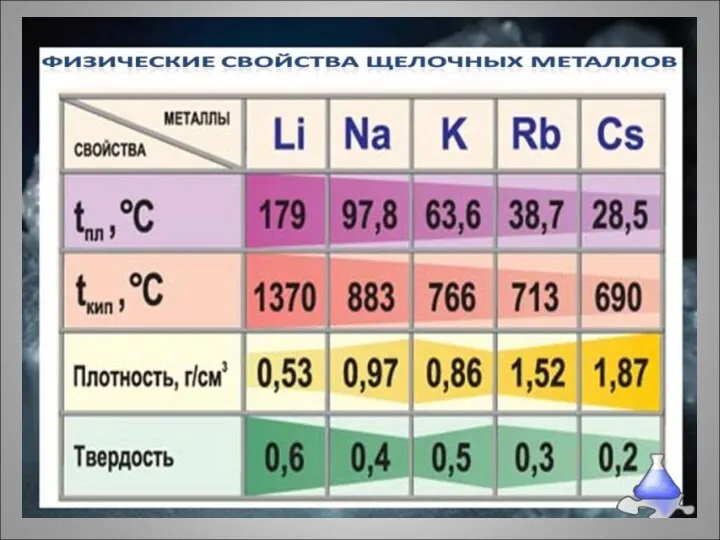
- 7. Щелочные металлы – простые вещества Литий Натрий Литий и натрий - мягкие щелочные металлы серебристо-белого цвета
- 8. Щелочные металлы Калий Рубидий Калий и рубидий мягкие щелочные металлы серебристо-белого цвета
- 9. Щелочные металлы цезий Цезий 99,99999% в ампуле Мягкий щелочной металл золотисто-белого цвета
- 10. Франций Франций - щелочной металл, обладающий как радиоактивностью, так и высокой химической активностью . Не имеет
- 11. Химические свойства щелочных металлов Типичные металлы, очень сильные восстановители. В соединениях проявляют единственную степень окисления +1.
- 12. Химические свойства 2Na + Cl2 = 2NaCl (в атмосфере F2 и Cl2 щелочные Me самовоспламеняются) 4Li
- 13. Качественное определение щелочных металлов Li+ Na+ K+ Для распознавания соединений щелочных металлов по окраске пламени исследуемое
- 14. Получение щелочных металлов 1) Электролиз расплавов соединений щелочных металлов: 2МеCl = 2Ме + Cl2 4МеOH =
- 15. Применение щелочных металлов БИОЛОГИЧЕСКАЯ РОЛЬ И ПРИМЕНЕНИЕ СОЕДИНЕНИЙ КАЛИЯ И НАТРИЯ
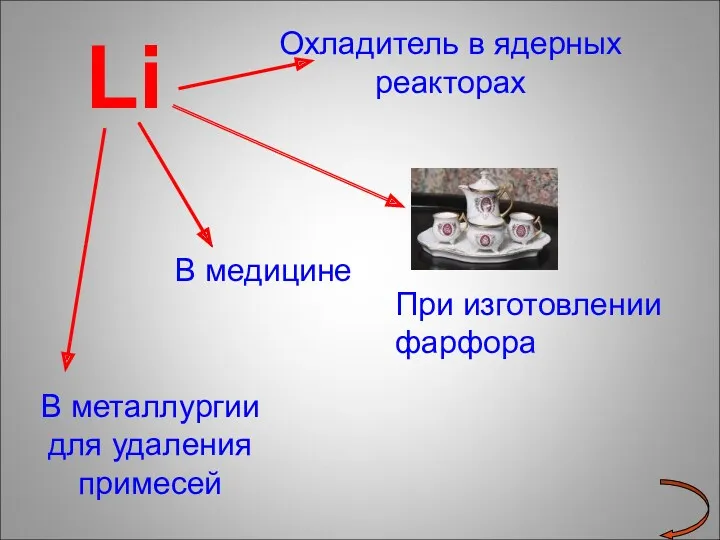
- 16. Li Охладитель в ядерных реакторах В медицине В металлургии для удаления примесей При изготовлении фарфора
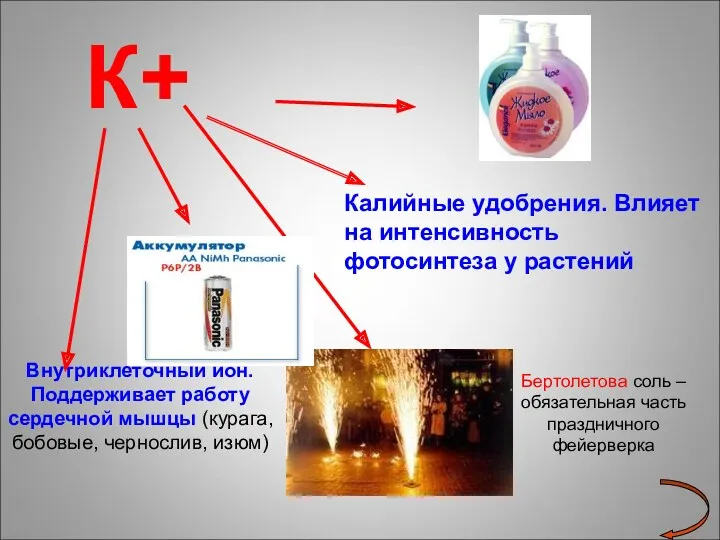
- 17. К+ Внутриклеточный ион. Поддерживает работу сердечной мышцы (курага, бобовые, чернослив, изюм) Калийные удобрения. Влияет на интенсивность
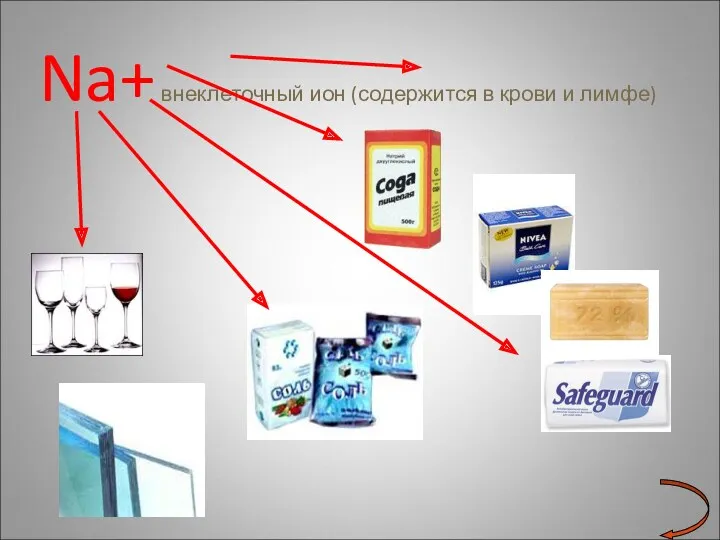
- 18. Na+ внеклеточный ион (содержится в крови и лимфе)
- 20. Скачать презентацию












 Коррозия металлов
Коррозия металлов 5.Алкины
5.Алкины Углерод и его свойства
Углерод и его свойства Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Начала органической химии
Начала органической химии Сплавы и их свойства. Легирующие добавки
Сплавы и их свойства. Легирующие добавки Алкины. Тема 4
Алкины. Тема 4 Центрифугирование
Центрифугирование Свойства кислорода. Получение кислорода методом вытеснения воздуха
Свойства кислорода. Получение кислорода методом вытеснения воздуха Механическая смесь и растворы
Механическая смесь и растворы Химические реакции
Химические реакции Алкадиены
Алкадиены Ионное произведение воды. Водородный показатель
Ионное произведение воды. Водородный показатель Mineralogy. Chemical composition and properties of minerals
Mineralogy. Chemical composition and properties of minerals Нафталин
Нафталин Электролиз. Классификация
Электролиз. Классификация Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды
Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды Гидролиз органических и неорганических веществ, солей
Гидролиз органических и неорганических веществ, солей Свойства воды
Свойства воды Отдаленные последствия токсического воздействия. Гигиена труда в с/х при работе с ядохимикатами
Отдаленные последствия токсического воздействия. Гигиена труда в с/х при работе с ядохимикатами Основные классы неорганических соединений
Основные классы неорганических соединений Алюминий и его соединения
Алюминий и его соединения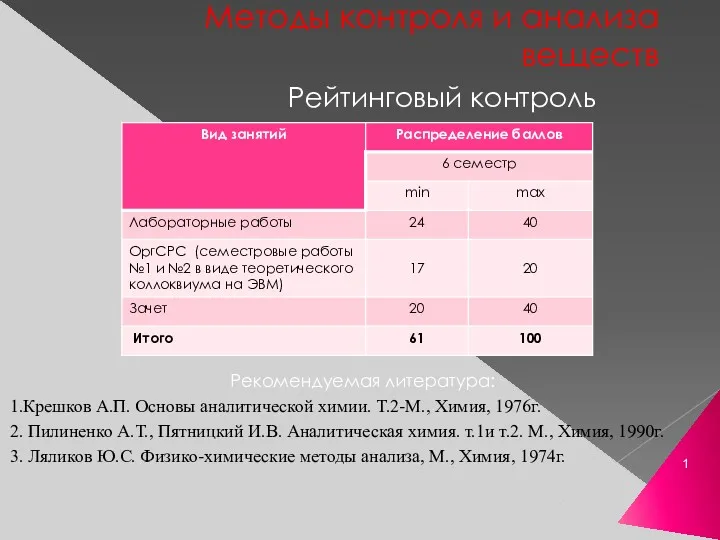 Методы контроля и анализа веществ
Методы контроля и анализа веществ Всероссийская олимпиада школьников по химии (региональный этап). Разбор заданий, 9 класс
Всероссийская олимпиада школьников по химии (региональный этап). Разбор заданий, 9 класс Алкины
Алкины Химия аминокислот. Лекция № 4
Химия аминокислот. Лекция № 4 Прочность полимеров
Прочность полимеров