Содержание
- 2. План лекции Способы классификации Показатели коррозии Механизм электрохимической коррозии Термодинамика электрохимической коррозии Методы защиты металлов от
- 3. Коррозия металлов Самопроизвольное разрушение металлов и сплавов вследствие их взаимодействия с окружающей средой Классификация по механизму
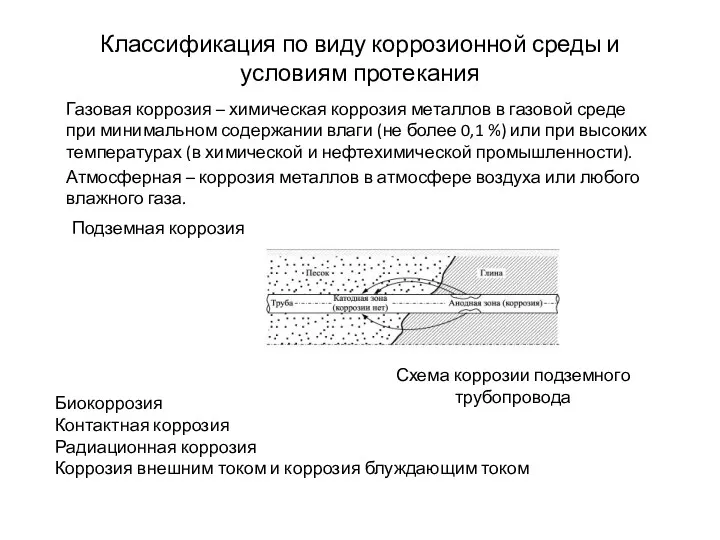
- 4. Классификация по виду коррозионной среды и условиям протекания Газовая коррозия – химическая коррозия металлов в газовой
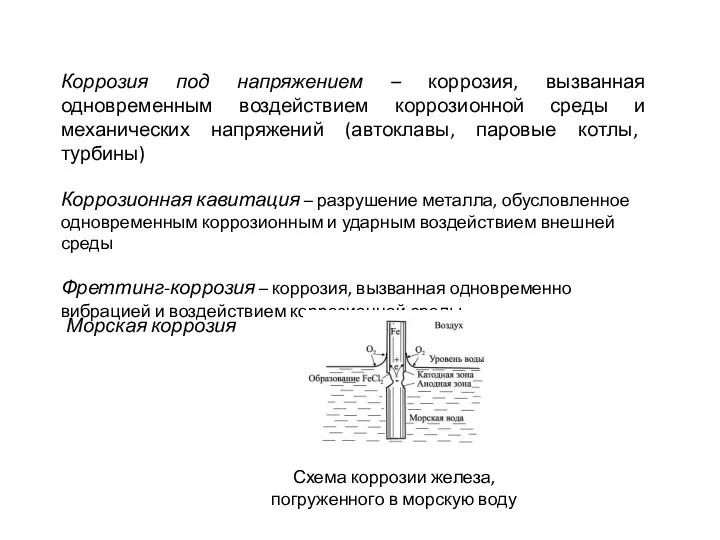
- 5. Коррозия под напряжением – коррозия, вызванная одновременным воздействием коррозионной среды и механических напряжений (автоклавы, паровые котлы,
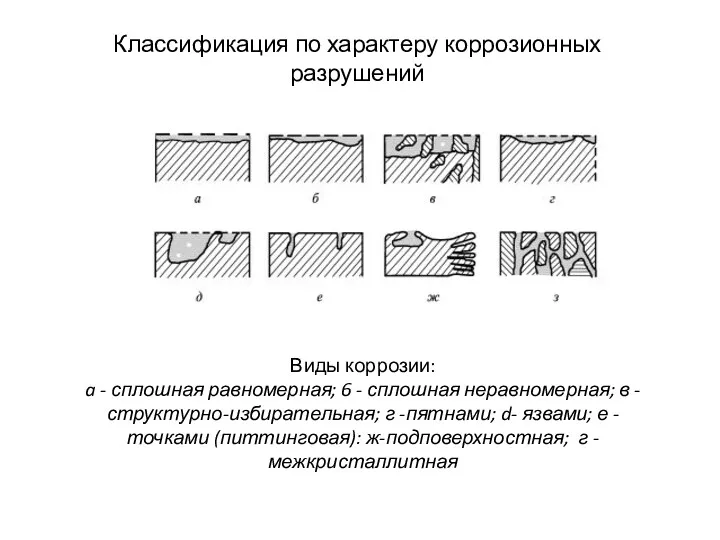
- 6. Классификация по характеру коррозионных разрушений Виды коррозии: a - сплошная равномерная; 6 - сплошная неравномерная; в
- 7. Показатели коррозии Истинная или мгновенная дифференциальная скорость коррозии в момент времени t: Средняя интегральная скорость: где
- 8. Механизм электрохимической коррозии Анодное окисление металла: Катодное восстановление окислителя (Ох: H+, H2O, O2, Cl- ): Перенос
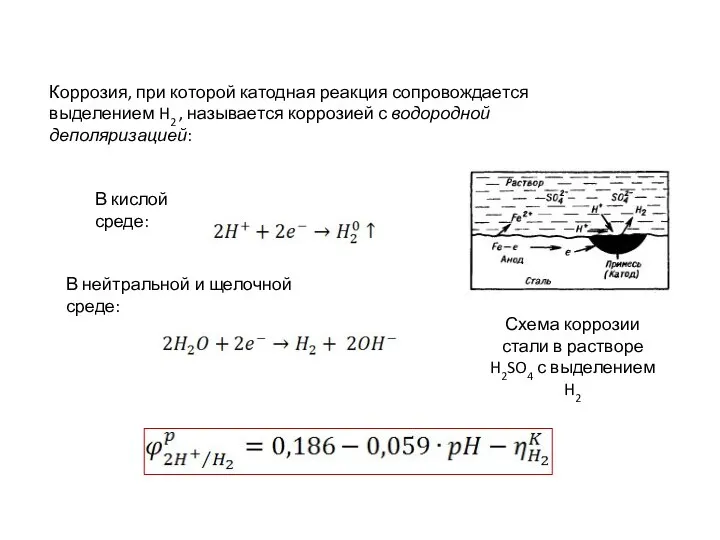
- 9. В нейтральной и щелочной среде: В кислой среде: Коррозия, при которой катодная реакция сопровождается выделением H2
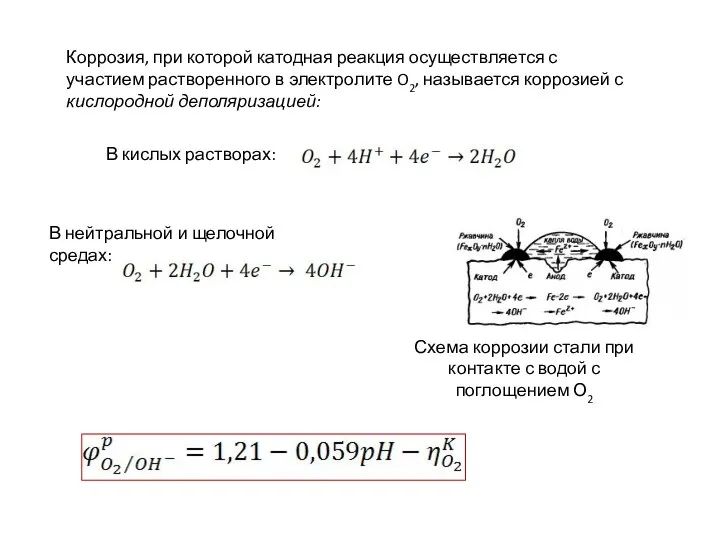
- 10. Коррозия, при которой катодная реакция осуществляется с участием растворенного в электролите O2, называется коррозией с кислородной
- 11. Для электрохимических реакций свободная энергия Гиббса: Термодинамика электрохимической коррозии Условие возможности электрохимической коррозии с водородной и
- 12. Методы защиты металлов от коррозии Основным условием противокоррозионной защиты металлов является уменьшение скорости коррозии. Уменьшить скорость
- 13. Гальванические покрытия Преимущества электроосаждения перед другими методами защиты от коррозии: позволяет регулировать толщину слоя; экономно расходовать
- 14. Анодные и катодные покрытия По отношению к стали цинковое покрытие является анодным : медное покрытие –
- 15. Электрохимическая защита Основана на снижении скорости коррозии металлов путем смещения потенциала до значений, соответствующих крайне низким
- 16. Электрохимическая защита Анодная защита: при анодной защите потенциал защищаемой конструкции смещают в положительную сторону до достижения
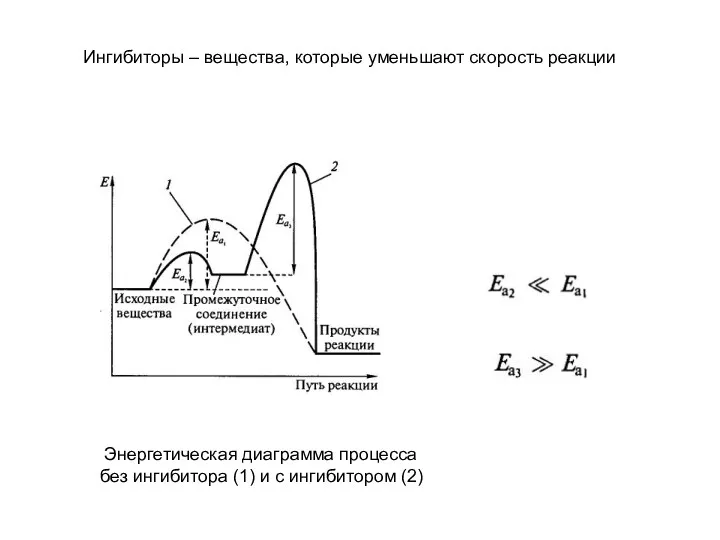
- 17. Энергетическая диаграмма процесса без ингибитора (1) и с ингибитором (2) Ингибиторы – вещества, которые уменьшают скорость
- 18. Примеры решения задач Определите возможность электрохимической коррозии гальванопары Fe/Sn в среде электролита с рН = 3
- 19. 4. Расчет потенциалов катодных процессов: 5. Определение возможности коррозии: Вывод: В заданных условиях корродирует железо с
- 21. Скачать презентацию












 Последствия применения удобрений в сельском хозяйстве
Последствия применения удобрений в сельском хозяйстве Аминокислоты и белки
Аминокислоты и белки Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Энергетика химических реакций
Энергетика химических реакций Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Создание слоев пористого кремния на p-Si
Создание слоев пористого кремния на p-Si Химические свойства серной кислоты
Химические свойства серной кислоты Белки. Строение и свойства
Белки. Строение и свойства Аммиак. Соли аммония
Аммиак. Соли аммония Сағыз пайдалы ма, әлде зиян ба?
Сағыз пайдалы ма, әлде зиян ба? Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2
Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2 Задачи на избыток-недостаток
Задачи на избыток-недостаток Кислородные соединения азота. Азотная кислота
Кислородные соединения азота. Азотная кислота Basis Sets and Pseudopotentials
Basis Sets and Pseudopotentials Основные задачи и понятия химической метрологии
Основные задачи и понятия химической метрологии Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Органічна хімія. Теорія хімічної будови. Гомологічні ряди. Алкани
Органічна хімія. Теорія хімічної будови. Гомологічні ряди. Алкани Основания - свойства ТЭД
Основания - свойства ТЭД Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И. Менделеева
Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И. Менделеева Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении
Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении Строение атома
Строение атома Электролиз: опыты к заданиям ЕГЭ
Электролиз: опыты к заданиям ЕГЭ Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали, галогени, інертні гази
Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали, галогени, інертні гази Alyuminiy_ego_soedinenia
Alyuminiy_ego_soedinenia Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною
Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною Топливо. Виды топлива
Топливо. Виды топлива Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл