Содержание
- 2. Термодинамика система - открытая - закрытая - изолированная
- 3. Тепловая энергия Q, [Дж] Параметры состояния: P, T, V, состав системы
- 4. Функции состояния: Внутренняя энергия U, Энтальпия H, Энтропия S, Энергия Гиббса (изобарно-изотермический потенциал) G.
- 5. Первый закон термодинамики Q = ΔU + A ΔU = U2 – U1, U2 и U1
- 6. Изохорный процесс: V=const, ΔV = 0, А = 0, тогда QV = ΔU Изобарный процесс: Р=const
- 7. H = U + рV, Отсюда: Qp = Н2 – Н1 = ΔН ΔH > 0
- 8. H2(г) + 1/2О2(г) → H2O(ж); ΔrH = –285,84 кДж при 25°С и 101 кПа ΔH°обр или
- 9. ΔfH°298(O2) = 0, ΔfH°298(C(графит)) = 0, Однако: ΔfH°298(O3) = 142,3 кДж/моль, ΔfH°298(C(алмаз)) = 1,828 кДж/моль
- 10. Закон Лавуазье-Лапласа 1/2H2 (г) + 1/2Сl2(г) → HCl(г); ΔrH°298(HCl) = –92 кДж HCl(г) → 1/2H2 (г)
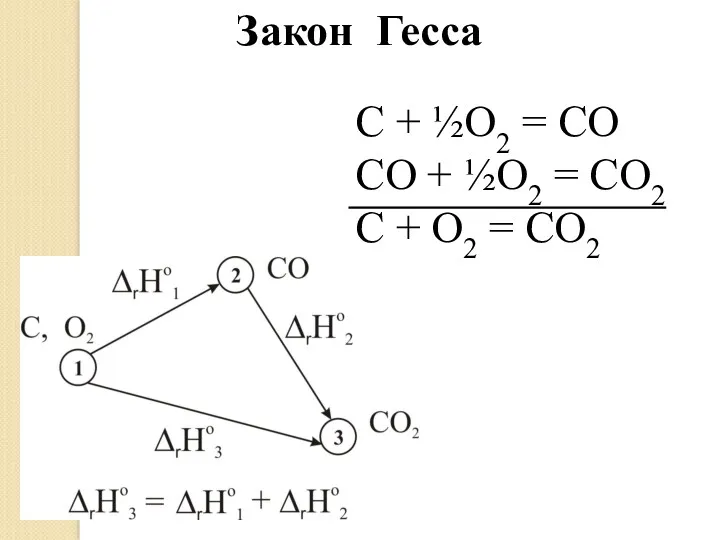
- 11. C + ½O2 = CO CO + ½O2 = CO2 C + O2 = CO2 Закон
- 12. Следствие из закона Гесса: ΔH = Для реакции в общем виде: аА + bB → cC
- 13. Пример: Вычислить тепловой эффект реакции горения бензола по стандартным энтальпиям образования С6Н6(ж) + 7/2О2(г) = 6СО2(г)
- 14. Энтропия, S [Дж/(моль⋅К)] Процессы, для которых ΔS > 0: 1) расширение газов; 2) Sтв SН2О(пар) =
- 15. Процессы, для которых ΔS 1) сжатие газов; 2) конденсация и кристаллизация веществ. S = Рассчитывается по
- 16. NH4NO2(к) = N2О(г) + 2H2О(г) V1 V2 V1 △S > 0 2H2S(г) + 3O2(г)= 2H2О(к) +
- 17. Энергия Гиббса, ΔG, [кДж/моль] ΔG = ΔН – ТΔS
- 18. ΔG ΔG > 0 – процесс термодинамически невозможен (реакция не идет); ΔG = 0 – система
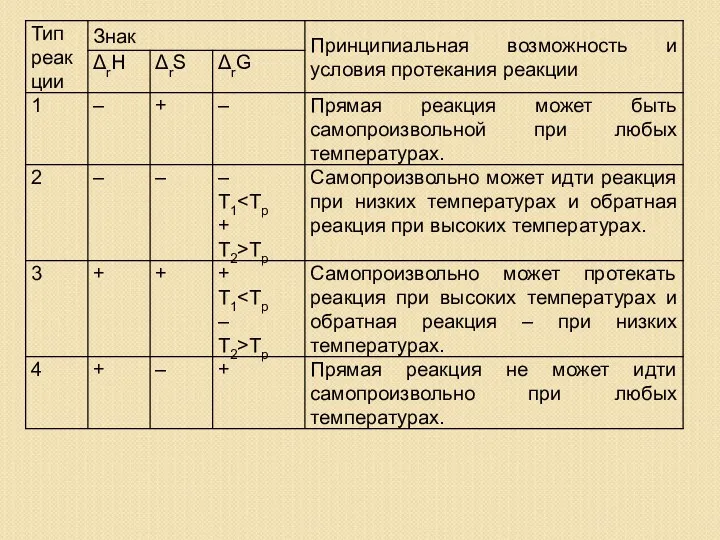
- 19. Возможность протекания реакции Реакция экзотермическая ΔН 0, ΔН ΔG = ΔН – ТΔS то всегда ΔG
- 20. Реакция эндотермическая ΔН > 0, ΔS ΔН > 0, ΔS > 0, ΔG = ΔН –
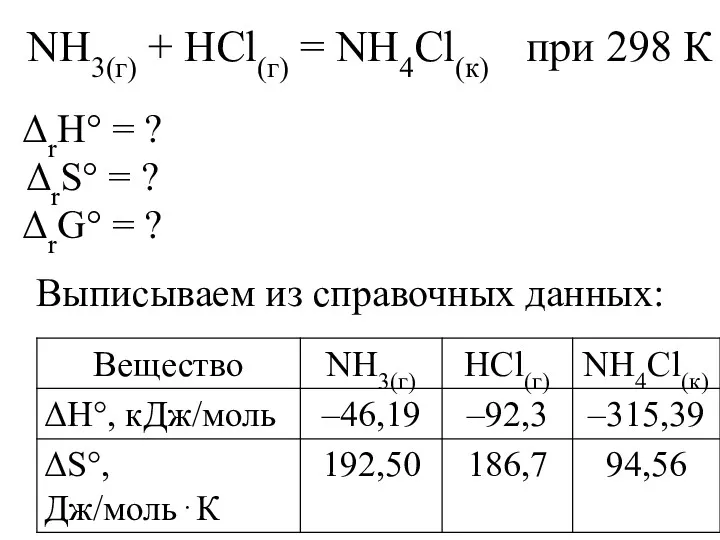
- 22. NH3(г) + HCl(г) = NH4Сl(к) при 298 К Выписываем из справочных данных: ΔrН° = ? ΔrS°
- 23. Из з-на Гесса энтальпия реакции: ΔrН° = ΔН°(NH4Сl(к)) – ΔН°(NH3(г)) – ΔН°(HCl(г)) = –315,39 – (–46,19
- 25. Скачать презентацию

![Тепловая энергия Q, [Дж] Параметры состояния: P, T, V, состав системы](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/180309/slide-2.jpg)





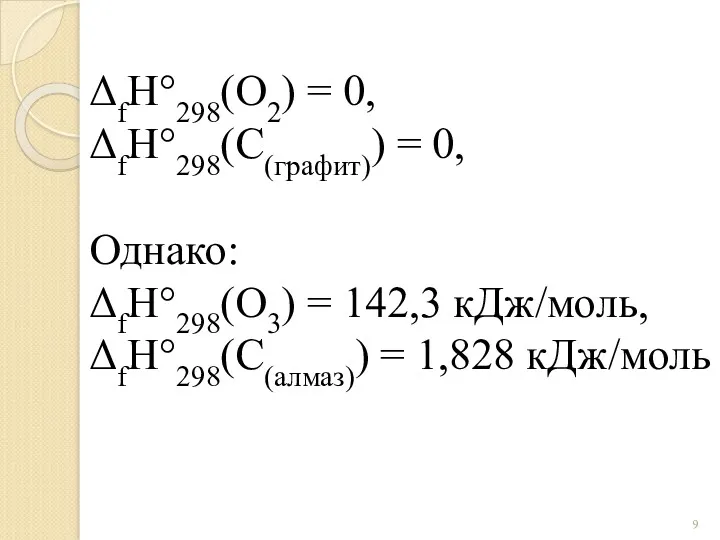



![Энтропия, S [Дж/(моль⋅К)] Процессы, для которых ΔS > 0: 1)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/180309/slide-13.jpg)

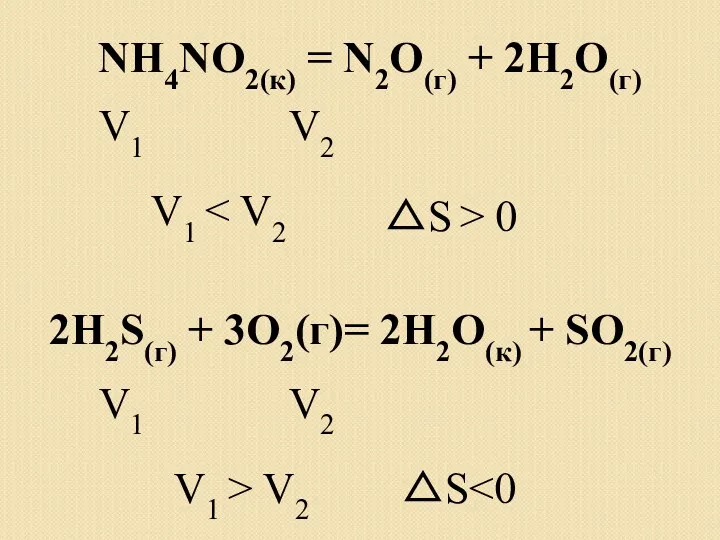
![Энергия Гиббса, ΔG, [кДж/моль] ΔG = ΔН – ТΔS](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/180309/slide-16.jpg)




 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей