Содержание
- 2. Я металл, серебристый и лёгкий, И зовусь самолётный металл, И покрыт я оксидною плёнкой Чтоб меня
- 4. Al +13 2 8 3 Al0 - 3ē → Al+3 Степень окисления алюминия в его соединениях
- 8. Алюминий представляет собой серебристо-белый металл. Лёгкий (ρ=2,7г/см3) и мягкий. Плавится при температуре 660 0С. Он очень
- 9. Нахождение алюминия в природе В земной коре содержится 8,8 % алюминия. Алюминий занимает 3 место по
- 10. Соединения алюминия Алюмосиликаты Бокситы Корунд (Al2O3)
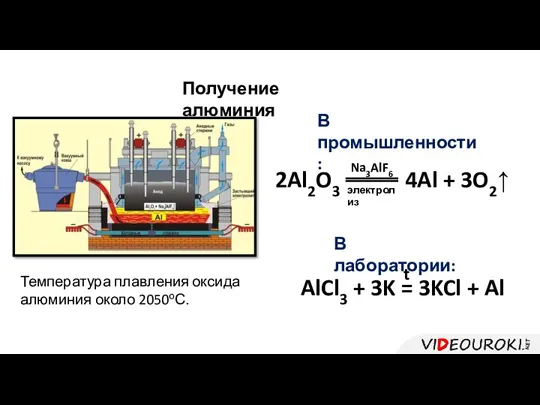
- 11. Получение алюминия AlCl3 + 3K = 3KCl + Al t В лаборатории: В промышленности: 2Al2O3 4Al
- 12. По объёму производства алюминий занимает 2 место после железа и его сплавов (среди металлов). Для выплавки
- 13. Алюминий – активный металл. Алюминий покрыт прочной и тонкой плёнкой оксида. Механически разрушить плёнку сложно. Амальгамированный
- 14. Реакция с кислородом Химические свойства 4Al + 3O2 = 2Al2O3 оксид алюминия t 0 0 +3
- 16. Реакции с неметаллами хлорид алюминия t 0 0 +3 -1 6 ē Аl – восстановитель Неметаллы
- 17. Реакция с йодом Химические свойства 2Al + 3I2 = 2AlI3 йодид алюминия
- 18. Реакция с водой Химические свойства Восст-ль 2Al + 6HOH = 2Al(OH)3 + 3H2↑ 0 +3 +1
- 19. Реакции с растворами кислот Химические свойства Восст-ль 0 +3 +1 0 Ок-ль 2Al + 3H2SO4 =
- 20. Концентрированные серная и азотная кислоты пассивируют поверхность алюминия.
- 21. Реакция со щелочами Химические свойства Восст-ль Ок-ль 2Al + 6KOH + 6H2O = 2K3[Al(OH)6] + 3H2↑
- 22. Алюминий является активным металлом. Алюминий реагирует с простыми веществами – неметаллами. Восстанавливает металлы до свободного состояния,
- 23. Al2O3 Белое, твёрдое вещество Широко распространён в природе Имеет высокую температуру плавления Обладает инертностью при обычных
- 24. Al2O3 + 2KOH = 2KAlO2 + H2O Al2O3 + CaO = Ca(AlO2)2 Al2O3 + 2KOH +
- 25. Получение оксида алюминия 2Al(OH)3 = Al2O3 + 3H2O t
- 26. Al(OH)3 Обладает амфотерными свойствами Получают осаждением из растворимых солей алюминия действием щелочей Реагирует с кислотами и
- 27. Химические свойства гидроксида алюминия Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + NaOH = Na[Al(OH)4]
- 28. AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl Al3+ + 3OH- = Al(OH)3↓
- 29. 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O 2Al(OH)3 + 6H+ = 2Al3+ + 6H2O
- 30. Al(OH)3 + NaOH = Na[Al(OH)4] Al(OH)3 + OH- = [Al(OH)4]-
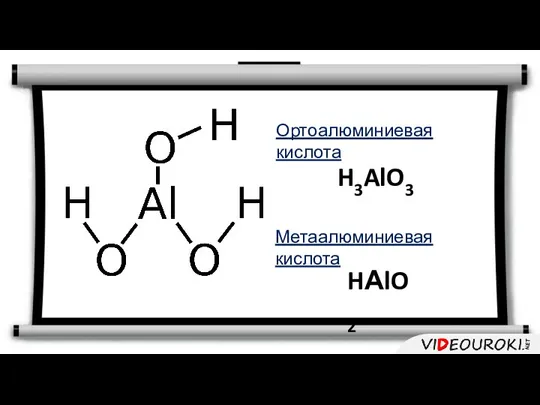
- 31. Ортоалюминиевая кислота H3AlO3 Метаалюминиевая кислота HАlO2
- 32. Благородная шпинель Драгоценный хризоберилл
- 33. Соли алюминия Все соли алюминия, кроме фосфатов, хорошо растворимы в воде Некоторые соли, такие как сульфиды,
- 34. Оксид алюминия при обычных условиях является достаточно инертным веществом и широко распространен в природе. Гидроксид алюминия
- 35. Al 1. Алюминий — самый распространённый металл в земной коре. 2. Обладает высокой коррозионной стойкостью и
- 36. Al
- 37. Al
- 38. Al
- 39. Al Алюминий — самый распространённый металл в природе. Он расположен в 3 периоде IIIA группы, имеет
- 41. Скачать презентацию























![Al(OH)3 + NaOH = Na[Al(OH)4] Al(OH)3 + OH- = [Al(OH)4]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/327339/slide-29.jpg)





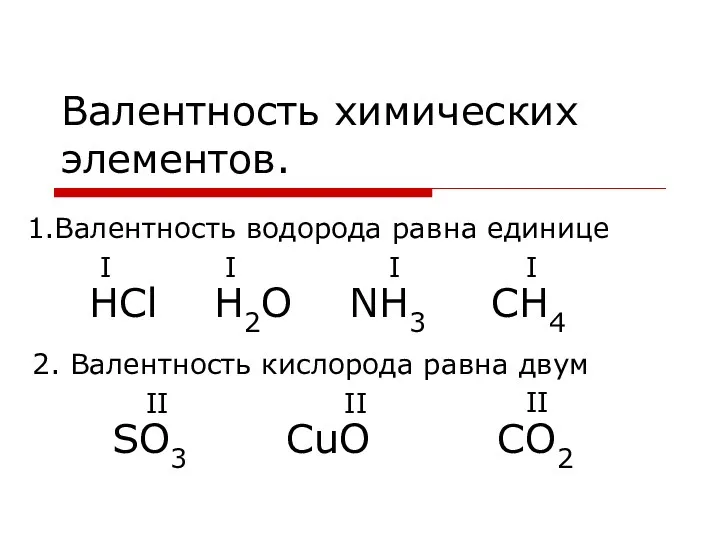 Валентность химических элементов
Валентность химических элементов Азотные удобрения
Азотные удобрения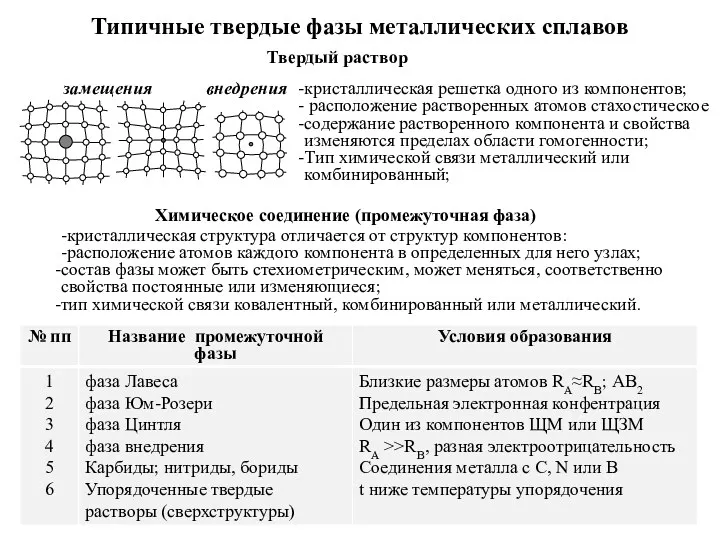 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Природные и синтетические полимеры
Природные и синтетические полимеры Тема 10- Гетроциклические соединения
Тема 10- Гетроциклические соединения Хинолин. Строение хинолина
Хинолин. Строение хинолина Дисперсные системы
Дисперсные системы Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией О каком веществе идёт речь?
О каком веществе идёт речь? Пористые адсорбенты. Лекция 06
Пористые адсорбенты. Лекция 06 Көміртек
Көміртек Массовая доля вещества в растворе. 8 класс
Массовая доля вещества в растворе. 8 класс Ауыр металлдар
Ауыр металлдар Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Карбоновые кислоты
Карбоновые кислоты Растворение. Растворы.
Растворение. Растворы. Алкадиены
Алкадиены Кристаллическое состояние вещества в природе
Кристаллическое состояние вещества в природе Окислительные свойства серной и азотной кислот
Окислительные свойства серной и азотной кислот Uses of chlorine and its compounds
Uses of chlorine and its compounds Удивительное вещество - вода
Удивительное вещество - вода Періодична система
Періодична система Ионная химическая связь
Ионная химическая связь Organic molecules
Organic molecules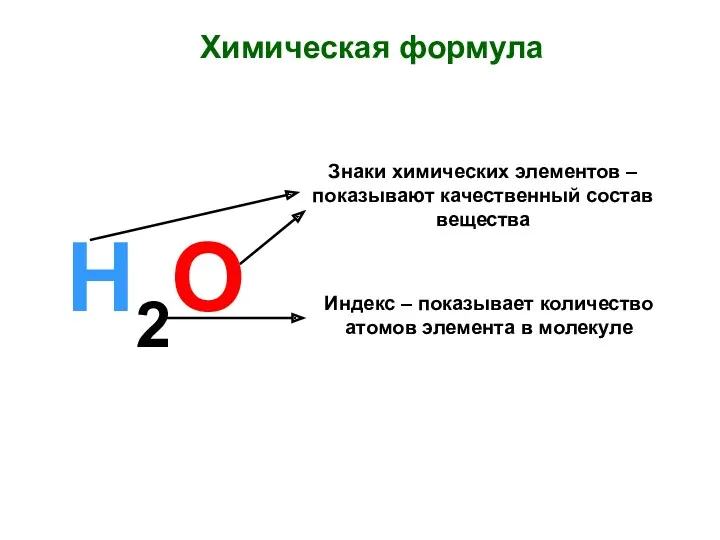 Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов Алюминий. Схема расположения электронов на энергетических подуровнях
Алюминий. Схема расположения электронов на энергетических подуровнях Материалы и изделия на основе полимеров. Лекция 16
Материалы и изделия на основе полимеров. Лекция 16 Поняття про родини хімічних елементів: лужні метали, галогени, інертні елементи. Урок хімії у 8 класі
Поняття про родини хімічних елементів: лужні метали, галогени, інертні елементи. Урок хімії у 8 класі