Содержание
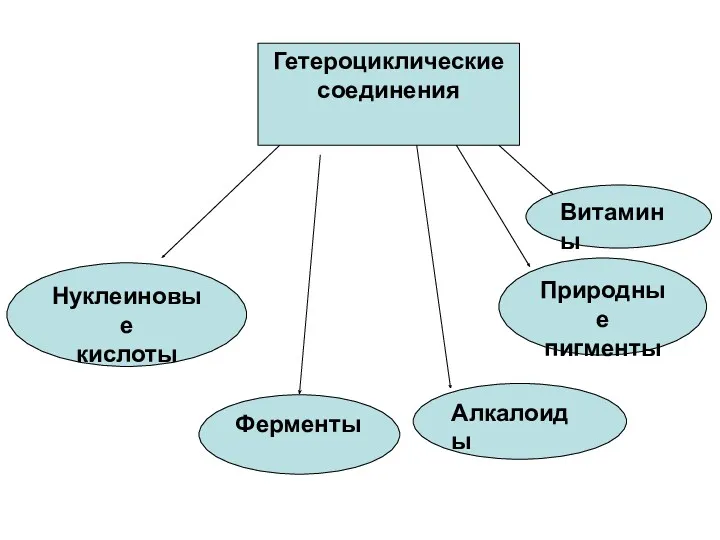
- 2. Гетероциклическими называются соединения, имеющие циклическую структуру и содержащие в цикле неуглеродные атомы (гетероатомы). Наибольшее распространение и
- 4. Классификация и номенклатура гетероциклов Гетероциклы классифицируются: 1) по величине цикла 2) по виду и количеству гетероатомов
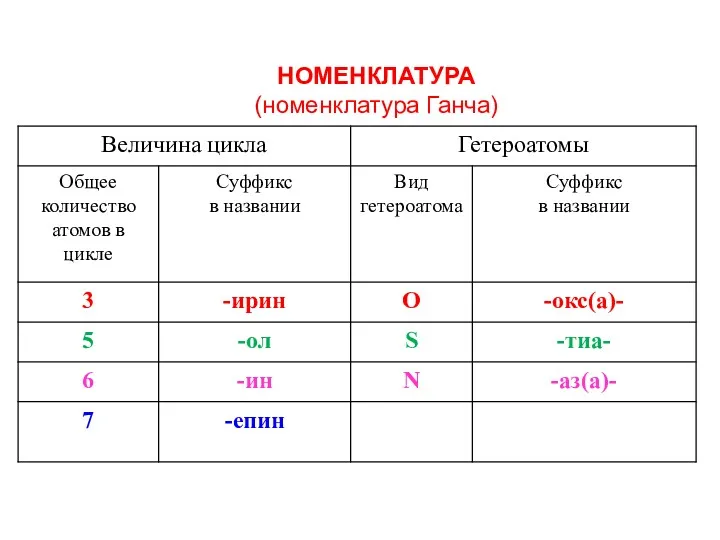
- 5. НОМЕНКЛАТУРА (номенклатура Ганча)
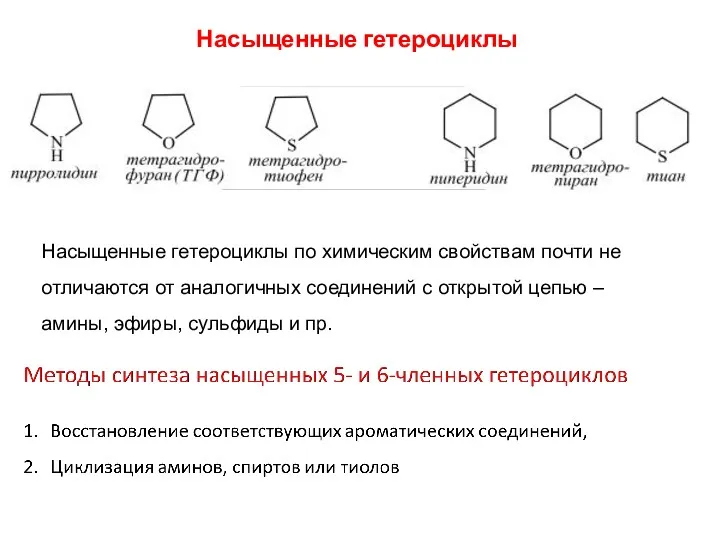
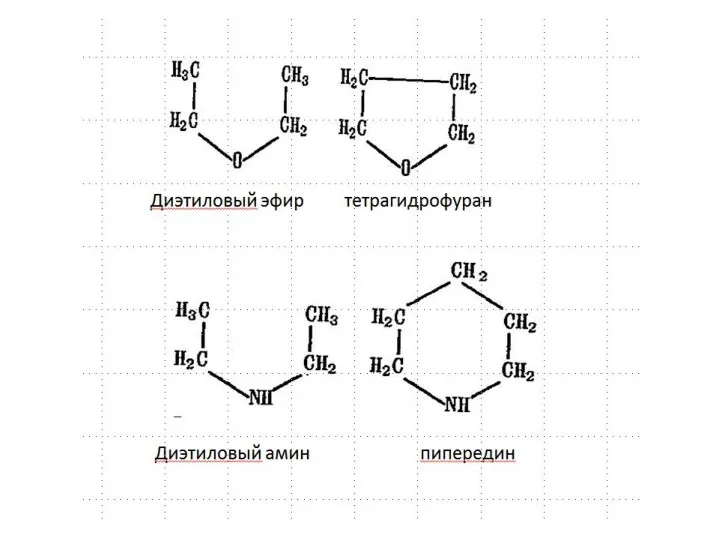
- 6. Насыщенные гетероциклы Насыщенные гетероциклы по химическим свойствам почти не отличаются от аналогичных соединений с открытой цепью
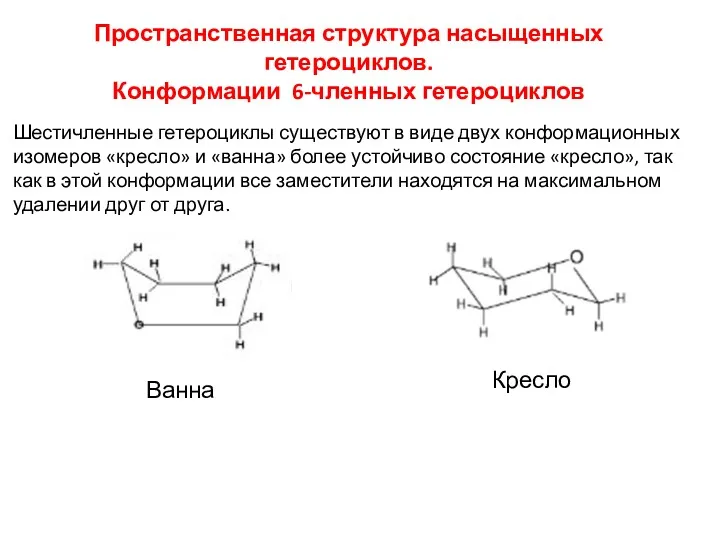
- 8. Пространственная структура насыщенных гетероциклов. Конформации 6-членных гетероциклов Шестичленные гетероциклы существуют в виде двух конформационных изомеров «кресло»
- 9. Пятичленные гетероциклы с одним гетероатомом Пятичленные гетероциклы с одним гетероатомом и двумя двойными С-С-связями отвечают требованиям
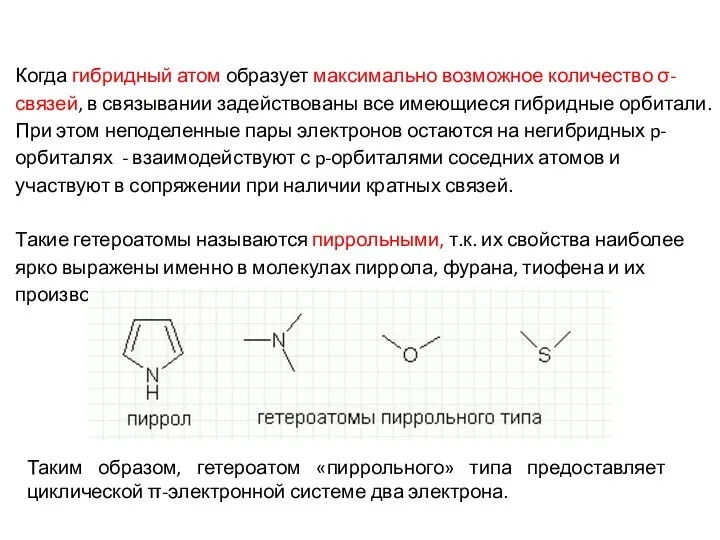
- 10. Когда гибридный атом образует максимально возможное количество σ-связей, в связывании задействованы все имеющиеся гибридные орбитали. При
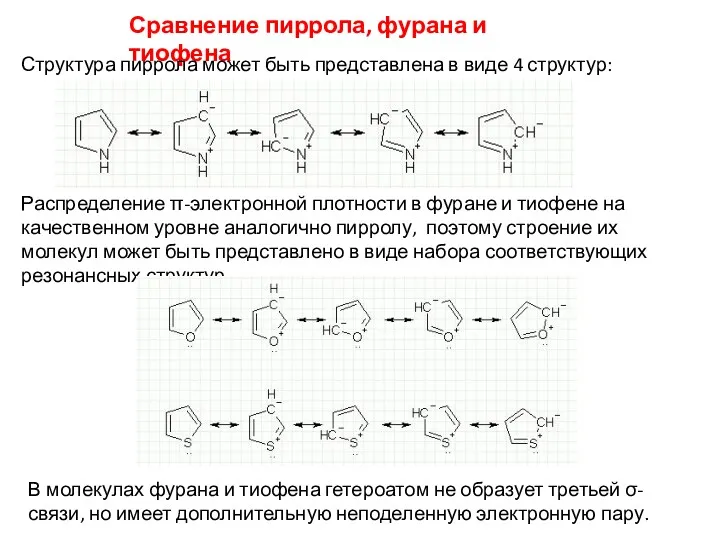
- 11. Сравнение пиррола, фурана и тиофена Структура пиррола может быть представлена в виде 4 структур: Распределение π-электронной
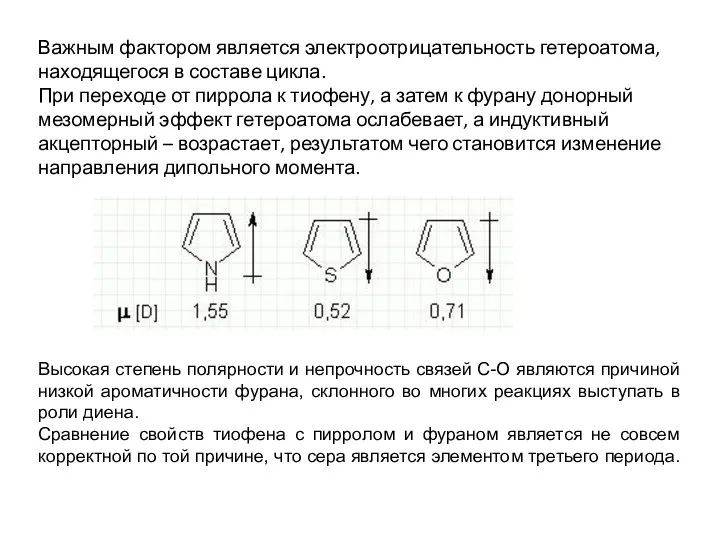
- 12. Важным фактором является электроотрицательность гетероатома, находящегося в составе цикла. При переходе от пиррола к тиофену, а
- 13. Химические свойства гетероциклов: - кислотно-основные превращения с участием гетероатома; - реакции присоединения; - реакции замещения: относительная
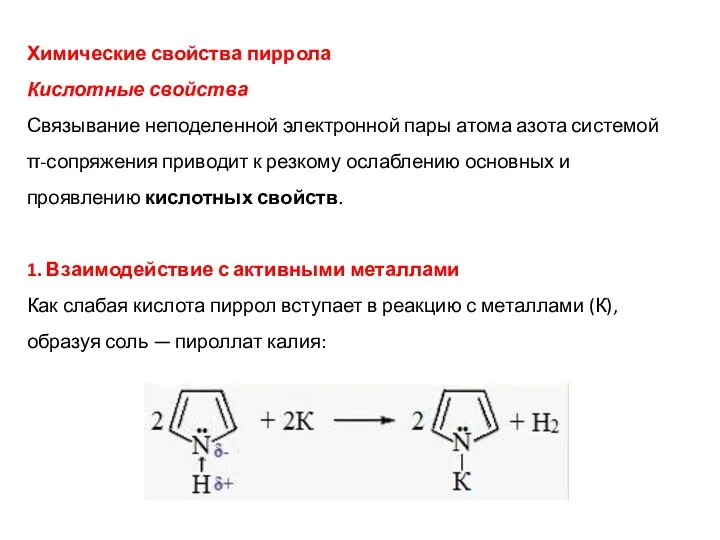
- 14. Химические свойства пиррола Кислотные свойства Связывание неподеленной электронной пары атома азота системой π-сопряжения приводит к резкому
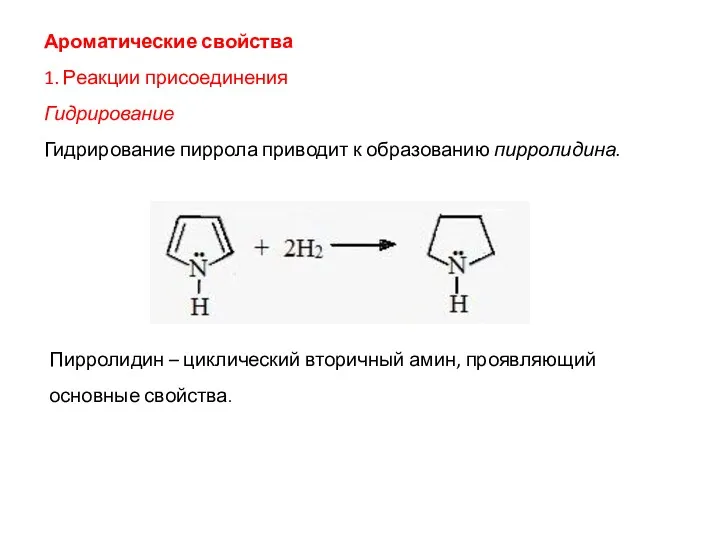
- 15. Ароматические свойства 1. Реакции присоединения Гидрирование Гидрирование пиррола приводит к образованию пирролидина. Пирролидин – циклический вторичный
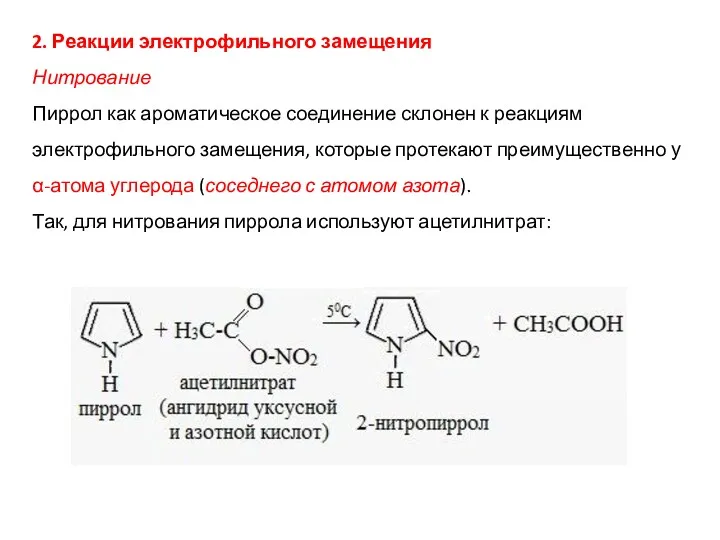
- 16. 2. Реакции электрофильного замещения Нитрование Пиррол как ароматическое соединение склонен к реакциям электрофильного замещения, которые протекают
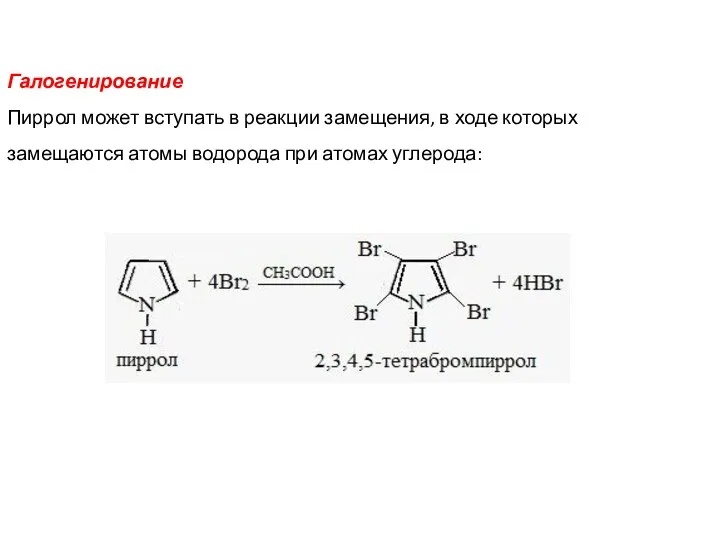
- 17. Галогенирование Пиррол может вступать в реакции замещения, в ходе которых замещаются атомы водорода при атомах углерода:
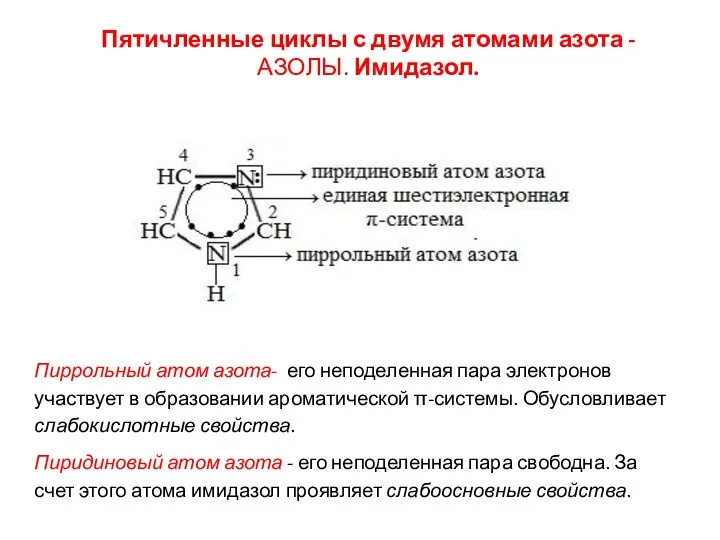
- 18. Пятичленные циклы с двумя атомами азота - АЗОЛЫ. Имидазол. Пиррольный атом азота- его неподеленная пара электронов
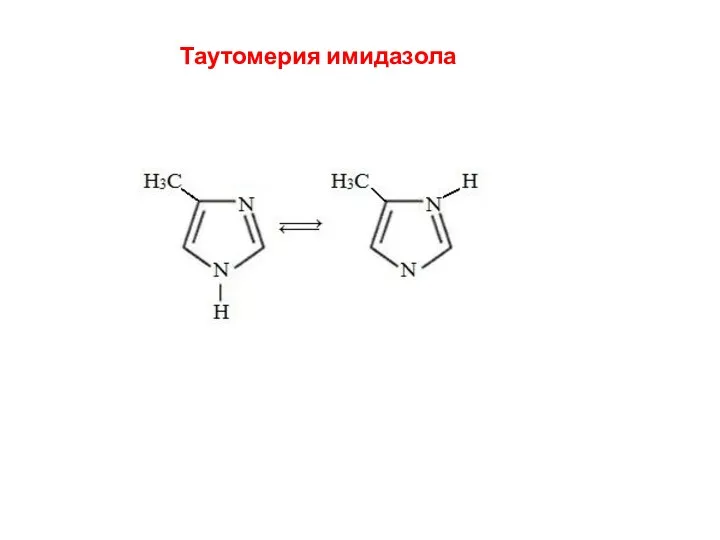
- 19. Таутомерия имидазола
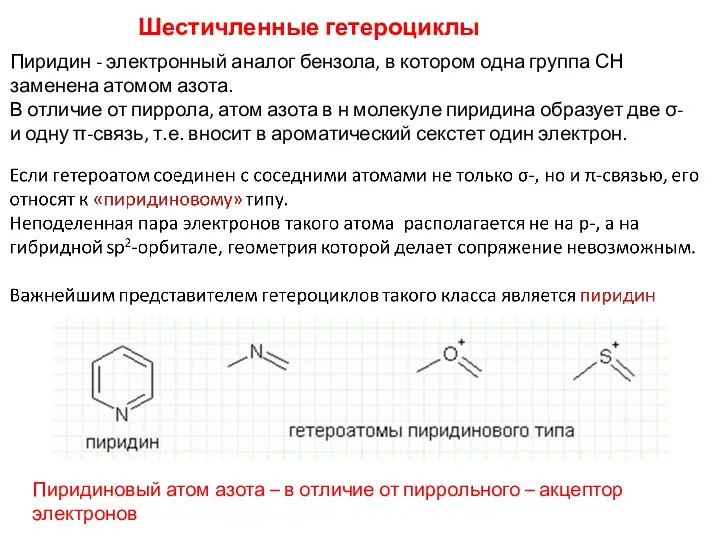
- 20. Шестичленные гетероциклы Пиридин - электронный аналог бензола, в котором одна группа СН заменена атомом азота. В
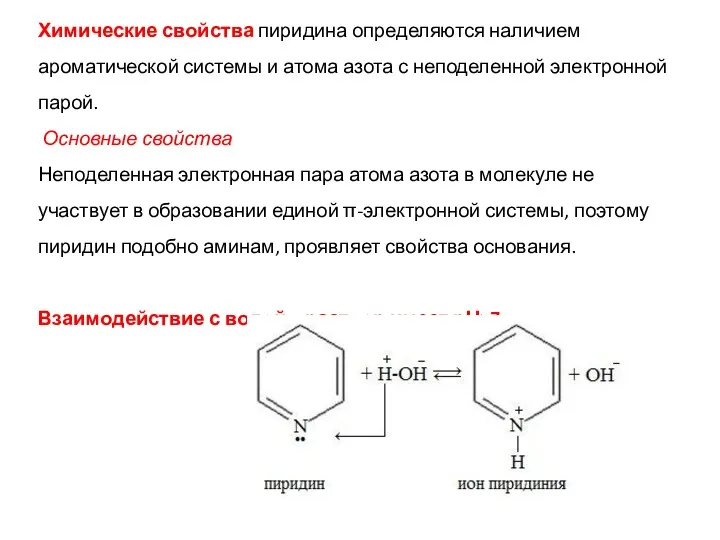
- 21. Химические свойства пиридина определяются наличием ароматической системы и атома азота с неподеленной электронной парой. Основные свойства
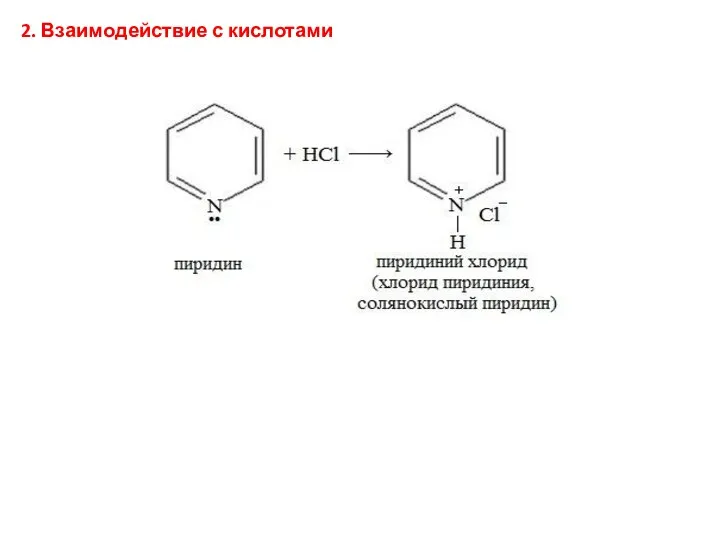
- 22. 2. Взаимодействие с кислотами
- 23. Ароматические свойства Реакции электрофильного замещения Так же как и бензол, пиридин вступает в реакции электрофильного замещения,
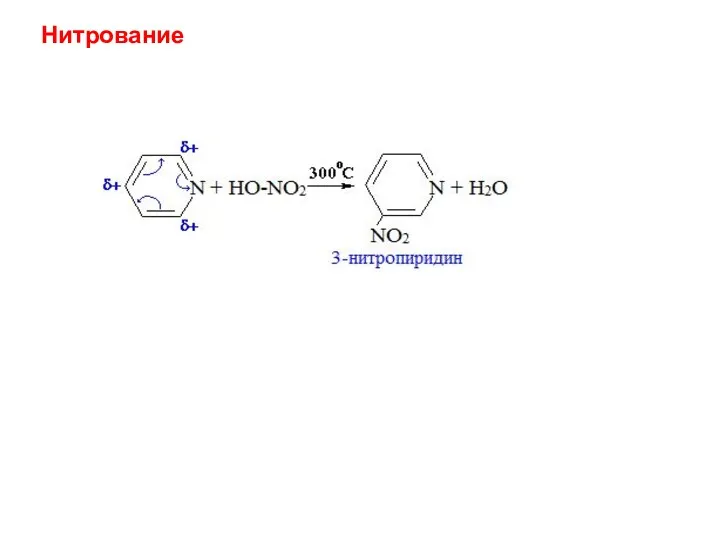
- 24. Нитрование
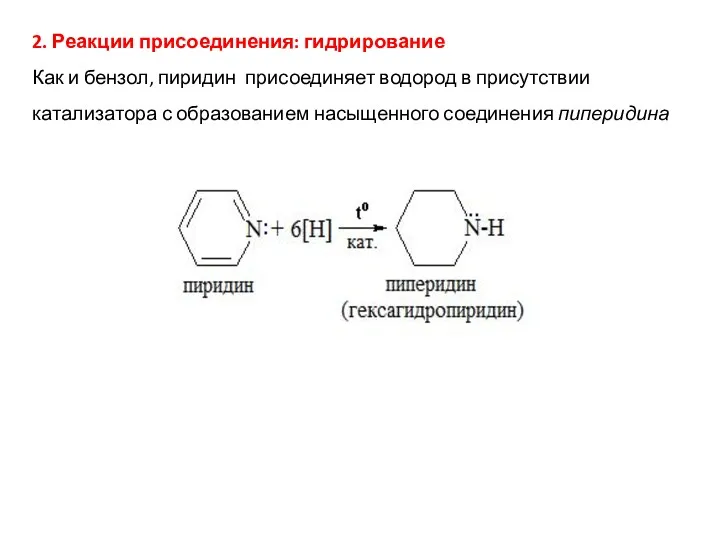
- 25. 2. Реакции присоединения: гидрирование Как и бензол, пиридин присоединяет водород в присутствии катализатора с образованием насыщенного
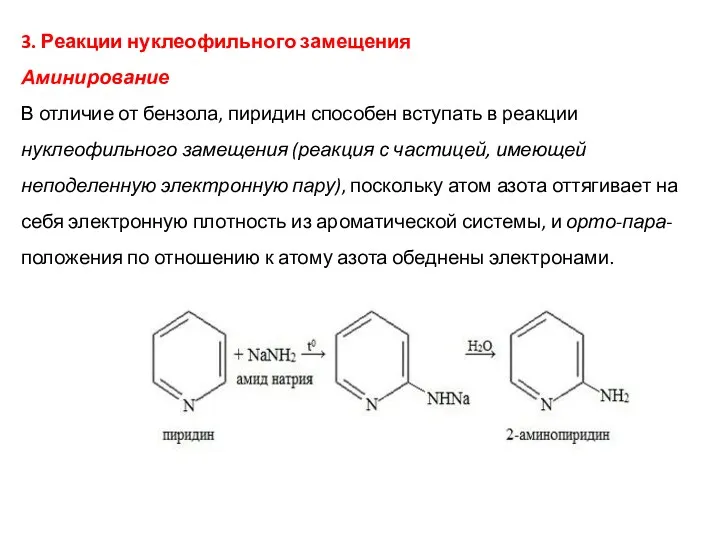
- 26. 3. Реакции нуклеофильного замещения Аминирование В отличие от бензола, пиридин способен вступать в реакции нуклеофильного замещения
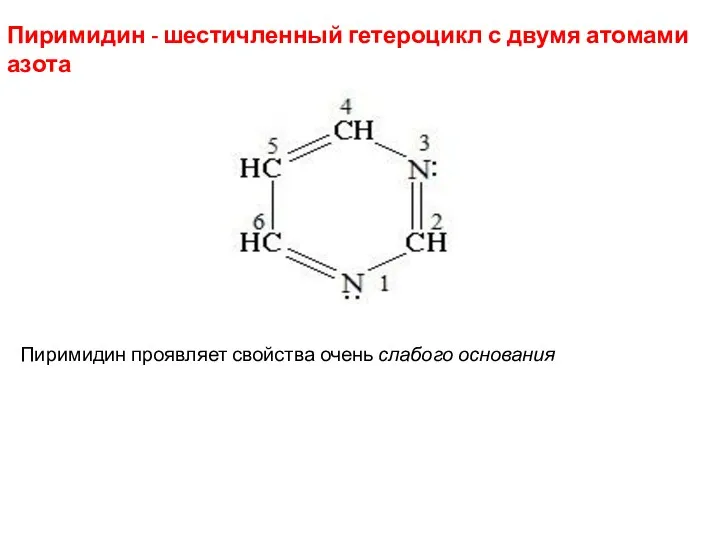
- 27. Пиримидин - шестичленный гетероцикл с двумя атомами азота Пиримидин проявляет свойства очень слабого основания
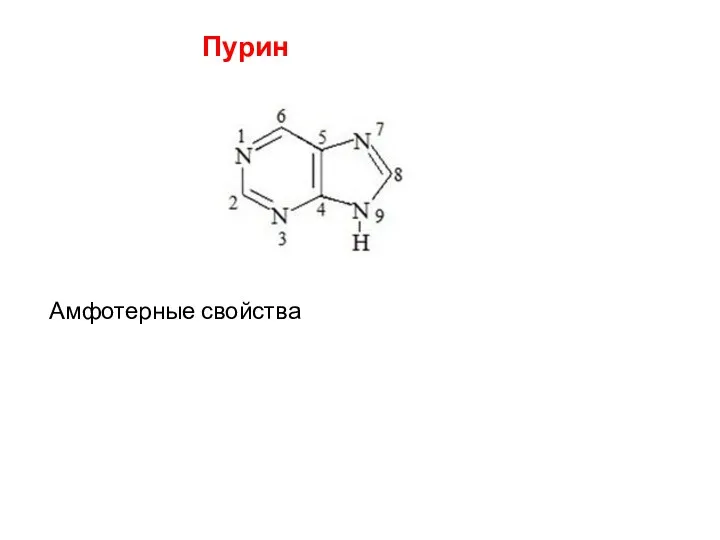
- 28. Пурин Амфотерные свойства
- 29. 5- и 6- членные ненасыщенные гетероциклические соединения обладают ароматичностью, поэтому их химическое поведение напоминает свойства ароматических
- 31. Скачать презентацию






 Ионоселективные электроды
Ионоселективные электроды Дисперсные системы. Дисперсное состояние вещества. Лекция 10
Дисперсные системы. Дисперсное состояние вещества. Лекция 10 Роль побутової хімії у житті
Роль побутової хімії у житті Мыло. Его состав и моющее действие. Синтетические моющие средства
Мыло. Его состав и моющее действие. Синтетические моющие средства Основні закони хімії.Класи та номенклатура неорганічних сполук
Основні закони хімії.Класи та номенклатура неорганічних сполук Медь и её сплавы
Медь и её сплавы Общая характеристика неметаллов
Общая характеристика неметаллов Химия - тұрмыста
Химия - тұрмыста Металдар арасындағы беттік керіліс
Металдар арасындағы беттік керіліс Теоретические аспекты
Теоретические аспекты Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Коррозия металлов
Коррозия металлов Кристаллические решётки и их виды
Кристаллические решётки и их виды Галогены. Положение в ПСХЭ Д.И. Менделеева
Галогены. Положение в ПСХЭ Д.И. Менделеева Серная кислота H2SO4
Серная кислота H2SO4 Аллотропия
Аллотропия Растворы. Процесс растворения
Растворы. Процесс растворения Общие свойства металлов
Общие свойства металлов Определение качества нефтепродуктов (на примере бензинов и дизельного топлива)
Определение качества нефтепродуктов (на примере бензинов и дизельного топлива) Алкены – непредельные углеводороды. Получение, химические свойства и применение
Алкены – непредельные углеводороды. Получение, химические свойства и применение Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Общая характеристика элементов V-А-группы. Азот
Общая характеристика элементов V-А-группы. Азот Задачник. Основные физические величины в химии
Задачник. Основные физические величины в химии Новое направление в бизнесе компании – катализаторы синтеза метанола
Новое направление в бизнесе компании – катализаторы синтеза метанола Сложноэфирная конденсация Кляйзена-Шмидта
Сложноэфирная конденсация Кляйзена-Шмидта Warm-Up
Warm-Up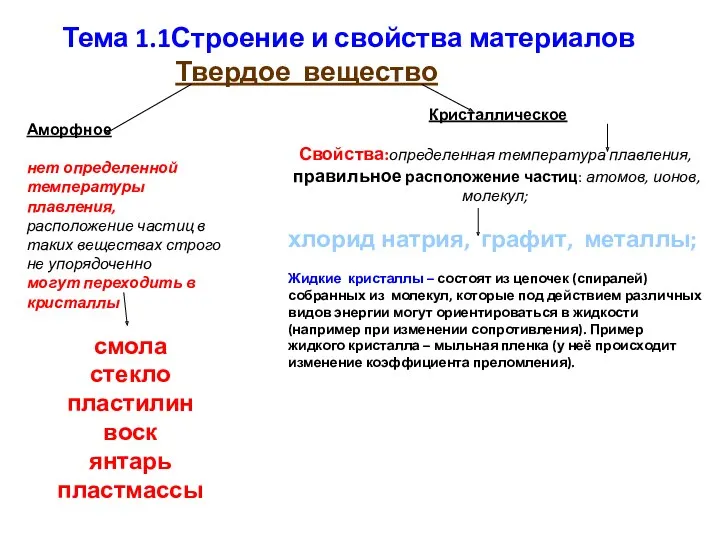 Строение и свойства материалов. Тема 1.1
Строение и свойства материалов. Тема 1.1