Содержание
- 2. УМК «ХИМИЯ» Тема лекции: Общие свойства металлов Лектор – Иванов М.Г.
- 3. Цель лекции: изложение основных понятий физических и химических свойств металлов в рамках современной химической теории Компетенции,
- 4. Нахождение в природы содержание Оксиды - Fe3O4, MnO2 Сульфиды - ZnS, FeS2 MnO2 SiO2 CaSO4.2H2O Соли-
- 5. содержание В свободном виде (самородки)- Au, Pt, Ag, Cu Нахождение в природы Pt Cu Au
- 8. Металлический блеск металлический блеск – электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как
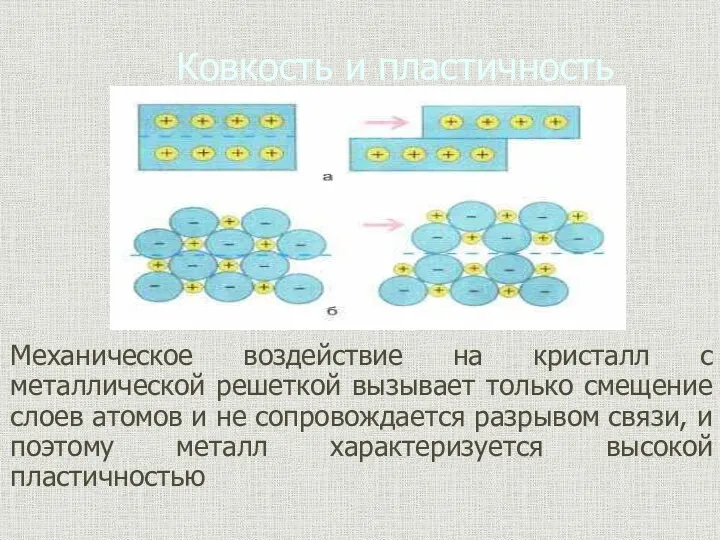
- 9. Ковкость и пластичность Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и
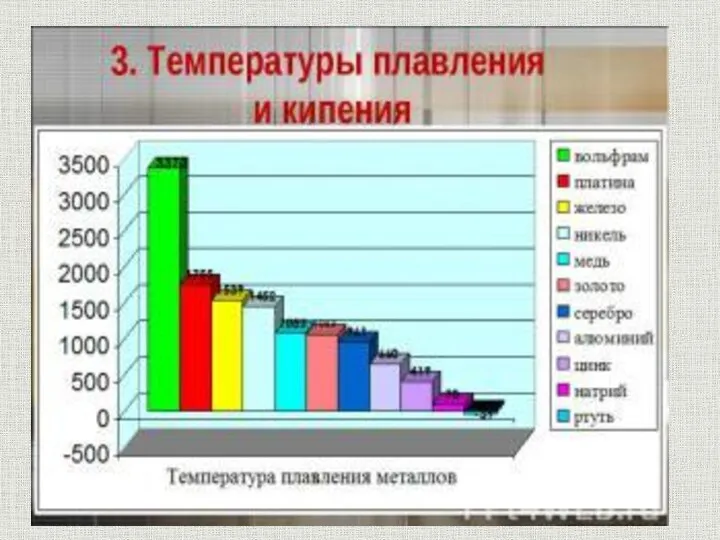
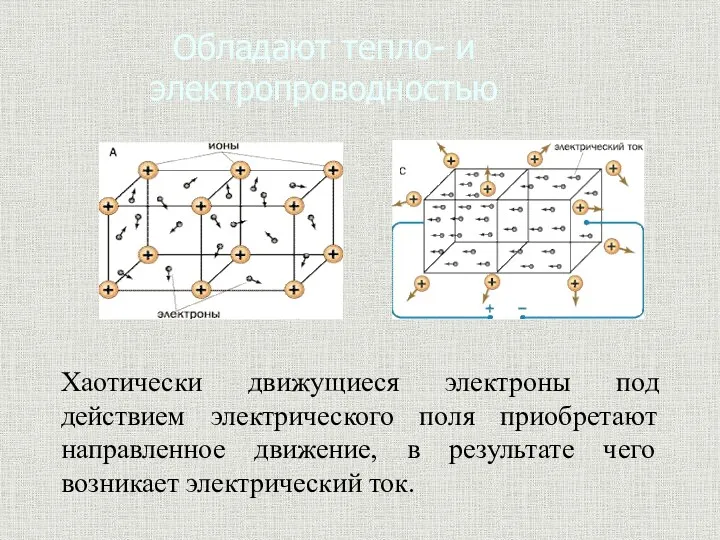
- 10. Обладают тепло- и электропроводностью Хаотически движущиеся электроны под действием электрического поля приобретают направленное движение, в результате
- 11. Ртуть Вольфрам
- 12. Тантал Литий
- 13. Серебро Платина Золото
- 14. Магнитные свойства металлов Ферромагнетики – металлы способные сильно намагничиваться и долго сохранять это свойство (Fe, Co,
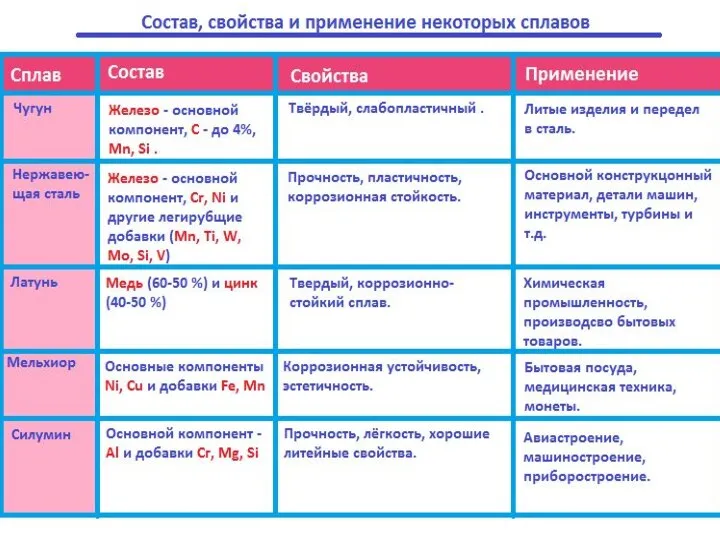
- 16. Сплавы металлов Сплавы - (твердые растворы) — это системы, состоящие из двух и более металлов или
- 17. Виды и свойства чугунов.
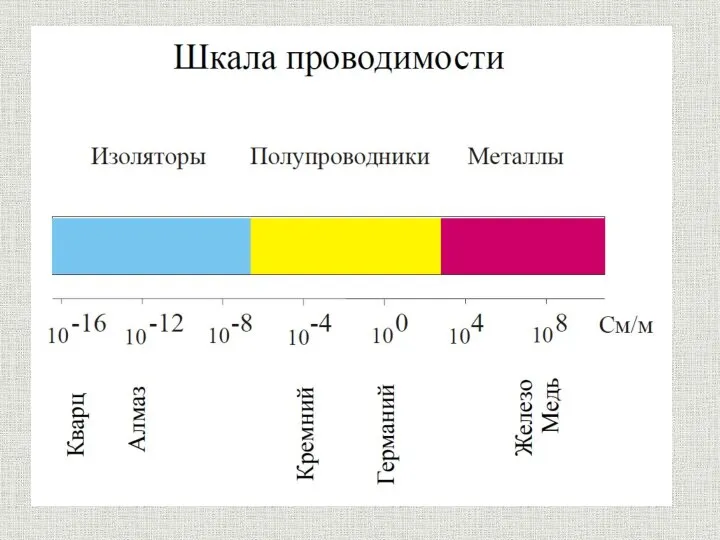
- 19. содержание Физические свойства металлов Металл Электропроводность Теплопроводность
- 20. содержание Металлическая связь Металлическая связь характерна только для металлов в твердом или жидком агрегатном состоянии
- 21. содержание Основные типы кристаллических решеток металлов а) гранецентрированная кубическая (ГЦК); б) объемноцентрированная кубическая (ОЦК); в) гексагональная
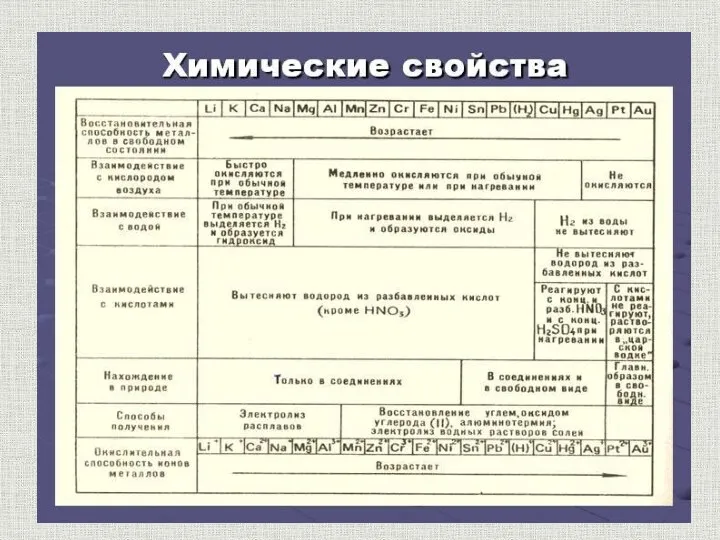
- 30. содержание Химические свойства металлов По своим химическим свойствам все металлы являются восстановителями Взаимодействие с простыми веществами
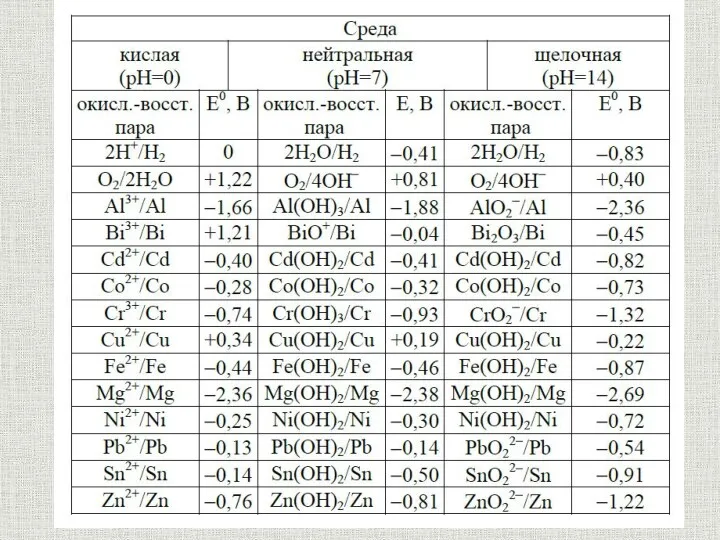
- 31. содержание Электрохимический ряд напряжений металлов Li, K, Ca, Na, Mg, Al, Zn, Cr, Fe, Pb, H2,
- 34. Взаимодействие с кислотами содержание Окислитель Н+ Анион кислоты 1. Величины стандартного электродного потенциала М; 2. Окислительной
- 36. содержание С концентрированной серной кислотой М + H2SO4конц. → Мn(SO4)M + H2O + SO2 S H2S
- 39. содержание С концентрированной азотной кислотой М + HNO3конц. → М(NO3)M + H2O + NO2 3Re +
- 40. содержание С разбавленной азотной кислотой М + HNO3разб. → М(NO3)M + H2O + NO N2O, N2
- 43. содержание Взаимодействие с водой M + H2O → M(OH)n + H2 Явление глубокого торможения окисления металла,
- 44. содержание Взаимодействие с водными растворами щелочей при pH = 14 в растворах щелочей растворяются металлы, потенциалы
- 49. Скачать презентацию














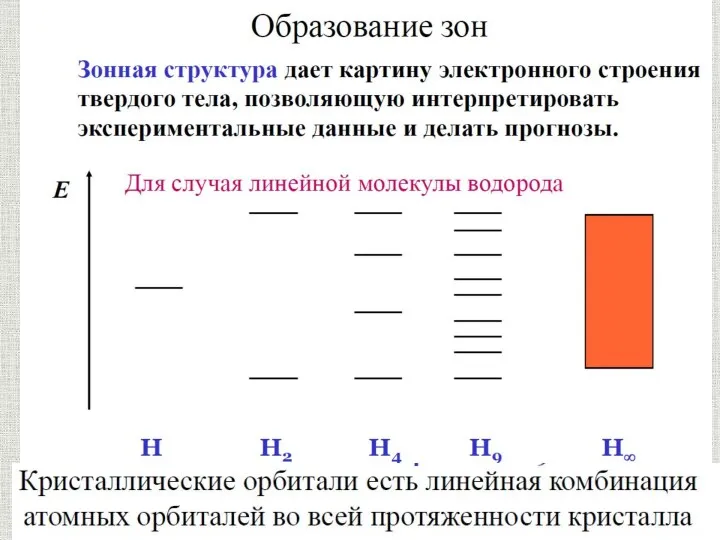
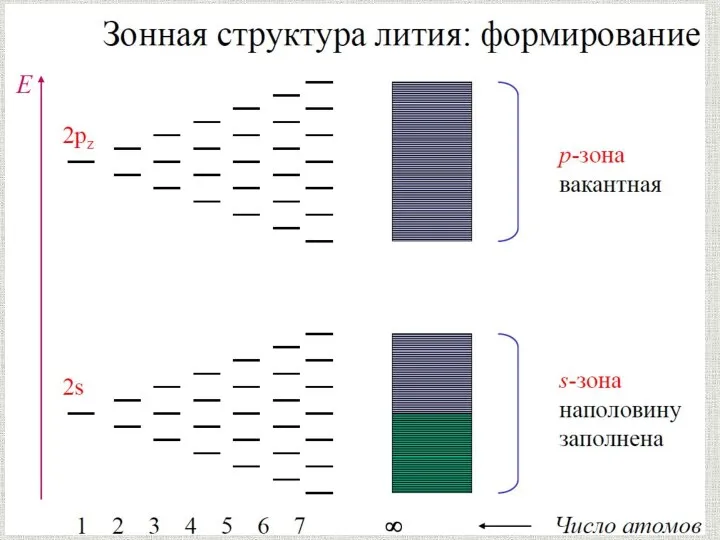
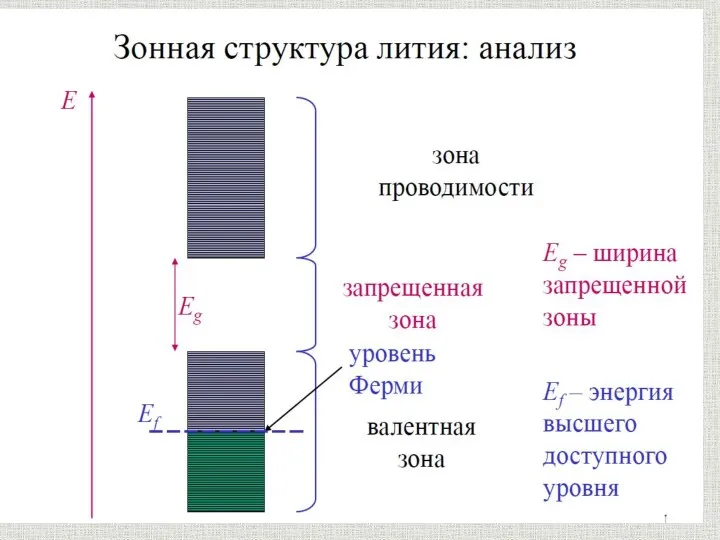
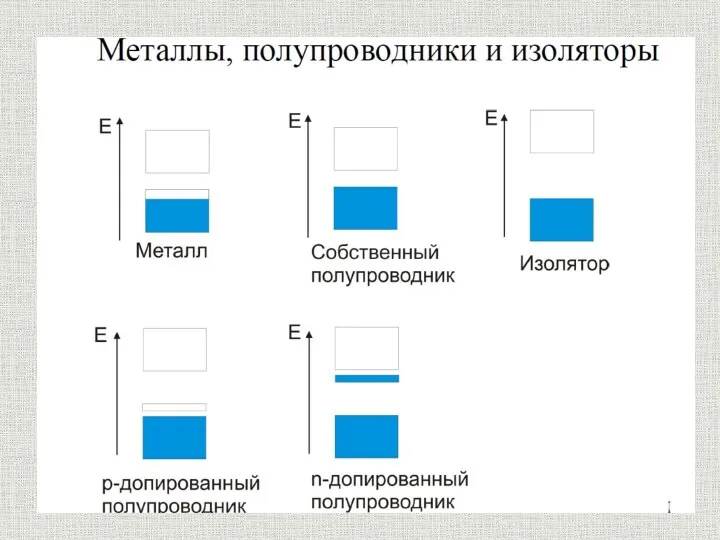
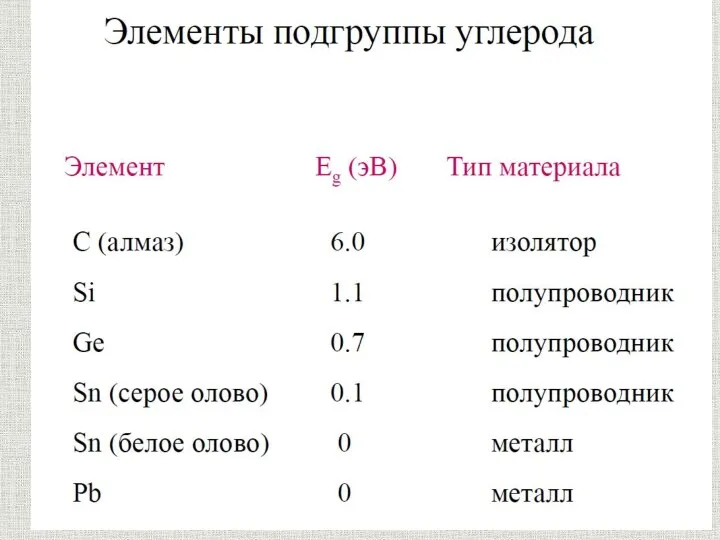
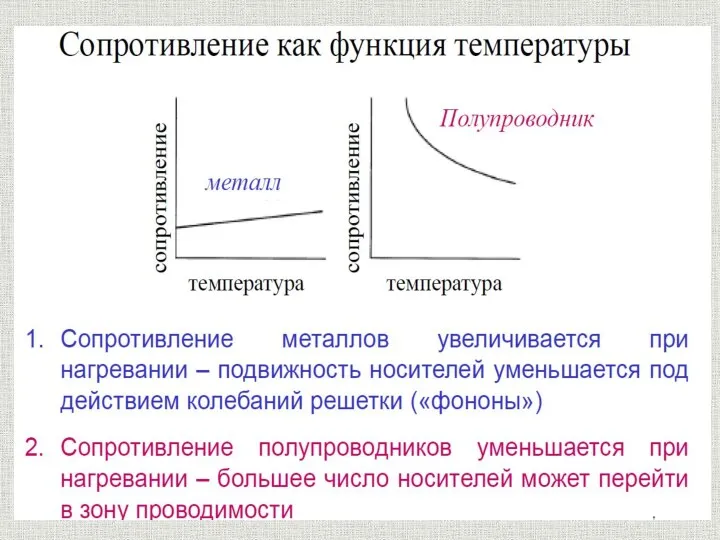














 Органолептические и визуальные методы идентификация полимера
Органолептические и визуальные методы идентификация полимера 20230315_prezentatsiya_k_uroku_elementy_ivgruppy_glavnoy_podgruppy_
20230315_prezentatsiya_k_uroku_elementy_ivgruppy_glavnoy_podgruppy_ Чистые вещества и смеси
Чистые вещества и смеси Свойства спирта и воды
Свойства спирта и воды 20230305_ammiak
20230305_ammiak Агрегатные состояния веществ. Газовые законы для идеальных и реальных газов
Агрегатные состояния веществ. Газовые законы для идеальных и реальных газов Алюминий. Природные соединения алюминия
Алюминий. Природные соединения алюминия Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов
Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов Химический элемент медь
Химический элемент медь Речовини. Молекули. Атоми
Речовини. Молекули. Атоми Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Коррозия металлов
Коррозия металлов Төменгі фосфориттерден азот – фосфорлы тыңайтқыштар алу технологиясын әзірлеу
Төменгі фосфориттерден азот – фосфорлы тыңайтқыштар алу технологиясын әзірлеу Chemical Formulas and Nomenclature of compounds
Chemical Formulas and Nomenclature of compounds Химическая термодинамика
Химическая термодинамика Характеристика химического элемента Металла на основании его положения в периодической системе Д.И. Менделеева
Характеристика химического элемента Металла на основании его положения в периодической системе Д.И. Менделеева Фосфор и его соединения
Фосфор и его соединения Железо и его свойства
Железо и его свойства Карбон
Карбон Циклоалканы. Строение циклоалканов
Циклоалканы. Строение циклоалканов Спирты
Спирты Химическая связь. 8 класс
Химическая связь. 8 класс Органічна хімія. Теорія хімічної будови. Гомологічні ряди. Алкани
Органічна хімія. Теорія хімічної будови. Гомологічні ряди. Алкани Кислотно-основное титрование
Кислотно-основное титрование Типы химических реакций
Типы химических реакций Химическая кинетика
Химическая кинетика Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов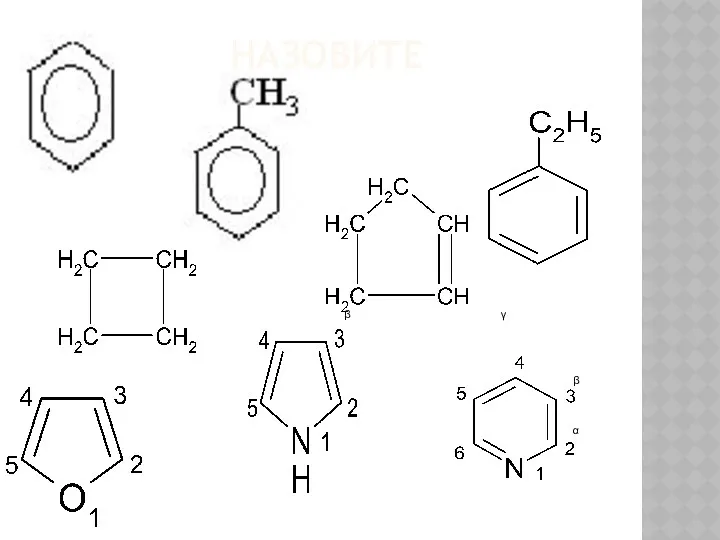 Общие сведения о гетероциклах
Общие сведения о гетероциклах