Содержание
- 2. Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема
- 3. Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов)
- 4. Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, концентрации, температуры, природы растворителя и т.д.
- 5. Закон действующих масс: Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
- 6. ХИМИЧЕСКАЯ КИНЕТИКА Коэффициент пропорциональности k есть константа скорости химической реакции. Физический смысл: Константа скорости численно равна
- 7. ХИМИЧЕСКАЯ КИНЕТИКА Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической
- 8. ХИМИЧЕСКАЯ КИНЕТИКА Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции есть
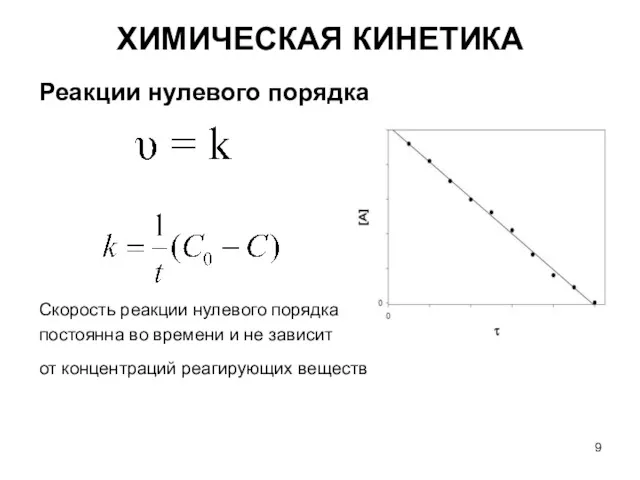
- 9. Реакции нулевого порядка Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих
- 10. Реакции первого порядка период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по
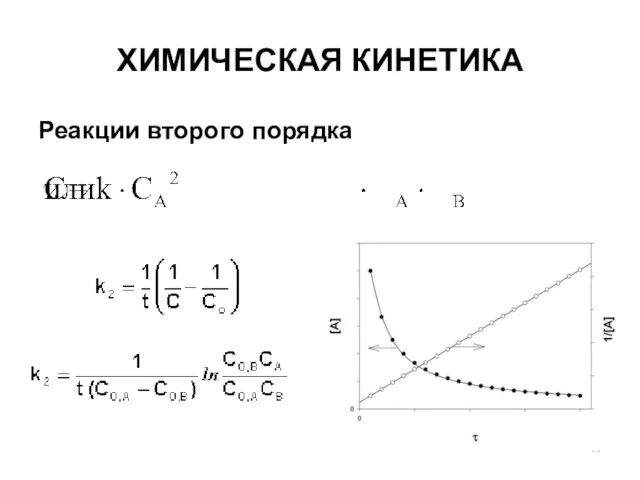
- 11. ХИМИЧЕСКАЯ КИНЕТИКА Реакции второго порядка
- 12. Молекулярность число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия. Различают:
- 13. Влияние температуры на скорость реакции Правило Вант-Гоффа При повышении температуры на каждые 10 градусов константа скорости
- 14. Теория активных столкновений (С. Аррениус) Условия для прохождения реакции: Молекулы должны столкнуться. Молекулы должны обладать необходимой
- 15. Уравнение Аррениуса столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если
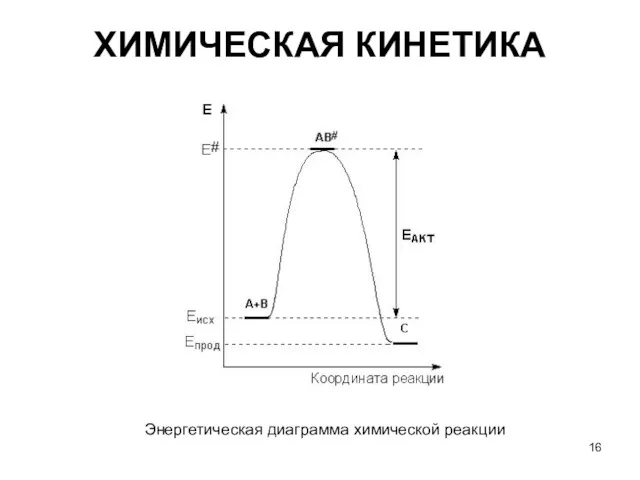
- 16. ХИМИЧЕСКАЯ КИНЕТИКА Энергетическая диаграмма химической реакции
- 17. ХИМИЧЕСКАЯ КИНЕТИКА Катализ – явление изменения скорости химической реакции в присутствии веществ, количество которых после реакции
- 18. ХИМИЧЕСКАЯ КИНЕТИКА Свойства катализаторов: Специфичность - способность ускорять только одну реакцию или группу однотипных реакций и
- 19. ХИМИЧЕСКАЯ КИНЕТИКА Причиной увеличения скорости реакции при положительном катализе является уменьшение энергии активации при протекании реакции
- 20. ХИМИЧЕСКАЯ КИНЕТИКА Энергетическая диаграмма химической реакции без катализатора (1) и в присутствии катализатора (2).
- 21. ХИМИЧЕСКАЯ КИНЕТИКА В зависимости от фазового состояния реагентов и катализатора различают: Гомогенный катализ каталитические реакции, в
- 22. ХИМИЧЕСКАЯ КИНЕТИКА Автокатализ процесс каталитического ускорения химической реакции одним из её продуктов. Особенность: реакция протекает с
- 23. ХИМИЧЕСКАЯ КИНЕТИКА Ферментативный катализ каталитические реакции, протекающие с участием ферментов – биологических катализаторов белковой природы. Особенности:
- 24. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Обратимыми называют реакции, продукты которых могут между собой взаимодействовать с образованием исходных веществ. Состояние
- 25. ХИМИЧЕСКОЕ РАВНОВЕСИЕ принцип Ле-Шателье - Брауна, или принцип подвижного равновесия если на систему, находящуюся в равновесии,
- 26. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Направление смещения равновесия в результате изменения температуры определяется знаком теплового эффекта реакции. Повышение температуры
- 27. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Повышение давления смещает равновесие в сторону реакции, идущей с образованием меньшего количества молей газообразных
- 28. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Увеличение концентрации одного из исходных веществ или уменьшение концентрации одного из продуктов реакции смещает
- 29. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Катализаторы одинаково ускоряют, как прямую, так и обратную реакции и поэтому на смещение равновесия
- 31. Скачать презентацию

























 Алкены. Химические свойства этилена
Алкены. Химические свойства этилена Растворение. Растворы. Физическая теория
Растворение. Растворы. Физическая теория Ртуть
Ртуть Электронные представления в химии
Электронные представления в химии Щелочные породы среднего состава
Щелочные породы среднего состава Производство извести в домашних условиях. 7 класс
Производство извести в домашних условиях. 7 класс Виды соли и ее значение в питании
Виды соли и ее значение в питании Оксид цинка
Оксид цинка Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Introduction to effective permeability and relative permeability
Introduction to effective permeability and relative permeability Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи
Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи Алмаз. Алмаз дегеніміз не
Алмаз. Алмаз дегеніміз не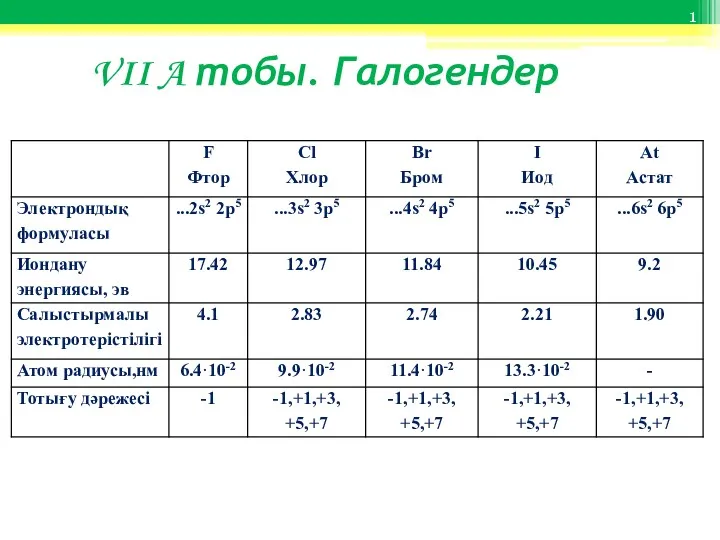 VII A тобы. Галогендер
VII A тобы. Галогендер Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Методы получения нанопорошков
Методы получения нанопорошков Химия и искусство
Химия и искусство Строение атома
Строение атома Каменный уголь. Физические и химические свойства
Каменный уголь. Физические и химические свойства Кристаллические решетки
Кристаллические решетки Фосфор и его соединения
Фосфор и его соединения Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Неметаллы
Неметаллы Равновесие в реакциях гидролиза. Лекция 6
Равновесие в реакциях гидролиза. Лекция 6 IV группа (побочная подгруппа)
IV группа (побочная подгруппа) Происхождение рибосомы, белкового синтеза и генетического кода
Происхождение рибосомы, белкового синтеза и генетического кода Кислород и оксиген
Кислород и оксиген Межлабораторные сравнительные испытания качественных параметров нефтепродуктов
Межлабораторные сравнительные испытания качественных параметров нефтепродуктов Композиционные материалы: углепластик, стеклопластик
Композиционные материалы: углепластик, стеклопластик